质子治疗临床应用研究简介
宋新宇,宋英鹏,李京,李志斌,王光宇,戴谷宇,刘亚昕,李光俊,柏森
四川大学华西医院 放疗科,四川 成都 610041
引言
1946年,美国物理学家罗伯特·威尔逊首次提出带电粒子束在医学和生物学方面应用的假设,阐述了质子治疗的物理学优势以及其他相关问题。1954年洛伦兹伯克利国家实验室完成了世界首例人体质子治疗。1955年瑞典乌普萨拉大学开展了一系列质子治疗的动物实验,并于1957年完成了首例患者治疗,乌普萨拉大学也是世界上首个在质子治疗中采用射程调节器的机构。19世纪60年代起,哈佛大学回旋加速器实验室联合麻省总院开始质子治疗临床研究,截至2002年关闭前共治疗9000多名患者,同期进行质子治疗相关研究的还有俄罗斯、日本、瑞士等国家。1990年,世界上首台医用专用的质子加速器在美国Loma Linda大学开始运行,同时安装了世界首个质子治疗旋转机架。至20世纪末期,质子治疗相关技术逐步发展,越来越多的医用专用质子设备在各大医院建造,同时商用质子加速器产业迎来了良好的发展机遇。如今正值质子治疗的新技术变革时期,质子放疗向精准治疗方向稳步前进,已成为一种先进的放疗技术[1-3],在儿童癌症放疗方面其优势更加突出。截至2019年,全球接受质子治疗的患者数已超过22万[4],并呈增长趋势。目前用于医疗的质子加速器有回旋加速器和同步加速器两种类型。质子回旋加速器可采用超导技术做到非常紧凑,直径可以做到2.5 m,如IBA的产品Proteus ONE,同时回旋加速器引出的是连续波束流,可以达到很高的剂量率。回旋加速器引出的质子能量是恒定的,所以只能通过降能器来调节束流射程。质子同步加速器占地面积相对较大,但是可以得到更好品质的束流,例如更小的束斑以及能量分散,同时引出能量可以连续变化,上海市瑞金医院质子中心采用的就是质子同步加速器。据国际粒子治疗协作委员会统计,超过60%的医用质子加速器采用回旋加速器[5]。目前,我国已有四家质子放疗中心投入运营,在建项目23个,拟建项目30个,将来质子放疗占传统放疗的比例会大幅度增加。由中国原子能研究所自主设计建设的CYCIAE-230质子超导回旋加速器(图1a)已通过治疗旋转机架测试,最高引出能量可达231 MeV,这是我国首个拥有自主知识产权的高剂量率放疗设备。2020年底,由中科院和非物质科学研究所自主研制的紧凑型超导回旋质子放疗系统加速器(图1b)顺利引出质子束流,实现高能量级超导回旋加速器关键技术突破,标志国产紧凑型超导回旋质子加速器研制成功,打破了高能量级超导回旋加速器特别是医用超导回旋加速器的进口垄断。
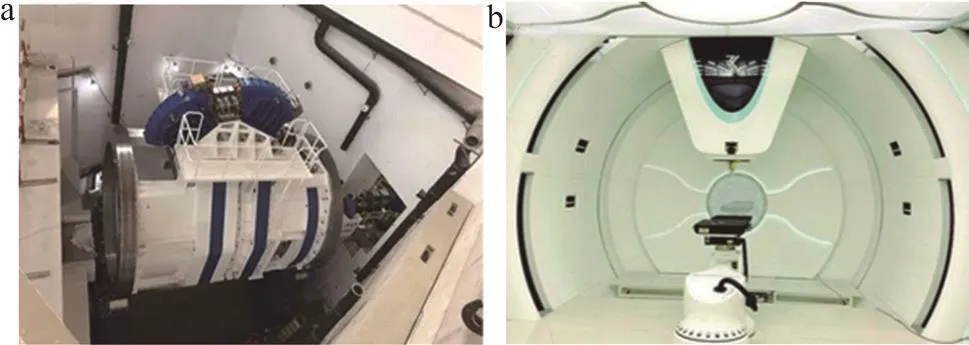
图1 用于医疗的质子加速器
1 质子治疗物理和生物学特性
1.1 质子治疗物理学特性
质子束与物质相互作用时能量沉积有如下特性,在射程初期释放能量较少且变化不大,称为坪区,在接近射程末端时释放大量能量,形成一个尖峰,称为布拉格峰(Bragg Peak),之后能量沉积迅速降为0,能量沉积曲线如图2a所示。利用这一特性,选取合适的质子能量可以将布拉格峰置于肿瘤的位置,有效地减小肿瘤前后正常组织的剂量,从而更好地保护正常组织。质子相对于核外电子质量较大,不容易被散射,可以有效地减小照射半影。

图2 质子束与物质相互作用时能量沉积特效
1.2 质子治疗生物学特性
质子放疗的生物学特性主要和其传能线密度(Linear Energy Transfer,LET)相关,粒子的LET值由粒子的种类和能量共同决定。质子在大部分能量下属于低LET射线,在肿瘤靶区附近属于高LET射线,和传统X射线放疗相比,高LET射线对DNA的破坏主要是引起双链断裂,相对于常规X射线放疗对癌细胞具有更强的杀伤力。通常用相对生物学效应(Relative Biologic Effectiveness,RBE)来表征其他射线相对于X射线对细胞的杀伤能力。射线的RBE值依赖于众多因素,包括射线LET值、照射总剂量、剂量分次数、剂量率以及损伤评价指针(End point)。目前临床上质子的RBE均值一般取1.1。
2 质子治疗临床相关技术研究进展及挑战
2.1 治疗计划系统
计划系统剂量计算的精确性依赖于物理和生物计算模型。质子与人体组织相互作用通过电磁相互作用和核反应进行能量沉积,电磁相互作用造成的能量损失和散射可以用Bethe-Bloch公式和多重库伦散射理论精确描述,核反应过程对剂量沉积贡献占比较低,采用经验公式即可得到满意的精度。目前光子放疗计划系统(Treatment Planning System,TPS)中生物学模型采用LQ模型,其结果与实验数据吻合较好。对于质子重离子放疗,LQ模型中的参数α和β依赖于离子类型和能量,这使得RBE的计算变得复杂并且容易产生误差。目前质子重离子放疗TPS中采用微剂量动力学模型[9]。
强度调制质子疗法(Intensity-Modulated Proton Therapy,IMPT)计划是当前质子治疗采用的主要模式,通过优化射束能量和强度来实现满足要求的靶区剂量分布,但受各种不确定性的影响较大[10],将不确定性纳入IMPT的鲁棒优化是显著提高IMPT剂量分布置信度和最优性的重要方法[11]。多角度照射是提高治疗计划鲁棒性有效方法,由此提出的点扫描弧形质子治疗计划依靠剂量系统和机架运动的有机配合,在机架旋转的同时出束,提供了更好的靶区剂量适形度,有效地降低了对射程不确定性的敏感性,从而提高治疗精确度[12]。质子TPS系统包含多种优化算法,鲁棒性优化算法用于处理射程不确定度、患者在分次间的摆位误差及疗程中的解剖变化及分次内的解剖学变化对剂量的影响。LET优化能够降低靶区周围危及器官高的LET值信息,降低危及器官的LET和RBE生物效应。多目标优化是质子TPS的独特模块,能够快速准确地平衡目标权重,方便医生权衡患者肿瘤和危及器官的矛盾关系,适用于光子的各治疗模式。
2.2 束流扩展技术
质子治疗中束流扩展有两种方式,分别是被动散射法和主动扫描法。被动散射法是利用散射体对束流进行散射和降能来实现横向和纵向的展宽,从而在3D靶区内形成均匀的剂量分布,双散射法是常用的被动散射法,通过两个散射体将不同能量的束流散射形成拓展布拉格峰(Spreadout Bragg Peak,SOBP)。如图2b所示,放疗计划设计中将肿瘤置于SOBP的平坦区域,该技术对器官运动敏感度低、技术实施简单,在质子放疗初期采用较多。主动扫描法又被称为笔形束扫描(Pencil Beam Scanning,PBS),将较小的束斑通过扫描磁铁在横向展宽,从而达到剂量在横向的均匀分布,纵向扫描采用降能器或者加速器主动降能[13]的方法进行控制。PBS大致可分为离散点扫描、连续点扫描和连续扫描三种方式。和SOBP方法相比,PBS具有束流利用率高、靶区剂量更加适形等优点,同时治疗时间较长,且对束流精度控制要求较高,是目前质子放疗横向宽展采用的主要方式。
2.3 图像引导技术
质子治疗中剂量分布对各种误差极为敏感,小的偏差(例如1.5 mm)可造成高达20%的剂量偏差[14],因此图像引导技术在质子治疗中尤为关键。治疗计划剂量计算前需要将CT值转化为质子相对阻止本领,采用常规CT该转化环节存在约2%~3%的误差,目前有多种改善方法,包括采用化学计量法[15]进行转换,或者采用双能CT进行成像。采用质子直接成像可以提高转化精度,这一方法的临床应用还在研究中[16]。患者摆位图像验证早期采用正交X射线成像技术,但是二维成像有其固有的局限性。目前质子治疗摆位验证多采用室内CT或者CBCT,但均有不足之处,室内CT通常为滑轨设计,即患者成像的中心点和治疗的中心点不一致,在患者运输过程中可能产生偏差;CBCT图像质量比诊断CT差,尤其当涉及自适应放疗时,CBCT图像质量目前难以达到临床要求,有待进一步提升。实施治疗前的射程验证也依赖于图像引导技术,目前多采用室内CT完成,在研的技术有PET/CT成像技术[17-18]和瞬发γ成像技术[19-23]。
MRI能实现无电离辐射的快速、高软组织对比度成像,将MRI和质子治疗整合到MRiPT系统中,较X射线更具提高粒子治疗精度的潜力[24]。MRiPT尚面临许多挑战,如MRI与质子治疗系统之间的电磁相互作用会降低MRI成像质量和质子束传输、剂量畸变等。
2.4 运动管理技术
患者在接受治疗时身体的运动会导致解剖学变化,主要包括呼吸运动、心跳、膀胱充盈以及肠胃蠕动等,在笔形束扫描模式下,这些运动会导致实际剂量分布和预期不一致,这一现象被称为interplay效应[25],从而导致治疗的效果变差[26-27],因此我们需要对这些运动进行管理。运动管理办法主要有以下几种:采用4D图像、腹压板、深呼吸屏气和门控技术。采用4D图像可以简化治疗流程,但是会增加靶区周围危及器官的照射剂量。通过使用腹压板可以减小呼吸和心跳的运动幅度,从而改善interplay效应。深呼吸屏气是让患者深吸一口气后屏气30 s左右进行治疗,可以较好地改善呼吸运动带来的剂量偏差,该技术对患者身体条件有一定要求。门控技术通过将呼吸曲线与加速器出束联动实现,设定一个允许的呼吸运动幅度,当呼吸曲线位于幅度内时加速器出束治疗,在允许幅度外加速器停止出束,门控技术同时实现了患者治疗的舒适度和精准性,为了进一步改善interplay效应,PSI发展了多重扫描技术[28]。
2.5 FLASH治疗
FLASH治疗是指采取超高剂量率(≥40 Gy/s)照射肿瘤的一种新型治疗方式,FLASH治疗在不影响对肿瘤细胞杀伤效果的前提下,实现了对正常组织的更好保护,该现象被称为FLASH效应。近几年FLASH效应在临床方面的潜在应用引起了医疗界的广泛关注。目前FLASH效应背后的生物学机制尚不明确,当前提出的假说包括氧耗竭[29]、DNA损伤通路的差异性激活[30]以及局部组织氧耗竭导致的反应性有机过氧化氢物的形成[31]等。首例人体FLASH研究已在一名经历多次常规照射的皮肤淋巴瘤患者身上开展,并获得了良好的效果[32]。FLASH治疗距离临床应用还有很长的路要走,除了其背后的生物学机理尚不明确以外,还存在各种实施相关技术挑战[33]。日前,瓦里安宣布获得FDA批准的首个FLASH疗法临床试验的研究型器械豁免,研究招募了十名疼痛性骨转移成年患者,将以实验性治疗模式进行高剂量率放射治疗,评估FLASH治疗疼痛性骨转移的毒性、止痛效果及辐射副作用,还将评估治疗的工作流程可行性。这是第一组人体临床试验,使学界能够评估临床环境中提供质子闪射的可行性。
3 总结
相比传统放疗,质子治疗能更好地保护正常组织,可以为癌症患者提供更优的治疗效果,尤其是儿童癌症患者。经历半个多世纪的发展,质子治疗相关技术取得了瞩目的成果,全球质子治疗中心逐年增加。同时仍有诸多技术问题有待解决,包括射程不确定性、质子成像、质子FLASH效应等。随着质子放疗相关技术的发展和进步,质子加速器系统将迈向高精确化、设备集成化、小型化和智能化[34]。目前我国的质子治疗事业尚处于发展阶段,有待相关科研院所、企业以及医院共同努力,推动我国质子治疗事业的发展。

