结核分枝杆菌利福平耐药分子药敏结果与其表型药敏差异的研究
罗嘉韵,余明均,廖卫平
1.佛山市第四人民医院呼吸与危重症医学科,广东 佛山 528000;2.佛山市第四人民医院.检验科,广东 佛山 528000
结核病是全球公共卫生组织重点关注的慢性传染性疾病,主要是由结核分枝杆菌感染所引起。全球感染结核分枝杆菌人数已达到十几亿,每年新发病例达千万,死亡病例达到百万,尤其是耐药菌株的流行,造成疫情日益严重[1-2]。据不完全统计,我国耐多药/耐利福平初治耐药率约为6.6%,复治耐药率为30%[3]。利福平是一种广谱抗生素,由利福霉素类半合成,属一线抗结核药物。但利福平耐药是影响抗结核效果的主要因素,通常有80%以上对利福平耐药性菌株也对异烟肼产生一定的耐药性,并逐渐成为结核病耐药性的标志物[4-5]。因此掌握利福平耐药机制,有助于结核病的早期诊断、准确控制。既往临床药敏试验测定常用罗氏试验,但耗费时间长,菌株分离培养需要3~8周,随后再耗费4 周时间才能得到药敏结果,难以在短时间内取得理想、可靠、准确的药敏结果。随着检测技术的快速发展,分子检测技术逐渐被用于菌株检测,并取得显著效果。但在临床实际工作中,分子技术与传统药敏试验存在诊断结果差异性,给临床治疗带来困难。本研究就结核分枝杆菌利福平耐药的分子药敏与其表型药敏检测的差异性进行分析,以期为临床治疗提供一定的参考依据。
1 资料与方法
1.1 一般资料 从2018年1月至2020年12月在佛山市第四人民医院进行Xpert MTB/RIF 检测的4620例患者中筛选出480株结核分枝杆菌。标本每人1 份,H37Rv 标准菌株来自中国药品生物制品鉴定所。培养菌株标本收集患者痰液、肺泡灌洗液进行分离获得,按照实验规程操作。纳入标准:①患者年龄≥18 岁;②符合结核诊断标准[6];③同意纳入本研究。排除标准:①患者年龄<18岁;②合并肝肾功能衰竭、血液系统疾病、自身免疫性疾病、恶性肿瘤患者。本研究经医院伦理委员会批准。
1.2 仪器与试制 实时荧光PCR 检测仪(Xpert MTB/RIF,美国Cepheid),液体培养仪器与配套试剂(Bactec MGIT960,美国BD),利福平耐药试剂盒及干粉(美国Sigma公司)。
1.3 检测方法 所获得的菌株置入100 L菌液内,分别接种在罗氏培养基,连续培养4周。4周后,用接种环刮取培养基上的一层菌落,加入已添加生理盐水的离心管内,85℃下灭活20 min。灭活后的菌液离心5 min后丢弃上清液,用生理盐水清洗,再100℃下金属浴10 min,超声15 min,离心后,留取上清液,设置DNA模板。设计rpoB基因引物序列,测定其基因型。利用Xpert MTB/RIF、Bactec MGIT960测定对利福平的耐药性,获取耐药表型数据。Xpert MTB/RIF:留取标本置入前处理管内,添加标本体积的SR处理液2 mL,涡旋振荡,30 s,静置60 min,取处理药品2 mL,缓慢添加至反应盒内,放置检测模块,再自动化检测,读取检测结果。Bactec MGIT960:取0.5 mL处理后标本,添加培养管,培养阳性标本行药敏试验。药敏试验是根据分离出的结核分枝杆菌,观察其生长情况,并与未药物的对照管做对比,若菌株在对照、药物培养管内均存在生长,则有耐药,若仅在对照管内生长,则有敏感性。采用仞天青显色法检测最低抑菌浓度(MIC)。
1.4 观察指标 (1)以罗氏培养法作为金标准,比较 Xpert MTB/RIF、Bactec MGIT960 的检测效能;(2)观察基因型与表型特征耐利福平不一致的检测结果;(3)比较表型、基因型利福平耐药率;(4)分析不同基因突变型菌株的MIC表达。
1.5 统计学方法 应用SPSS20.0 统计软件进行数据分析。计量资料以均数±标准差()表示,组间比较采用t检验,计数资料比较采用χ2检验,一致性采用Kappa一致性检验。均以P<0.05为差异有统计学意义。
2 结果
2.1 检测效能 480 株分离的结核分枝杆菌利福平耐药菌株52 株(10.83%)/敏感菌株428 株(89.17%),Xpert MTB/RIF 检出耐药菌株 92.31%(48/52),敏感度为95.83%,特异度为98.61%;Bactec MGIT960 检出耐药菌株96.15%(50/52),敏感度为98.00%,特异度为99.30%,两者检出的灵敏度、特异度比较差异均无统计学意义(P>0.05),见表1和表2。

表1 Xpert MTB/RIF检出效能比较(例)

表2 Bactec MGIT960检出效能比较(例)
2.2 检测药敏不一致结果 52 株耐利福平菌株,RRDR区rpoB 基因突变46 株,6 株无氨基酸突变,Xpert MTB/RIF检测耐药而Bactec MGIT960检测敏感有35 株,2 株无氨基酸突变;Xpert MTB/RIF检测利福平敏感而Bactec MGIT960 检测耐药的变异菌株8 株,4株无氨基酸突变,一致性检验Kappa值为0.795,差异有统计学意义(P<0.05)。
2.3 突变位点 RRDR 区 rpoB 基因突变 46 株(88.46%),缺失突变位点分别有 508、509、526、511、533、531、516,其中 508、509 位点突变缺失部分属GCA-CA,除去缺失突变,其他突变改变情况,见表3。
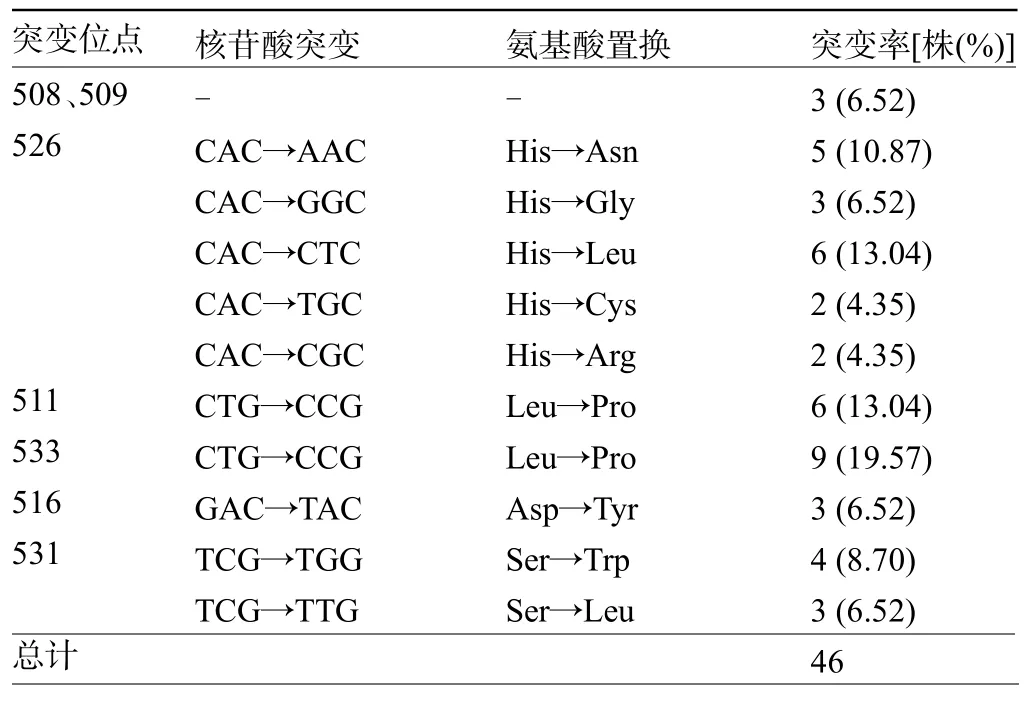
表3 46株RRDR区rpoB基因突变分析
2.4 不同突变型利福平MIC 水平测定 敏感:His526Asn、His526Gly、Asp516Tyr 突变类型菌株的MIC 水平均低于0.25µg/mL;高水平耐药:His526Leu突变MIC水平为32µg/mL,低水平耐药MIC值为0.5~4.0µg/mL;His526Arg突变菌株:低水平耐药MIC值为1 µg/mL。Leu511Pro 突变:低水平耐药:MIC 水平为1~2 µg/mL;Leu 533Pro 突变:敏感:MIC 水平 0.25~0.5 µg/mL;508、509 位缺失突变:低水平耐药:MIC 水平2~4µg/mL,见表4。
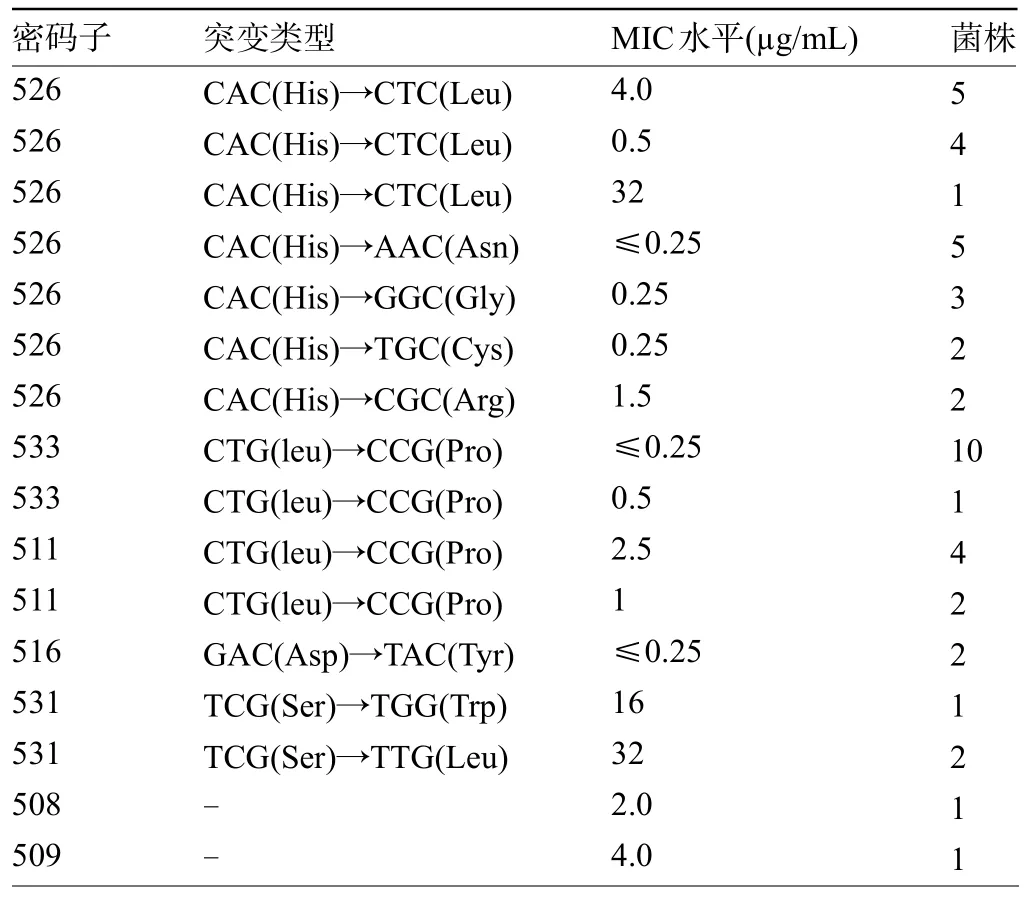
表4 不同突变类型菌株MIC水平测定
3 讨论
近年来,结核病耐药性逐渐增加,主要是因化疗方案应用不合理、依从性差等原因导致。尤其是耐多药结核病病例的广泛增多,使结核病的疫情传播、诊治方案更加严峻,大大地增加了结核病防治难度。通常耐药结核病是对利福平或异烟肼等药物耐药,而耐多药在体外证实对利福平、异烟肼等药物存在耐药性[7]。其中利福平是治疗结核病的一线药物,由链霉素产生的广谱抗生素,是耐药结核病的主要标志性药物。掌握患者耐利福平机制,有助于早期诊断及控制结核病的发生、进展,并未临床治疗方案的选择提供参考。结核分枝杆菌主要的耐药机制较多,譬如靶基因结构改变、细胞壁的通透性异常改变、失活酶、代谢过程改变等,其中利福平耐药产生的主要机制是药物作用靶基因异常突变所致[8]。通常结核分枝杆菌的RNA聚合酶参与到细胞转录、RNA 延伸途径,是菌株存活、生长的必需产物[9]。利福平的药理作用机制是经过非共价键,特异性结合作用于RNA 聚合酶亚基介质,该介质是菌株DNA 生成的重要因子,通过下调RNA 聚合酶活性,阻断细胞转录、RNA 延伸途径,抑制细菌蛋白质的合成过程,发挥显著的抗菌效果[10]。由于RNA聚合酶由5个亚基单位组成,其基因编码有rpoA、rpoB、rpoC、rpoZ,在基因编码异常、基因突变造成RNA聚合酶亚基结构异常改变,以此产生利福平耐药性[11]。因此在检测利福平耐药时,可根据基因分子靶标作为利福平耐药测定的主要方法。
Xpert MTB/RIF 是检测利福平耐药的主要方法,操作简便、快速准确,受到临床重点关注。随着耐药分子机制的深入,利福平耐药分子技术得到极大进展,其中Bactec MGIT960进行分子表型测定,也在极大程度上提高利福平耐药性诊治水平[12]。本研究中Xpert MTB/RIF检出耐药菌株92.31%,Bactec MGIT960则为96.15%,两者灵敏度、特异度比较差异均无统计学意义;Xpert MTB/RIF、Bactec MGIT960检测一致性检验的Kappa 值为0.795。据刘立宾等[13]报道,将Bactec MGIT960 的药敏检测结果作为金标准,Xpert MTB/RIF 检出敏感率为96.21%,且药敏结果的一致性为0.794。因此两种方法对检测利福平耐药有积极意义。两者间的检测结果存在不一致性可能是因其他原因造成利福平耐药,不单单是因基因突变导致药物耐药产生。此外,BACTEC MGIT960同Xpert MTB/RIF相比较,其仍然存在耗时较长的不足,难以充分满足临床诊断的需要。有研究指出,结核分枝杆菌耐药产生主要是因rpoB 基因突变导致,基因突变造成编码RNA 聚合酶异常突变,引起氨基酸置换、空间构象改变,以此产生利福平耐药[14]。本研究中52 株耐利福平菌株,RRDR区rpoB基因突变46株,6株无氨基酸突变,rpoB基因突变、缺失突变位点分别有508、509、526、511、533、531、516。通常531、526、516是常见的基因突变位点,以碱基置换为主要突变类型,而插入、缺失较少。在菌株耐药性测定时,rpoB 基因不同位点突变所产生的利福平耐药值也不同,本研究对不同突变型利福平MIC 水平进行了测定,其中His526Asn、His526Gly、Asp516Tyr突变类型菌株的MIC水平均低于0.25 µg/mL,为药物敏感。其中rpoB 基因508、509位缺失是造成利福平低耐药的主要原因,而基因His526Asn、His526Gly、Asp516Tyr 突变是唯一致利福平敏感的主要基因编码,但也会产生利福平高耐药。可能是患者感染混合菌株,造成不同基因突变使利福平耐药也存在差异[15]。因此,由于XpertMTB/RIF 所采用精密设计的分子探针可以高效检测到rpoB 核心区基因突变情况,对鉴定RFP 耐药菌株具有较大帮助。
综上所述,不同分子检测方法对利福平耐药测定有一定意义,但分子药敏与表型药敏检测也有一定的差异性,临床上可根据具体情况将两者作为利福平耐药检测的有效选择,以指导抗结核药物的选择。在结核分枝杆菌经利福平耐药性测定,利福平耐药性较高,rpoB基因突变是其主要改变原因,不同基因突变类型,使利福平耐药水平也存在差异,但其结果依然无法肯定药敏方法的可靠性,需临床进一步研究探讨。

