建兰品种资源数量性状与分组性状的DUS判定
钟声远,钟海丰,陈宇华,陈剑锋,张 荟,钟淮钦,林 兵,刘中华,邱思鑫,黄敏玲
(1福建省农业科学院 作物研究所,福建 福州 350013;2农业农村部 植物新品种测试福州分中心,福建 福州350013)
建兰(Cymbidiumensifolium)是兰科(Orchidaceae)兰属(Cymbidium)多年生草本植物,花香淡雅,姿态优美,因其花期较长且可多次开花,又名四季兰。建兰主要分布在中国福建、四川、广西、广东、台湾等地,福建是建兰的主要产区,有着悠久的栽培历史。建兰性喜阴,忌强光直射,耐寒性较差,喜温暖湿润和半阴环境,忌干燥,适宜采用富含腐殖质的疏松肥沃土壤。建兰除了观赏外,还可入药,有极高的园艺和药用价值[1-3]。
植物品种特异性(Distinctness)、一致性(Uniformity)和稳定性(Stability)测试(简称DUS测试)是定义植物品质的科学方法,也是目前我国作物品种管理、新品种保护、育种评价的重要技术支撑[4-5]。DUS测试指南是新品种审查测试的技术基础和授权的科学依据[6],在目前的DUS测试中,除了部分作物品种利用分子标记等方法进行品种鉴定外,大部分作物的DUS测试还是以传统的表型性状观察和形态学测量为主[7]。其中数量性状是植物形态描述的主要指标体系,数量性状的评价标准是开展种质评价和DUS测试的重要内容[8-9]。数量特征通常是基因型组合的结果,因此在不同环境中表达的变化程度有所不同[10-11],容易受到年度、区域、环境等因素的影响[12]。为了建立科学的评价与分级体系,有必要对数量性状的变异情况及分级标准进行研究分析[13]。通常在进行DUS测试时,为了修正环境条件对不同表达状态的影响,同时种植标准品种,参照标准品种的表现来给测试品种分级,但在实际测试过程中,由于标准品种过于陈旧等原因而很难收齐,因此数量性状分级更多地是根据测量数据进行划分[14]。
对建兰性状的研究中,艾叶等[15]基于27个建兰数量性状,从226个建兰品种中筛选了包含60个品种的核心种质;艾叶等[16]还利用建兰植株、花部和叶部形态3个方面共21个评价因子,基于层次分析法构建了建兰品种观赏价值评价模型,结果表明花部形态是评价建兰观赏价值的核心要素;王宏利等[17]观测了30份建兰种质资源的25个表型性状,通过变异系数分析、主成分分析和聚类分析,对供试材料进行了聚类和花部性状的综合评分。
针对建兰数量性状进行分级时,具体分级过程中采用级差大于2倍LSD0.05(最小显著差数),可以有效避免由于群体内部变异造成最终分级结果的偏差[18],然后再通过主成分分析对分组性状进行判定。李季鸿[19]采用极差法对142个兰属品种的10个数量性状进行了分级,并基于植物新品种DUS测试照片的要求,对兰属品种提供了规范的拍摄指导。分组性状主要用于品种分组,利用分组性状可以避免在DUS测试中将性状差异较大的近似品种与申请品种相邻种植,对于品种类群划分和近似品种筛选有重要意义[20]。张鹏等[21]通过观测15个数量性状,对48个蝴蝶兰品种的数量性状和分组性状进行了DUS判定;徐珍等[22]对45个金针菇品种的21个性状进行分析,对12个数量性状进行分级并通过形态性状的聚类筛选出分组性状。 但总体来看,目前关于建兰DUS测试及数量性状分级的研究报道尚比较少。
DUS测试指南不仅是DUS测试机构进行测试的技术手册,而且是主管机构进行检查的技术标准,研制测试指南对促进中国植物新品种保护的发展和提高在国际植物新品种保护领域的地位均有重要意义[23]。 目前暂无建兰的DUS测试指南,统一使用的是《植物新品种特异性、一致性和稳定性测试指南:兰属》(NY/T 2441-2013)[24](以下统称《兰属植物DUS测试指南》),《兰属植物DUS测试指南》中包含建兰、蕙兰、墨兰等,在性状表达上有部分差异,因此应根据建兰具体的性状表达,加快推进建兰测试指南的研制。本试验旨在通过对收集的32份建兰种质资源数量性状的分析,确定数量性状的分级和分组性状,以期为建兰种质资源的开发利用提供参考,并为建兰测试指南的研制提供理论依据。
1 材料与方法
1.1 供试材料
试验材料为收集保存于农业农村部植物新品种测试福州分中心的32份建兰种质资源。
1.2 主要数量性状的观测
主要对《兰属植物DUS测试指南》中列出的18个数量性状进行测试,为了更好地进行分级,对该指南中的群体目测性状,即植株大小和假鳞茎大小也进行了测量。本试验所有性状的测量均以单株为单位进行,每个品种测量10株,每株取样数量为1个,测试的时间、部位、方法和要求严格按照《兰属植物DUS测试指南》执行,详见表1。

表1 建兰品种资源数量性状及测量方法Table 1 Quantitative characteristics and measurement methods of Cymbidium ensifolium cultivars
1.3 数据统计与分析
1.3.1 数量性状表达状态的划分和相关性分析 通过Excel计算出18个数量性状的平均值,根据《兰属植物DUS测试指南》中的分级数,将此平均值设定为中间级数的中位数,依照级差大于2倍LSD0.05(最小显著差数)的原则,分别向两端极值区间进行划分,每个分级包含的区间均不小于2倍LSD0.05,之后根据该指南得到各数量性状的分级区间,并用数字表示。划分区间后,根据分级范围对测量数据进行计数,并计算其在各区间的分布频率。
相关性分析是对2个或多个具备相关性的变量元素进行分析,从而衡量两个变量因素相关关系的密切程度,本研究运用SPSS软件进行各数量性状间的相关性分析。
1.3.2 数量性状稳定性和变异情况分析 用Excel计算18个数量性状的最大值、最小值、平均值、变异幅度、品种内变异系数和品种间变异系数,其中变异系数(CV)的计算公式为CV=(标准差/平均值)×100%。
计算单个品种每个性状观测数据的平均值、标准差以及变异系数,再求该性状在所有建兰种质资源中变异系数的平均值,即为该性状的品种内变异系数。根据单个品种每个性状观测数据的平均值,计算出该性状在所有品种中的平均值、标准差以及变异系数,该变异系数即为品种间变异系数。
1.3.3 数量性状主成分分析和分组性状的判定 主成分分析法是通过降维,将多个变量简化为较少的几个综合性指标,以减少数据过多或重叠带来的不便,但仍可再现原有变量和综合指标的关系。因此,本研究利用主成分分析法作为确定分组性状的科学方法[25],通过对18个数量性状进行主成分分析,以辅助DUS测试的分组性状的判定。
2 结果与分析
2.1 建兰品种资源数量性状的等级划分和相关性
2.1.1 等级划分 根据《兰属植物DUS测试指南》中的分级数,将18个数量性状划分为3,5,9级表达状态,计算出各数量性状的平均值和LSD0.05,据此对各数量性状的分级区间进行划分,结果见表2。
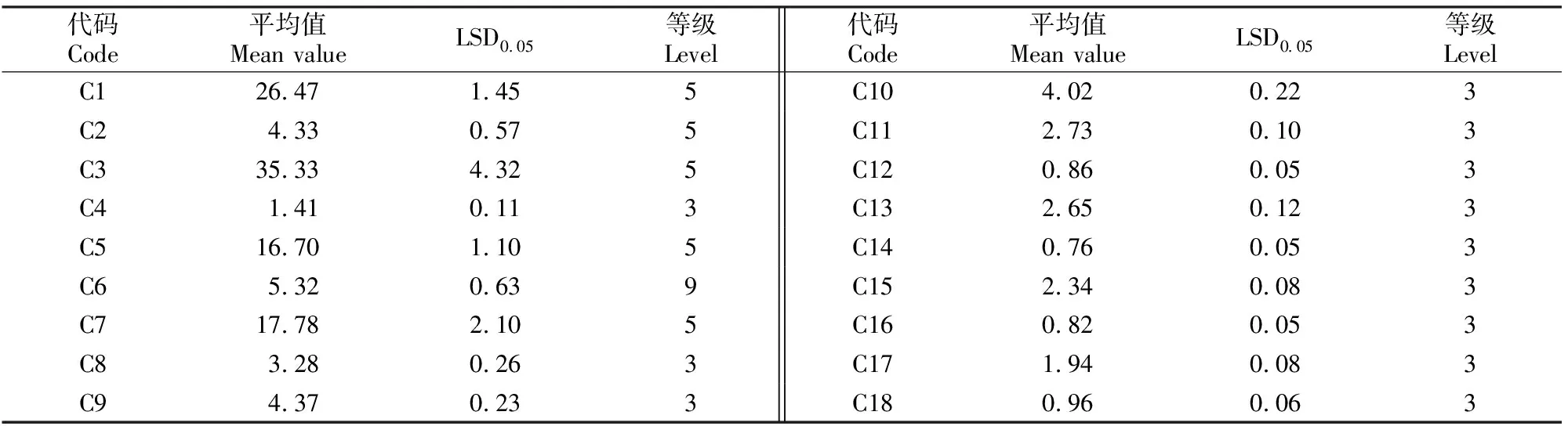
表2 建兰品种资源数量性状的等级划分Table 2 Classification of quantitative characteristics of Cymbidium ensifolium cultivars
参考《兰属植物DUS测试指南》并结合建兰实际测试情况,18个数量性状中叶片数(C2)由5级改为3级,花序花数量(C6)由9级改为5级,具体分级范围及各级分布频率见表3,其中植株大小(C1)、叶长度(C3)、假鳞茎大小(C5)、花序花数量(C6)和花序梗长度(C7)共5个数量性状划分为5级,其余13个数量性状均划分为3级。
根据建兰品种资源数量性状的分布频率(表3),可以发现,18个数量性状除了植株大小(C1)分布频率最高的为代码4的区间,其余数量性状分布频率最高的均为代码5区间,分布频率呈中间向两侧减少的趋势。说明植株大小(C1)的分布频率是稍微向左的偏态分布,其余17个数量性状的频率分布较为符合中间多两头少的正态分布,但不同性状的峰度高低不同。

表3 建兰品种资源数量性状分级范围与分布频率Table 3 Classification range and distribution frequency of quantitative characteristics of Cymbidium ensifolium cultivars
2.1.2 相关性分析 由表4可知,植株大小(C1)与叶片数(C2)和花序梗粗(C8)呈显著正相关,与叶长度(C3)和花序花数量(C6)呈极显著正相关;叶长度(C3)与中萼片长度(C11)呈显著正相关,与叶片数(C2)、花序梗粗度(C8)、花长度(C9)、花宽度(C10)、侧萼片长度(C13)、花瓣长度(C15)、唇瓣长度(C17)呈极显著正相关,相关系数为0.453~0.518。在花器官数量性状中,花长度(C9)、花宽度(C10)、中萼片长度(C11)、侧萼片长度(C13)、花瓣长度(C15)、唇瓣长度(C17)间两两呈极显著正相关,相关系数为0.752~0.946,其中花瓣长度(C15)与唇瓣长度(C17)间的相关系数最高,为0.946;中萼片宽度(C12)、侧萼片宽度(C14)和花瓣宽度(C16)间两两呈极显著正相关,相关系数为0.761~0.843;侧萼片长度与侧萼片宽度呈显著正相关(0.376),唇瓣长度与唇瓣宽度呈极显著正相关(0.505),而中萼片和花瓣的长度与宽度之间相关性不显著。

表4 建兰品种资源各数量性状间的相关性Table 4 Correlation among quantitative characteristics of Cymbidium ensifolium cultivars
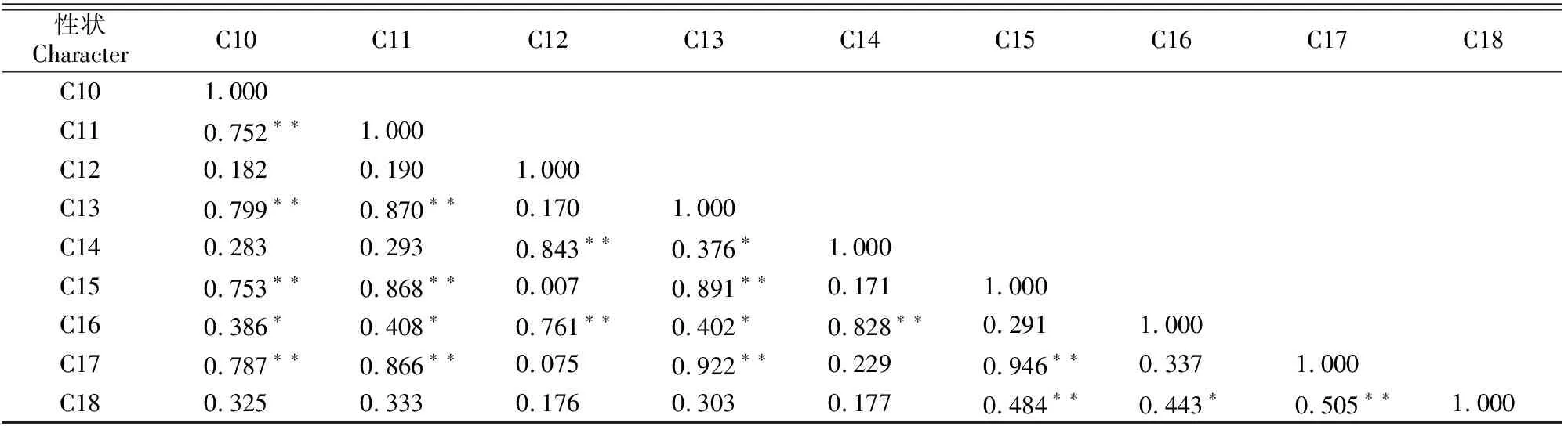
表4(续) Continued table 4
2.2 建兰品种资源数量性状的稳定性和变异情况分析
32个建兰品种的18个数量性状的最大值、最小值、平均值、变异幅度、品种内和品种间变异系数见表5。表5结果显示,建兰各数量性状在品种内的变异系数为3.36%~12.10%,均小于15%,说明各性状在品种内的稳定性较高。品种内变异系数最大的是叶片数(C2),最小的是花瓣长度(C15),叶片数(C2)、叶长度(C3)、花序花数量(C6)在品种内的变异系数均大于10%。
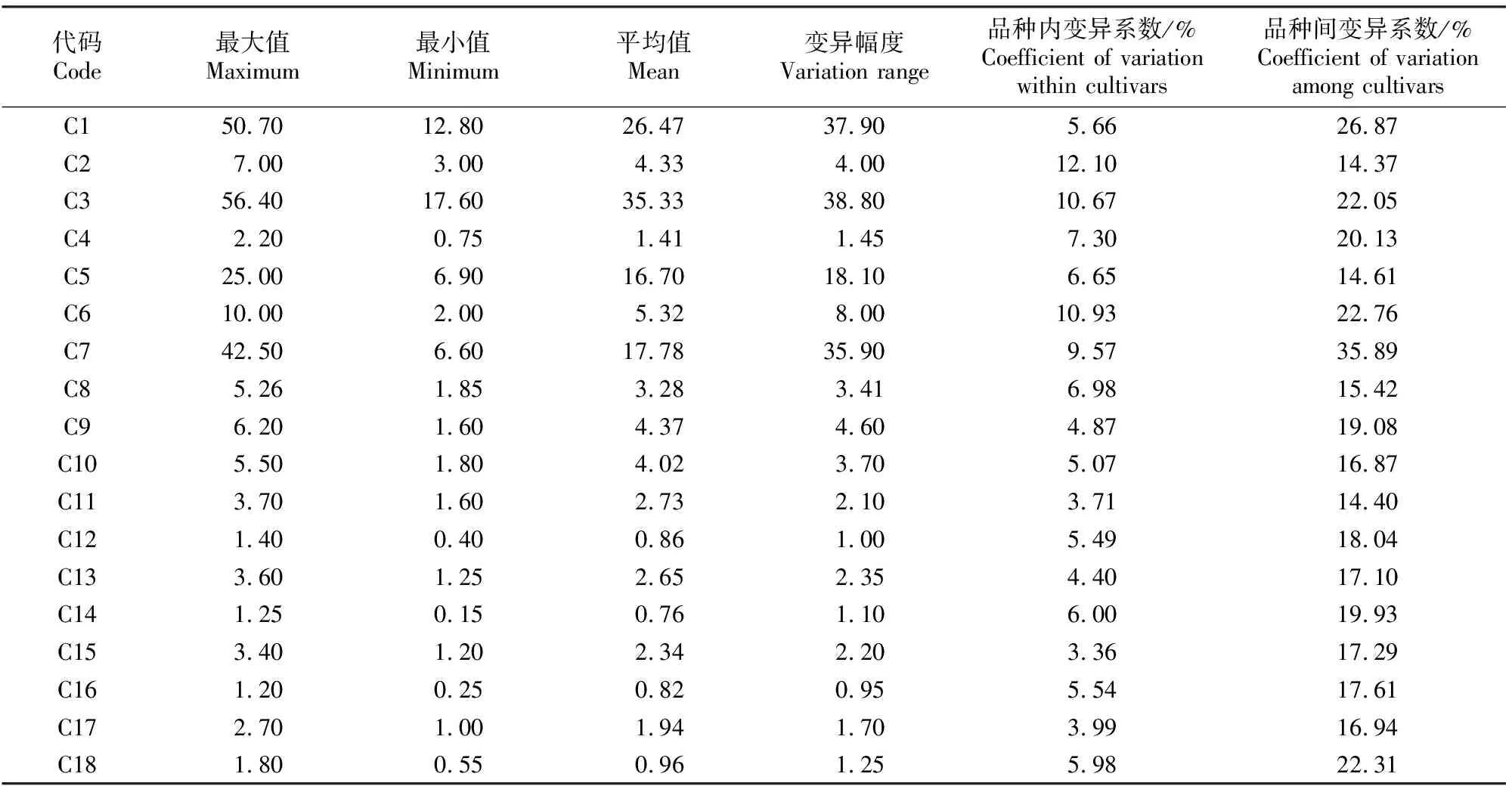
表5 建兰品种资源数量性状的变异情况Table 5 Variations of quantitative characteristics among Cymbidium ensifolium cultivars
各数量性状在品种间的变异系数为14.37%~35.89%,较品种内变异系数更大,说明建兰各性状在品种间变异丰富。品种间变异系数最大的是花序梗长度(C7),最小的是叶片数(C2)。品种间变异系数在15%以下的性状有3个,分别是叶片数(C2)、假鳞茎大小(C5)、中萼片长度(C11)。
2.3 建兰品种资源数量性状的主成分分析和分组性状的判定
由表6可知,根据特征根大于1的原则选取前5个特征根大于1的成分,5个成分的累积贡献率超过80%,各主成分贡献率分别为36.173%,17.188%,12.695%,7.522%和6.881%,累积贡献率为80.460%。

表6 建兰品种资源DUS测试数据的总方差解释表Table 6 Total variances explained of Cymbidium ensifolium cultivars DUS testing data
表7结果显示,主成分1中包含侧萼片长度、唇瓣长度、花瓣长度、花长度、中萼片长度和花宽度6个性状,且6个性状间均呈极显著正相关,该成分与花朵的长度相关,因此可称为花长因子。主成分2中包含植株大小、花序梗粗度、植株叶片数、叶长度、花序花数量和叶宽度6个性状,其中植株大小与叶长度、花序花数量、叶片数和花序梗粗度呈极显著或显著正相关,且叶长度与叶片数、花序梗粗度与叶片数、叶长度和叶宽度均呈极显著正相关,因此可称为植株因子。主成分3中包含中萼片宽度、侧萼片宽度和花瓣宽度3个性状,3个性状间均呈极显著正相关,该成分与萼片、花瓣的宽度相关,因此可称为萼片宽度因子。主成分4中只有花序梗长度,花序梗长度与花序梗粗度呈显著相关,与唇瓣宽度呈极显著负相关,该性状较为独立,可称为花序梗因子。主成分5中包含假鳞茎大小和唇瓣宽度,唇瓣宽度与花瓣长度、唇瓣长度呈极显著正相关,与花序梗长度呈极显著负相关,而假鳞茎大小与其他性状均无显著相关性,说明该性状较为独立,因此可称为假鳞茎因子。
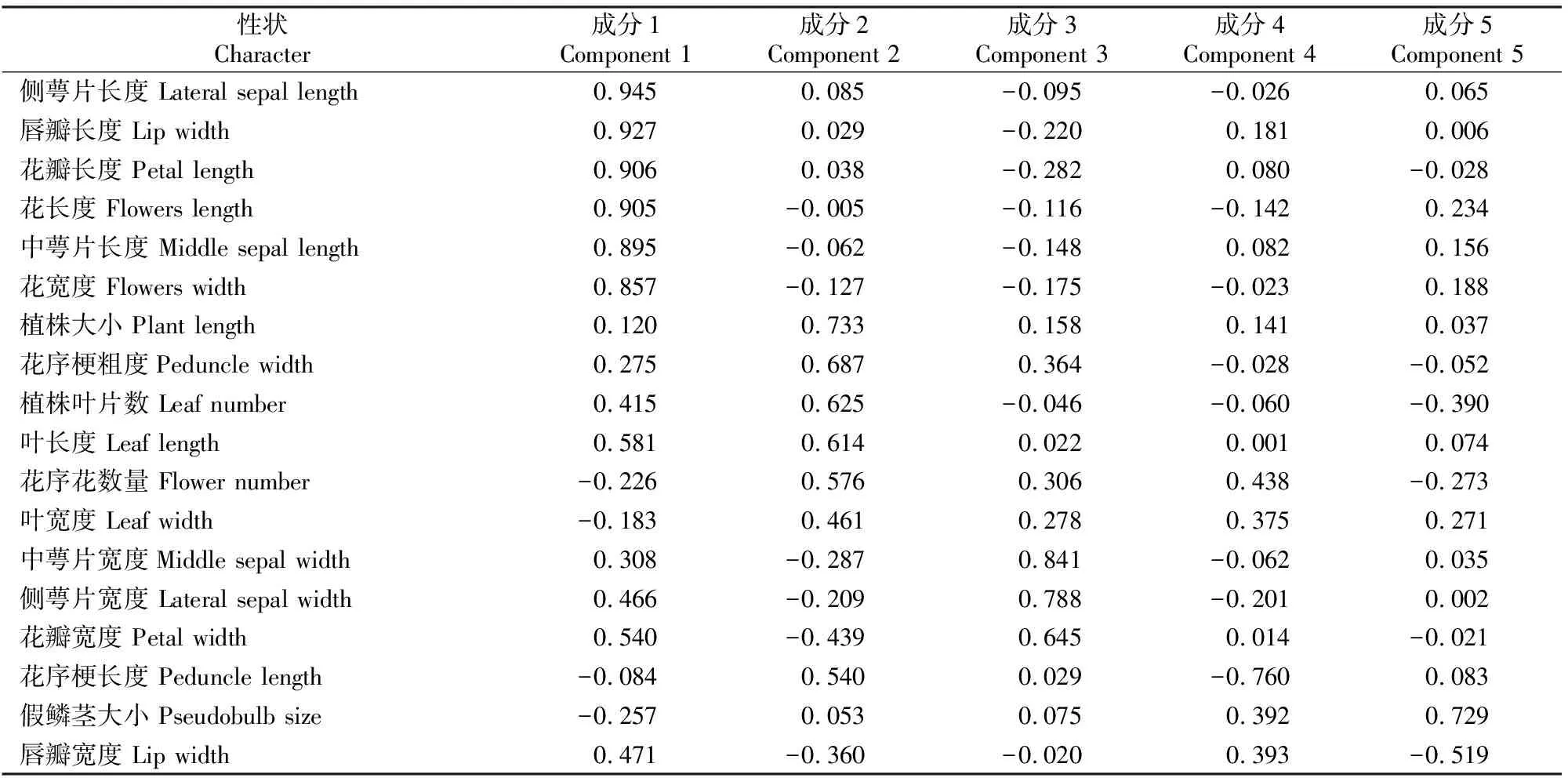
表7 建兰品种资源数量性状的成分矩阵Table 7 Quantitative characteristics component matrix of Cymbidium ensifolium cultivars
最终根据主成分内各因子对主成分的影响程度归纳出分组性状,分别为花长度、植株大小、萼片宽度、花序梗长度和假鳞茎大小。
3 讨 论
3.1 建兰品种资源数量性状的分级
对数量性状进行合理分级是DUS测试中最为重要的一个环节。数量性状存在较大的不确定性,容易因气候环境、栽培条件、年份、品种等因素产生变化,因此,《兰属植物DUS测试指南》中并未给出具体的分级数值,而是列出与各性状表达状态相对应的标准品种来矫正环境因素对测试数据产生的影响。在实际测试过程中,数量性状分级更多地是根据测量数据进行划分。对于已经发布的《兰属植物DUS测试指南》,测试员在应用过程中发现错误应及时反馈到总中心,由总中心公布勘误表,以提高测试指南的科学性,也提高测试报告的可信度[26]。
关于建兰品种数量性状的分级,本研究根据《兰属植物DUS测试指南》中的分级数进行划分,其中花序花数量分为9级,分级数较多,建兰的花序花数量一般在10朵以内,而大花蕙兰的花序花数量可达到40朵以上[27],故对建兰的测试应根据实际情况,可以考虑将花序花数量的分级数减少至3级或5级,因此统一的测试指南不一定适合所有的兰属品种,研制兰属内各类品种的测试指南势在必行。
3.2 建兰品种资源数量性状的变异情况及相关性分析
性状变异是物种进化及新品种、新物种形成的前提,历来被植物分类和育种学家所重视,变异系数的差异反映了性状在进化过程中遗传可塑性和保守性方面的不同[28]。
在种间变异方面,32份建兰种质资源各数量性状的变异系数为14.37%~35.89%,表明建兰种质资源在植株、叶片、花朵等相关数量性状上均存在丰富的遗传多样性,丰富的遗传多样性可为种质资源创新利用提供更大的选择潜力。在种内性状稳定性方面,各数量性状的变异系数为3.36%~12.10%,叶片数、花序花数量、叶长度3个数量性状种内变异系数较大,表明3个性状的种内稳定性较差,容易受环境影响,在开展性状数据采集时需确保植株长势、花芽分化条件以及栽培管理条件尽可能一致。
性状间相关性显著且相关系数较大时,会出现趋于相同的变化趋势,因此这样的性状在品种鉴别中的作用十分有限。在DUS测试中,测试性状的增加会显著增加测试工作量和成本,降低测试效率[29]。本研究中,花朵、中萼片、侧萼片、花瓣和唇瓣的长度间及萼片与花瓣的宽度间均存在极显著正相关关系,因此可以考虑减少几个相关性较高的性状,以减少测试工作量,提升工作效率。
3.3 建兰品种资源分组性状的判定
在DUS测试中,分组性状是一类重要性状。分组性状的表达状态,即使来自不同地域,仍可以单独或与其他该类性状的表达状态结合使用,分组性状应是质量性状,或是能够有效区分品种的数量性状或假质量性状[30-31]。建兰DUS测试性状较多,确定既科学又实用的分组性状对品种的划分有重要意义,目前尚无分组性状判定的统一方法,应在后续对测试指南内容的完善中进行深入探讨。
本研究参考了《兰属植物DUS测试指南》中的分组性状,该分组性状中的数量性状主要是植株大小、花序花数量、花长度和花宽度4个方面。通过主成分分析发现,建兰品种资源数量性状的5个主成分可以归纳为花长度、植株大小、萼片宽度、花序梗长度和假鳞茎大小,其中花长度、萼片宽度和植株大小与《兰属植物DUS测试指南》分组性状中的数量性状比较吻合,花宽度可以替换为萼片宽度。《兰属植物DUS测试指南》中将花序花数量作为分组性状,而花序梗长度和假鳞茎大小不属于该测试指南中的分组性状。建兰的花序花数量一般稳定在3~9朵,将花序花数量作为分组性状较难对建兰进行品种间的区分,可能其更适合花序花数量变化较大的其他兰属品种。假鳞茎大小在《兰属植物DUS测试指南》中作为目测性状,且变异幅度较小,而花序梗长度在建兰品种间的变异幅度更大,因此考虑将其作为建兰的分组性状可能比较合适。
本研究尚存在一定的不足,如观测的品种数量较少,观测的数据缺乏年度间的校对,对观测数据的分析未进行更深入的挖掘等,可能会因此产生一定的误差。但可以肯定的是,随着测试指南的完善、测试技术的进步、新的测试方法和工具的开发,对建兰品种DUS测试的研究工作将会更加深入。
4 结 论
数量性状是DUS测试指南中重要的性状,本研究通过最小显著差法对32份建兰种质资源的18个数量性状进行分级研究,分级结果可作为今后建兰DUS测试数量性状描述分级的依据;同时还进行了分组性状的判定,所确定的分组性状可以作为建兰品种区分的有效依据。
——植物学教材质疑(六)

