MYB基因家族在桃不同育性品种中的表达模式分析
万淑媛,李 琴,赵彩平
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
桃是我国最重要的落叶果树之一,花粉不育品种在我国桃生产中大量应用,如沙红、安农水蜜、八月脆、川中岛白桃等,均是我国桃的主栽品种。花粉败育品种在栽培时需要配置授粉树才能保证果实产量,且易受花期不良气候的影响而导致减产。目前,科研人员在桃花粉不育方面已开展了一些研究,在细胞学方面,桃花粉不育主要表现为花粉母细胞发育异常,绒毡层细胞体积增大,导致出现花药空囊、花粉空粒、花粉形态正常但生活力低等不育表现[1-3];在花粉不育的遗传定位方面,研究者利用SSR、RFLP、SNP等分子标记将花粉不育基因Ps(pollen sterility)定位在桃第6号染色体上[4-7]。Eduardo等[8]通过传统制图方法,利用重测序数据将Ps基因精细定位到近160 kb的区间,并推测Prupe.6G024900为花粉不育的关键候选基因。Huang等[9]筛选到位于第6号染色体的PpABCG26含有显著的SNP标记,推测该基因是控制桃花粉不育的候选基因。此外,Rios等[10]对不同休眠阶段的桃花蕾进行转录组测序,分析预测了参与桃花粉不育的相关基因。但关于桃花粉不育的分子机制还有待进一步明确。
MYB转录因子在植物生长发育、细胞周期、代谢及逆境反应等调控网络中发挥着关键作用[11]。MYB转录因子含有一段高度保守的DNA结合结构域,由1~4个不完全重复的氨基酸序列(R)组成,根据R序列的数量和位置,MYB转录因子分为1R-MYB(MYB-related)、R2R3-MYB、3R-MYB和4R-MYB等4类[11-13]。已有大量研究表明,MYB转录因子在植物花粉发育调控中起关键作用。在拟南芥中,AtMYB80在绒毡层和小孢子中表达,通过调控绒毡层细胞程序性死亡从而控制花粉育性[14];TDF1突变可导致花药发育过程中绒毡层的功能障碍,小孢子从四分体中释放失败,从而导致花粉不育[15];AtMYB99也在绒毡层细胞中表达,通过与AtMYB24、AtMYB21形成三聚体,调控苯丙烷类物质的生物合成,进而影响花粉壁的形成[16]。此外,拟南芥中的AtMYB32突变和过表达均会引起雄性不育,其功能可能也是通过改变苯丙烷代谢而影响花粉发育[17]。棉花GhMYB24、小白菜BcMF28均在调控花粉发育过程中发挥着重要作用[18-19]。苹果MdMYB39L通过调控己糖吸收、细胞壁形成和与小孢子发生相关的靶基因,参与苹果雄蕊发育和花粉管生长[20]。同样,OsCSA通过调控水稻雄性生殖生长过程在糖分配相关基因的表达来影响花粉发育[21]。除此之外,MYB转录因子还可通过参与茉莉酸、生长素、赤霉素等途径调控相关基因的表达,从而影响花药发育[17,22-23]。但综观现有研究,关于MYB转录因子是否涉及桃花粉不育的调控尚未见报道。为此,本研究以桃不育品种沙红和可育品种红芙蓉不同发育时期的花芽为材料,比较观察其花药形态特征,在前期通过转录组测序筛选出差异表达的MYB基因家族成员的基础上,分析这些差异表达的MYB基因家族成员与已报道的同花粉育性相关的MYB基因的亲缘关系,并通过qRT-PCR检测花粉发育过程中MYB转录因子表达量变化的差异,旨在鉴定与桃雄性不育相关的MYB转录因子,为探究桃花粉不育的转录调控机制奠定基础。
1 材料与方法
1.1 试验材料
试验材料为桃花粉不育品种沙红和可育品种红芙蓉,在盛花前30,24,18和15 d(分别对应S1、S2、S3和S4时期),采集其花芽及盛花期花蕾。所有样品均采自西北农林科技大学园艺学院园艺场。
1.2 桃不同育性品种花药形态观察
取采集到的不同发育时期的花芽,剥除芽鳞,切除多余的组织后解剖出花药,置于体视荧光显微镜(Leica MZ10F)下,观察比较花药形态并拍照。
1.3 桃不同育性品种花芽转录组测序
采集沙红和红芙蓉S1~S3时期的花芽,每个时期3个生物学重复。由上海美吉生物医药科技有限公司进行cDNA文库构建,用Illumina Novaseq 6000测序平台测序,将获得的各样品质控后的序列(clean reads)与桃基因组(ftp://ftp.bioinfo.wsu.edu/species/Prunus_persica/Prunus_persica-genome.v2.0.a1)进行序列比对,获得能比对到基因组上的数据(mapped data),以FPKM(fragments per kilobase of transcript per million mapped reads)值计算基因的表达量。
1.4 MYB基因家族差异表达成员的鉴定
通过美吉生物云平台,对桃不同育性品种进行差异基因表达分析,鉴定出差异表达基因。采用方法为DESeq2,筛选标准为:多重检验校正后的P值(P-adjust)<0.5,差异倍数(fold change)≥2。利用前人以MYB结合结构域(PF00249)检索并提交至NCBI和InterProScan验证后,鉴定得到的256个桃MYB成员[24],与差异表达基因进行韦恩分析,筛选出差异表达的MYB家族成员;通过层级聚类对筛选出的在桃花芽中差异表达的MYB家族成员进行聚类分析,并根据其FPKM值绘制热图。
1.5 MYB基因家族的系统进化分析
根据前人研究报道的与花粉育性相关的MYB转录因子(表1),通过NCBI、TAIR等数据库共获得拟南芥、水稻等物种的28条与花粉育性相关的MYB蛋白序列。利用MEGA6软件,对桃花芽发育过程中差异表达的MYB转录因子与其他物种的MYB蛋白序列进行多重比对,构建系统进化树。构建方法为最大似然法,蛋白替换模型为LG+G,bootstrap重复次数为1 000。
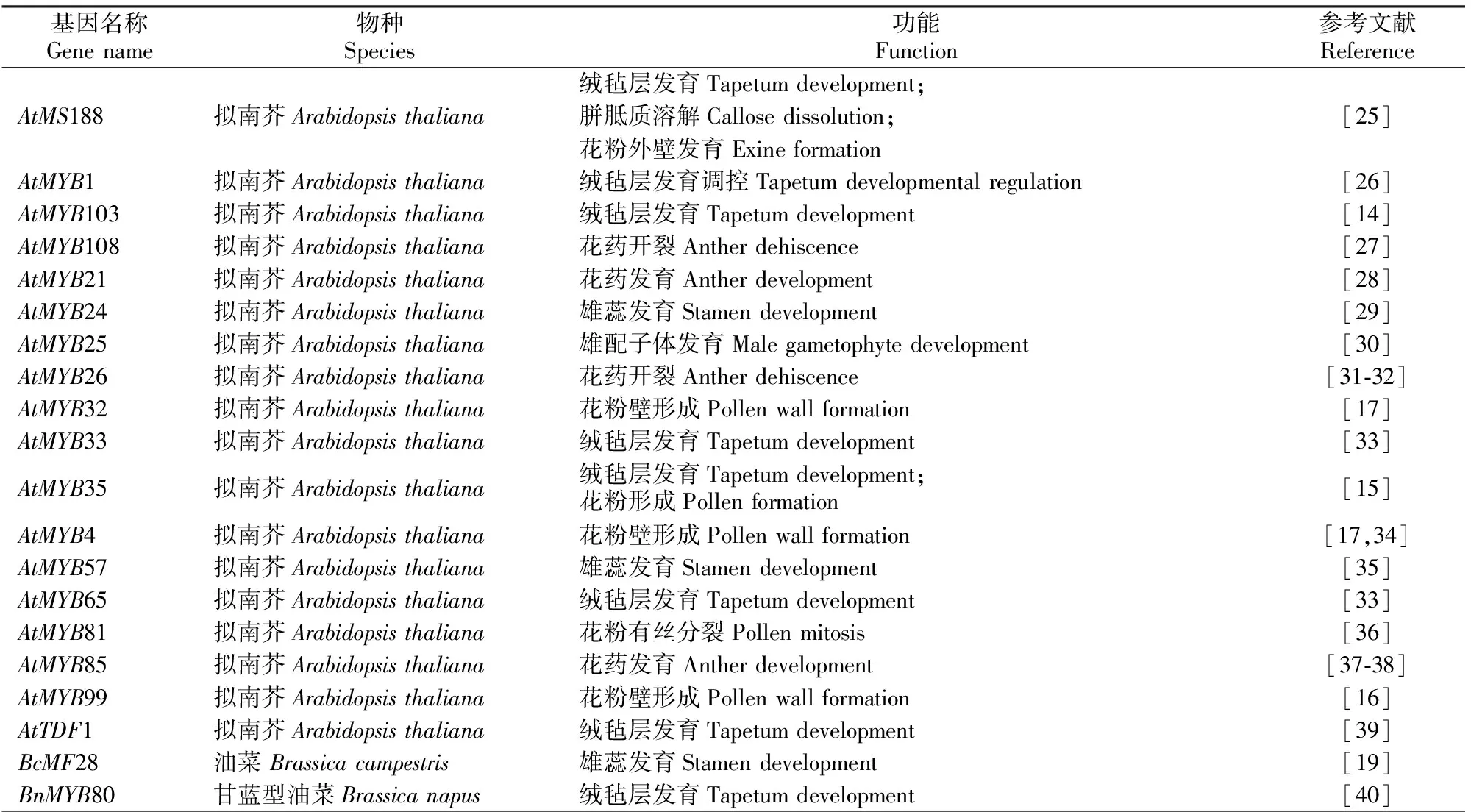
表1 28条与花粉育性相关的MYB转录因子Table 1 The 28 MYB transcription factors related to pollen fertility

表1(续) Continued table 1
1.6 桃部分MYB基因在不同育性品种中相对表达量的比较
为了进一步验证上述MYB基因家族成员在桃花粉发育中的调控作用,选择Prupe.3G046900、Prupe.1G551400、Prupe.4G192000、Prupe.1G323400、Prupe.1G273900和Prupe.2G192100等6个表达趋势可能与育性相关并且与其他物种同源性较高的成员,在桃不同育性品种中进行qRT-PCR分析。利用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生物)提取红芙蓉和沙红S1~S3时期花芽的总RNA,采用1%琼脂糖凝胶电泳法和紫外分光光度计(ThermoNanoDrop 2000,USA)检测RNA的完整性和浓度。使用EvoM-MLVRT Kit with gDNA Clean反转录试剂盒(艾科瑞生物)将RNA反转录合成cDNA。通过Primer Premier 6软件设计特异性引物(表2),利用CFX Connect Real-Time System实时定量PCR仪(Bio-Rad, USA),以桃PrupeTUA5和PrupeCYP2为内参基因,使用SYBR Green Pro Taq HS Premix (2×)实时荧光定量试剂盒(艾科瑞生物)进行qRT-PCR反应,反应体系与反应程序参照说明书设置,以2-ΔΔCt法计算基因的相对表达量。

表2 用于桃部分MYB基因相对表达量测定的实时荧光定量PCR引物Table 2 qRT-PCR analysis primers for relative expression of MYB gene in peach
2 结果与分析
2.1 不同育性桃品种花药的比较
对桃可育品种红芙蓉和不育品种沙红不同发育时期的花药进行观察比较,结果(图1)表明,随着花药的发育,红芙蓉花药体积逐渐增大,从S1~S4时期,花药颜色由淡黄色转变为金黄色,花药表面由透明状变为半透明状,且有明显增厚;相比之下,沙红的花药体积虽有所增大,但花药颜色略发白,在S3时期之后,花药较可育品种干瘪,表面增厚不明显。
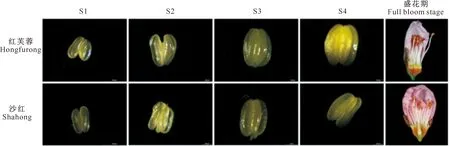
图1 红芙蓉和沙红不同发育时期的花药形态Fig.1 Anther morphology of Hongfurong and Shahong at different developmental stages
除此之外,由盛花期花器官观察结果(图1)可知,红芙蓉成熟花药饱满且体积较大,最终呈橙红色;而沙红成熟花药的体积明显小于红芙蓉,且颜色为淡黄色。
2.2 桃MYB基因家族差异表达成员分析
Zhang等[24]对桃MYB基因家族成员进行鉴定,共鉴定到256个桃MYB基因。转录组测序结果显示,有233个MYB基因家族成员在桃花芽中表达;多重检验校正后,当P值<0.5、差异倍数≥2时,有39个MYB基因家族成员在桃不同育性品种中差异表达。根据39个差异表达MYB家族成员的FPKM值绘制聚类热图,结果(图2)显示,所有差异表达的MYB家族成员被分为3簇,其中簇1中的MYB基因普遍在红芙蓉中高表达,尤其在S3时期的表达量显著高于沙红。簇2中的MYB家族成员基因普遍在沙红中的表达量较高,且在S3时期表达量显著高于红芙蓉,其中Prupe.1G405300和Prupe.1G405400在沙红花粉发育的S1~S3时期的表达量均高于红芙蓉。簇3中的MYB成员在红芙蓉花粉发育的S1~S3阶段,基因表达量随花粉发育呈下降趋势,且Prupe.1G273900在红芙蓉中的表达量均高于沙红;而在沙红花粉发育的S1~S3阶段,MYB家族成员的表达无明显规律性。
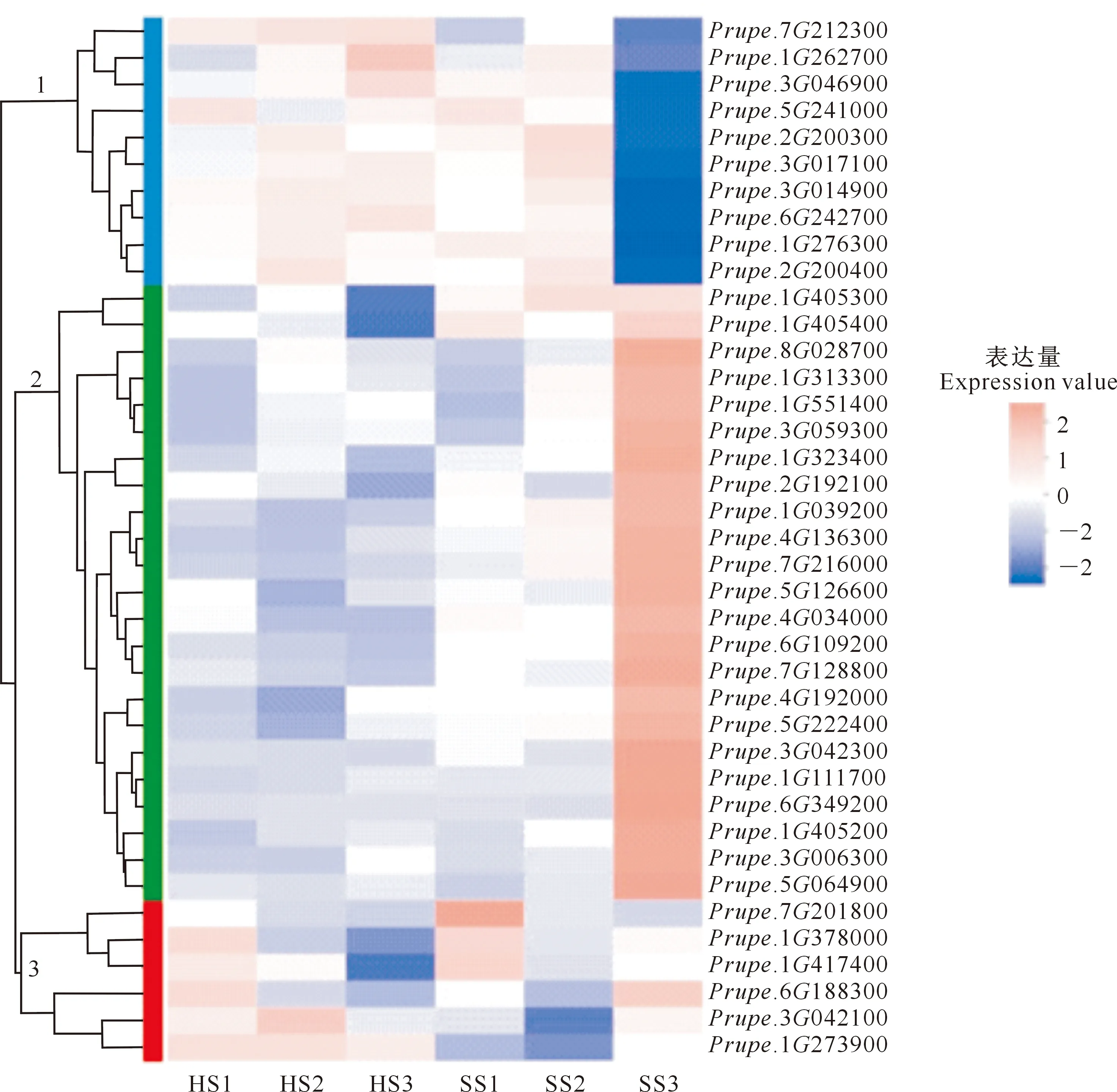
HS1、HS2、HS3分别代表红芙蓉S1、S2、S3时期的花芽样本,SS1、SS2、SS3分别代表沙红S1、S2、S3时期的花芽样本。左侧为基因聚类的树状图和子聚类的模块图,右侧为基因名称,2个基因分支离得越近,说明其表达量越接近;图中的色卡表示基因在每个样本中标准化处理后的表达量值,粉红色代表该基因在该样本中表达量较高,蓝色代表表达量较低HS1,HS2 and HS3 represent the flower bud samples of Hongfurong at stage S1,S2 and S3,respectively,while SS1,SS2 and SS3 represent the flower bud samples of Shahong at stage S1,S2 and S3,respectively.The left side is the dendrogram of gene clustering and the module of sub clustering,and the right side is the name of gene.Closer distances among two gene branches indicates closer expression.The color bar in the figure shows the expression value of the gene in each sample after standardized treatment.Pink represents high expression,while blue represents low expression图2 桃花芽转录组中差异表达的MYB家族成员在不同育性品种中的表达模式Fig.2 Expression patterns of differentially expressed MYB family members in peach flower buds transcriptome in different fertility cultivars
2.3 不同物种MYB家族成员的系统进化分析
为了探究差异表达的MYB家族成员在桃花粉育性形成中的潜在作用,将其与拟南芥、水稻等不同物种花药发育中起调控作用的MYB蛋白序列一起构建系统进化树。结果(图3)显示,所有39个差异表达的PrupeMYB被分成16簇,其中根据R结构的重复次数,簇1~12为R2R3-MYB,簇13~16为1R-MYB[24]。簇2、簇10、簇11和簇14不含桃MYB成员。在簇1~12中,多个桃MYB成员与其他物种中参与花粉形成的MYB家族成员同源性较高,如簇3中的桃Prupe.3G046900与拟南芥AtMYB26,簇4中的桃Prupe.3G017100与拟南芥AtMYB99,簇9中的桃Prupe.3G0006300与拟南芥AtMYB108;同时,簇12中的桃Prupe.1G276300与拟南芥AtMYB25、AtMYB1相似性较高,Prupe.1G551400、Prupe.1G323400与AtMYB4和AtMYB32成为1簇(簇7)。在簇16中,桃Prupe.8G028700、Prupe.1G273900与水稻OsCAS同源性较高,单独为一簇。
2.4 桃部分MYB基因在不同育性品种中的相对表达量
图4结果表明,在花芽发育的S1~S3阶段,Prupe.3G046900和Prupe.1G273900在可育的红芙蓉花芽中的相对表达量均高于不育的沙红,且分别在S3、S2时期二者差异显著。Prupe.2G192100、Prupe.1G323400和Prupe.4G192000在S1~S3阶段的表达特性呈现相似的趋势,即在S1、S2时期相对表达量比较稳定,且在2个品种间无显著差异;在S3时期可育的红芙蓉花芽中,其表达量仍然较为稳定,而在不育的沙红花芽中其表达量迅速上升,并显著高于红芙蓉。Prupe.1G551400的相对表达量在两品种中均表现为先升高后下降的趋势,且在S2时期沙红中的相对表达量显著高于红芙蓉。
3 讨 论
MYB转录因子家族是植物中最大的转录因子家族之一,参与调控植物的各种生物学过程[45],其中R2R3-MYB类成员最多[46-47],拟南芥等物种中多个与花粉育性调控相关的MYB转录因子都属于这一类,如拟南芥R2R3-MYB转录因子MYB24和MYB21与bHLH转录因子形成复合物,并与JAZs(JA ZIM-domain proteins)相互作用通过茉莉酸途径调控花粉育性[29];油菜BcMF28编码R2R3-MYB转录激活因子,在拟南芥中过表达会使雄蕊发育异常[19];辣椒CaMYB108同样编码R2R3-MYB转录因子,参与调控雄蕊发育[48]。本试验结果显示,在花芽中差异表达的39个桃MYB家族成员中,有27个属于R2R3-MYB类,与已有研究报道结果[24]类似。
同源基因的生物学功能可能相同或相似[45-50]。本研究的系统进化分析结果显示,桃中有多个MYB成员与拟南芥、苹果等物种中与花粉育性相关的MYB转录因子的同源性较高,而这些成员均通过苯丙烷代谢、JA信号通路、糖代谢等多种途径参与花药药室内壁增厚、花药开裂、花粉形成等花粉育性的调控。如在拟南芥中,MYB108在雄蕊中特异表达,随着花药发育其表达水平升高,特别在花药发育后期表达水平较高,在MYB21的下游介导茉莉酸反应,与MYB24协同正调控雄蕊和花粉成熟[27]。Prupe.1G111700、Prupe.3G006300与AtMYB108亲缘关系较近,同属于簇9,同时二者在不育品种沙红各时期花芽中的表达量均高于可育品种红芙蓉,且在S3时期二者差异显著,因此推测桃中的Prupe.1G111700和Prupe.3G006300可能参与花粉育性的调控,但区别于AtMYB108的正调控作用。拟南芥AtMYB26在木质素合成途径的上游起作用,对花药药室内壁次生增厚和花药开裂起重要作用[31-32],桃Prupe.3G046900与其同源性较高,在可育品种红芙蓉花芽发育过程中的表达量均高于不育品种沙红,且在S3时期二者差异显著,同时,在S3~S4时期两品种间花药形态差异明显,因此推测Prupe.3G046900与AtMYB26具有相似的功能,即在育性发育中期起正调控作用。拟南芥AtMYB32和AtMYB4表达水平的高低影响苯丙烷途径多种关键酶的合成,从而影响花粉壁的形成[17]。AtMYB4还对肉桂酸-4-羟化酶(Cinnamate-4-hydroxylase, C4H)的表达起抑制作用[34],C4H是苯丙烷代谢途径中的关键酶,与孢粉素前体形成有关[17,51]。桃Prupe.1G551400、Prupe.1G323400与拟南芥AtMYB4、AtMYB32亲缘关系较近,且在不育品种中的基因表达量高于可育品种,因此推测Prupe.1G551400和Prupe.1G323400可能通过负调控C4H的积累而参与花粉壁的形成,进而调控桃的花粉育性。苹果中的MdMYB39L通过糖代谢调控雄蕊发育和花粉管伸长,在反义转化株系中,参与己糖合成、细胞壁形成和小孢子发生的靶基因的转录水平的降低[20]。桃Prupe.6G188300、Prupe.4G192000与苹果MdMYB39L同源性较高,且在不育品种沙红S3时期的花芽中,Prupe.4G192000的相对表达量显著高于可育品种红芙蓉,因此推测Prupe.6G188300、Prupe.4G192000与MdMYB39L功能接近,可能通过糖代谢途径调控桃的花粉发育。
4 结 论
本研究对桃可育品种红芙蓉和不育品种沙红不同发育时期的花药进行了观察比较,前者花粉呈橙红色且饱满,后者呈淡黄色且瘪小。在2个桃品种中,差异表达的MYB转录因子家族成员有39个,其中27个属于R2R3-MYB类。系统进化树和表达特性分析结果表明,MYB家族成员Prupe.3G046900、Prupe.1G551400、Prupe.1G323400、Prupe.4G192000可能参与桃花粉发育的调控。

