植物内生菌16S rRNA基因扩增子高通量测序中降低宿主污染的方法
程丹丹,杨嘉麒,王 牧,赵 菁
(中国地质大学(武汉)环境学院,湖北 武汉 430078)
附着在植物表面和内部以及植物生长环境中的所有微生物统称为植物微生物组[1-2],根据其分布的部位可分为内生微生物、叶际微生物、根际微生物。植物内生菌作为植物微生物的重要组成之一,能够影响植物的生理代谢,增强其抗逆性[3-4],生产多种生物活性或拮抗物质,增强宿主抵抗病虫害的能力[5-6],对植物的生长起促进作用[7-8],也对环境调控有重要意义。
近年来,植物辅助土壤修复已成为国内外研究的热点[9]。植物体内参与激素合成、污染物降解等基因编码的代谢途径使植物内生菌具有解毒的能力,能够改变植物的生理代谢过程,以适应其生境[10],并能与植物协同合作使其在降解污染物、控制污染方面有巨大的潜力[11-12]。重金属污染是最常见的土壤污染之一,已有大量试验报道植物内生菌对土壤中铅(Pb)、镉(Cd)、铜(Cu)、铬(Cr)、镍(Ni)等重金属元素具有强耐受性[13-17],如假单胞菌、伯克氏菌、芽孢杆菌等[18-20],且一种植物内生菌能够对土壤中多种重金属具有耐受性[21-22],能够使土壤中重金属元素富集到植物体内从而进行环境修复,为植物-内生菌体系治理土壤重金属污染提供了广阔的应用前景。有机物污染也严重危害着土壤,植物内生菌对土壤中一些有机物也能够进行有效降解,如Zhu等[23]从红车轴草与小蓬草中均分离得到能够对土壤中多环芳烃进行降解的植物内生细菌;Anderolli等[24]从杨树内分离得到菌株DBT1,该菌株对土壤中多环芳烃具有极高的降解效率。也有试验证明植物内生菌能够对土壤中部分有机农药进行降解,如噻虫嗪、苯磺隆、二甲四氯等[25-27]。此外,在植物入侵机制研究方面,已从多种入侵植物中得到功能性内生菌[28-30],将植物内生菌与植物入侵机制相联系能够为植物入侵机制的研究与防治提供参考,也为探讨微生物在植物入侵机制中的作用提供了新视角。
植物内生菌是具有巨大应用潜力的资源库,植物内生菌研究对生态环境的健康发展具有重要意义。随着分子生物学的不断发展,近年来采用第二代测序技术能够在免培养条件下对植物内生菌的16S rRNA (small subunit ribosomal RNA)基因进行扩增,进而确定细菌群落种类组成和多样性。但由于植物叶绿体和线粒体基因序列与细菌在系统发育上有着高度的同源性,在植物内生菌的16S rRNA基因扩增子高通量(16S-seq)测序过程中不可避免地会出现宿主基因污染问题,而目前能够有效减轻这种宿主基因污染而不会对细菌16S rRNA基因扩增产生任何偏好仍旧是一个挑战。本文通过阅读相关文献,总结归纳了降低植物内生菌16S-Seq测序中宿主基因污染的主要方法。
1 植物内生菌
植物内生菌泛指那些在其生活史中的某一阶段或全部阶段生活在植物组织内,不改变植物的表观性状,对宿主植物不引起明显病害症状的微生物,包括内生细菌、内生真菌和内生放线菌[31],其广泛存在于几乎所有植物中。植物内生菌由德国科学家Bary在1886年提出[32],20世纪70年代木本植物内生真菌的研究逐渐兴起,但主要针对部分重要的经济林木和热带雨林原始林木[33]。随着研究的进一步开展,在多种灌木、草本植物以及栽培作物、果树甚至藻类、苔藓和蕨类植物中也发现了植物内生菌的存在[34]。植物内生菌几乎存在于植物的所有组织中,包括植物的根、茎、叶、花、果实、胚、种子[35]。
Compant等[36]研究认为,植物微生物与宿主植物的关系取决于植物基因型、环境和共定殖微生物群在内的许多因素。但一般认为,植物内生菌能与寄主植物建立和谐共生的关系[37], 因此植物内生菌与致病菌之间的明确区分需要详细的功能分析。作为非致病性微生物,植物内生菌可以改善植物健康状态、增强植物对胁迫的耐受性[38],也能够为宿主植物提供生物防治和作为植物生长的促进剂[39]。植物内生菌的传播方式有多种:第一种传播方式是垂直传播,即植物内生菌能通过种子或无性繁殖从母代植株传递到子代植株中,种子内微生物的代际传播对植物健康、生长和微生态有着深远的影响[40];第二种传播方式是微生物通过植物根部的裂缝进入到植物体内成为植物内生菌,根部是外界微生物进入植物内部的主要部位;第三种传播方式是外界微生物通过降解植物细胞纤维素进入到植物组织内成为植物内生菌。
植物内生菌是一个多样性十分丰富的微生物类群,如Hardoim等[41]对已经报道过的内生细菌和内生真菌的DNA序列进行了数据库构建,结果发现:内生细菌可归为21门,其中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)的序列数占比较高,最主要的纲为γ-变形菌纲,而占比较高的内生细菌属有肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、沙雷氏菌属(Serratia)等;内生真菌门类主要有球囊菌门(Glomeromycota)、子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)等,最主要的纲为粪壳菌纲(Sordariomycetes),而占比较高的内生真菌属有瘤座菌属(Balansia)、Epichlo⊇属、碳垫菌属(Nemania)、炭角菌属(Xylaria)、炭疽菌属(Colletotrichum)等。常见的内生放线菌有链霉菌属(Streptomyces)、诺卡氏菌属(Nocardia)、拟诺卡氏菌属(Nocardiopsis)、原小单胞菌属(Promicromonospora)等[42-43]。
2 细菌16S rRNA基因的扩增子高通量测序
植物内生菌可以从经过严格表面消毒的植物组织和汁液中分离培养获得,即将经过严格表面消毒的样品转移到培养基中,分离纯化目的菌并进行生理生化检测、分类、鉴定等一系列研究,这种方法被称之为传统的纯培养方法。随着分子生物学技术的发展,现在也可以从植物组织内直接扩增出微生物DNA进行测序,从而分析植物内生菌的群落组成和多样性。目前利用测序技术对细菌基因进行扩增主要有两种方法:一种是基于16S小亚基核糖体RNA(16S rRNA)基因的扩增子高通量测序方法;另一种是基于环境基因组DNA的宏基因组测序方法。这两种方法各有优缺点,相比之下,基于16S rRNA基因的扩增子高通量测序(16S-seq)技术更加常用,且分析方法也相对成熟。相较于传统的纯培养方法,16S-seq技术为植物内生菌群落多样性检测提供了更为有效的手段[44]。
细菌16S rRNA基因约由1 540个碱基构成,序列长度适中且所含遗传信息较充足,既有保守性序列片段,也有相对于每个细菌可变的可变性序列片段,利用保守区片段可以得到细菌的通用引物,扩增过程中不会与非细菌DNA结合;利用可变区片段,通过分析各个细菌可变区的差异可以区分不同的细菌(见图1)[44]。因此,选择细菌16S rRNA基因进行细菌鉴定以及遗传多样性的分析比较合理。
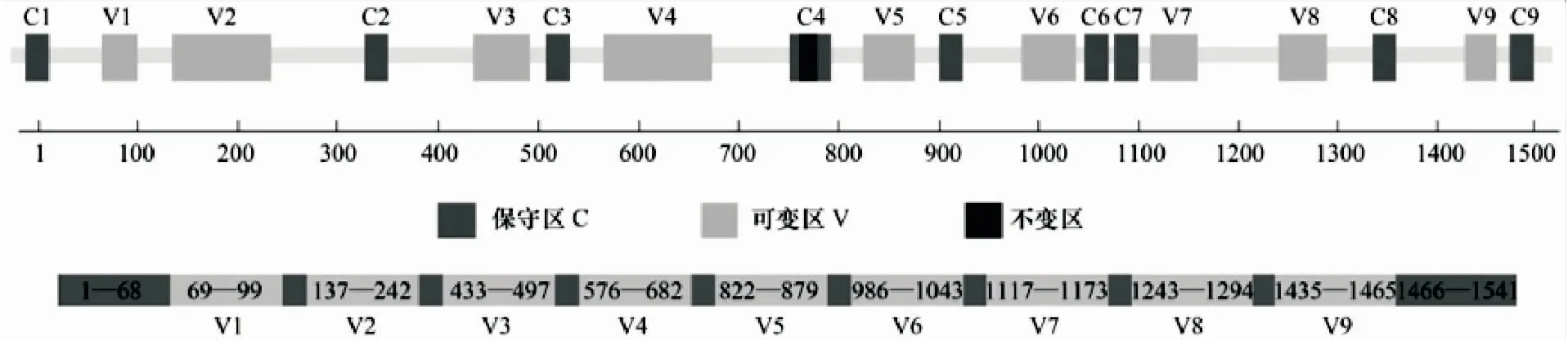
图1 细菌16S rRNA基因保守区和可变区的分布Fig.1 Distribution of conserved and variable regions of bacterial 16S rRNA gene
3 宿主基因污染对植物内生菌群落研究的影响
很多研究发现,在植物内生菌16S-seq结果中存在大量宿主细胞器基因序列。如刘乔等[45]在对湖北省神农架泥炭藓共生细菌群落分析研究中发现,扩增建库得到的蓝细菌序列与泥炭藓中叶绿体16S rRNA基因序列高度相似,叶绿体16S rRNA基因序列在未经过表面消毒样品总序列数中占比为38.19%,在经过表面消毒样品总序列数中占比为39.75%;陈泽斌等[46]在利用Illumina MiSeq高通量测序技术分析白芨内生细菌多样性研究中发现,部分基因序列归属于线粒体和叶绿体,存在宿主污染现象,该课题组在针对其他植物的研究中也发现了同样的现象;Tian等[47]在针对番茄根样本内生菌16S-seq结果中发现,测序得到的基因序列中内生菌序列的占比很小。
植物内生菌16S-seq结果中出现叶绿体的干扰,是因为就植物组织而言,叶绿体与细菌在系统发育上具有高度的同源性[48]。1905年,Mereschkowsky提出了叶绿体的内共生假说,认为高等植物体内的叶绿体是由长期共生于植物内部且具有光合作用的细菌逐步演化而来的。1967年,美国波士顿大学的Margulis提出了线粒体和叶绿体的共生形成学说,认为自由的细菌被原核细胞吞噬到细胞内未被消化而存活下来,逐渐发展成共生性质,最后成为细胞器[49],即细胞器的内共生起源学说,线粒体和叶绿体至今保存着部分与细菌和蓝细菌高度相似的基因片段。
虽然在数据处理中可以将叶绿体、线粒体基因序列和无法鉴定的基因序列剔除掉,以免影响数据分析。如Žiarovská等[50]在研究小麦发育早期内生菌多样性时去除了基因序列扩增结果中的叶绿体和线粒体基因序列。但是,植物内生菌16S-seq过程中宿主基因污染仍旧是存在的,严重的宿主基因污染会影响对植物内生菌的多样性分析,也会导致研究成本增加,所以这个问题仍然是需要解决和攻克的难题。
4 减少植物内生菌16S rRNA基因扩增子高通量测序中宿主基因污染的主要方法
通过查阅文献,对近年来用于减少植物内生菌16S-seq中宿主细胞器基因序列污染的方法进行了汇总,主要方法有寻找特异性错配引物、添加特异性阻断物、Cas-16S-seq方法、巢式PCR技术4种,详见表1。

表1 减少植物内生菌16S rRNA基因扩增子高通量测序中宿主基因污染的方法汇总Table 1 Advances in methods to reduce host genetic pollution in high-throughput sequencing of 16S rRNA gene amplicon sequencing of plant endophytic bacteria
4.1 寻找特异性错配引物
许多学者通过寻找特异性错配引物用来扩增细菌16S rRNA基因,以减少植物内生菌16S rRNA基因扩增子高通量测序(16S-seq)过程中的宿主基因污染。如Chelius等[51]开发了第一个特异性错配引物799F,该引物设计围绕着叶绿体16S rRNA基因序列中798和799位的两个碱基对错配以及783和784位的另外两个碱基对错配,并在对玉米根内生菌的研究中,通过查阅文献以及比对玉米根内叶绿体和线粒体基因序列,使用了799F-1492R这对引物,其中引物799F能放大细菌序列测序结果约1.5倍,且能排除叶绿体的干扰,而引物1492R能在匹配大多细菌的同时,还能使线粒体基因序列长度扩增到1090bp,且细菌16S序列长度只有约735bp,通过基因序列长度的差异来区分线粒体和细菌扩增序列;Sakai等[52]针对小麦和菠菜根部细菌进行分析时,将引物799F修饰为引物783F,结果发现在检测到高峰值细菌16S rRNA基因序列的同时,基本消除了植物细胞器基因序列的干扰。
但是,引物799F并不适用于所有植物。如Thijs等[54]选用了多对不同的细菌通用引物扩增杨树的根、茎、叶内生菌,结果发现引物799F及其变体相比于其他引物对消除非目标DNA和对细菌OTUs的检索都有较好的效果,可将测序结果中的叶绿体基因序列污染降到最低程度,但仍有部分线粒体基因序列被污染。针对特定的植物样本,有文献提出了减少宿主基因污染效果更好的引物对。如Nakano[55]在对蔬菜产品细菌多样性的研究中使用了335F/769R引物对,结果发现特异性335F/769R引物对对叶绿体和线粒体基因序列的退火亲和力最低,可以减少非细菌基因序列的扩增,扩增产物当中叶绿体和线粒体基因序列仅占总基因序列的0.84%。
综合来看,特异性错配引物799F及其变体能够对大部分植物样本中宿主基因污染有较好的抑制效果。表2列出了在植物内生菌16S-seq中常用的特异性错配引物,这些引物都被证实能够减少PCR扩增结果中的宿主基因污染。但是某种植物样本应当选择何种特异性错配引物,则需要参考相关文献或者设计针对性的特异性错配引物,才能更好地减少宿主基因污染。

表2 植物内生菌16S rRNA基因扩增子高通量测序(16S-seq)中常用的特异性错配引物Table 2 Specific primers commonly used in 16S-seq sequencing of plant endophytic bacteria
4.2 添加特异性阻断物
一些学者通过添加特异性阻断物用来抑制宿主基因序列的扩增,主要有PNA-PCR和LNA-PCR钳位技术。
4.2.1 PNA-PCR钳位技术
Lundberg等[57]设计了一种肽核酸(Peptide nucleic acids,PNA)PCR钳位技术,将PNA加入到植物内生菌16S-seq的PCR扩增过程中,用来抑制宿主细胞器基因序列的扩增。PNA是经过设计的较短的肽核酸链,它能与宿主叶绿体或者线粒体16S rRNA基因序列中的一段序列紧密结合,从而阻断该基因序列的扩增。此外,他还在同一个扩增流程中使用两种PNA,分别用来阻断叶绿体和线粒体基因序列的扩增,且不影响细菌基因序列的扩增,结果发现:同样的样本,没有使用PNA-PCR钳位技术进行处理,宿主基因污染高达85%;而使用PNA-PCR钳位技术进行处理,则成功阻断了宿主细胞器基因序列的扩增,且细菌16S扩增子序列也增加了8倍之多。
上述方法在一定程度上减少了植物内生菌16S-seq中的宿主基因污染。如De Souza等[58]在研究甘蔗细菌微生物组时,针对叶绿体和线粒体16S rRNA基因序列,使用PNA-PCR钳位技术,增加了细菌基因序列的扩增,同时大多数宿主细胞器基因序列扩增被抑制;Coleman-Derr等[59]在对栽培和野外龙舌兰内生菌的研究中,应用了PNA-PCA钳位技术,测序结果中只有少量叶绿体的干扰。但也有文献提到PNA-PCR钳位技术对于一些特定植物类群的微生物群组,减少宿主基因污染的效果并不显著。如Lu-Irving等[62]在研究黄矢车菊(Centaurea solstitialis)微生物群落时利用PNA来阻止植物叶绿体和线粒体16S rRNA基因序列的扩增,但最后仍得到83%的叶绿体基因序列,删除叶绿体基因序列后剩余扩增序列数目也相对较低,无法对叶片内生细菌群落进行研究。一项对水生植物微生物群落的研究也表明,PNA阻止了水生植物内生菌中某些细菌基因序列的扩增,从而给微生物群落结构分析带来一定的偏差[70]。如Fitzpatrick等[71]也证实,Lundberg等最初设计的特异性阻断物PNA的阻断效率在不同植物类群中的差异很大(从6%到100%)。针对PNA-PCR钳位技术在一些应用当中出现的问题,有研究人员在应用这项技术的同时也使用了特异性错配引物。如Johnston-Monje等[60]研究幼嫩玉米根际菌群时,在PCR中添加了抗叶绿体和抗线粒体PNA阻断物来阻断叶绿体和线粒体基因序列的扩增,同时也使用了特异性错配引物799F,但扩增结果中仍旧有一小部分没有被PNA有效阻断的线粒体和叶绿体基因序列。
此外,Simmons等[72]指出不同植物的叶绿体和线粒体16S rRNA基因序列存在差异,认为在实验设计过程中从生物信息学方面检查PNA与植物细胞器基因序列的互补性是很重要的,这关系着PNA能否成功阻止宿主细胞器基因序列的扩增;Fitzpatrick等[71]也强调了宿主细胞器基因序列变化在决定PNA有效性方面的重要性,指出PNA阻止DNA基因序列扩增的能力依赖于PNA-DNA相对于DNA-DNA双链增加的热稳定性(即升高的DNA熔解温度,Tm),而PNA与DNA基因序列之间的单核苷酸不匹配可导致Tm降低8~20℃,因此在通用的PNA与宿主细胞器基因序列差别较大的情况下,设计一个与宿主细胞器基因序列互补的PNA是一种更有效地减少宿主细胞器基因污染的方法。
4.2.2 LNA-PCR钳位技术
Ikenaga等[73]提出一种锁核酸(Locked nucleic acid,LNA) PCR钳位技术。LNA是一种人工核苷酸类似物,含有一个亚甲基连接核糖的2′-oxygen和4′-carbon。LNA寡核苷酸可以设计成与正常引物相似的引物,可以选择性扩增细菌基因序列,同时能够抑制宿主细胞器基因序列的扩增。他也指出LNA-PCR钳位技术的优势是使用覆盖范围更大的引物集来扩增几乎全部的细菌16S rRNA基因,而且随着LNA浓度的增加,宿主细胞器基因序列扩增产物也随之减少。
Yu等[61]在对大豆和玉米根部相关细菌群落结构的研究当中使用LNA-PCR钳位技术对宿主基因污染进行抑制,得到的扩增基因序列中叶绿体和线粒体基因序列的占比大幅下降;Ikenaga等[74]认为LNA原先所使用的引物对63F/1492R的抑制效率较低,故设计了3个新的正向引物KU63F、KU64F、KU68F和1个新的反向引物KU1494R用来改善其抑制效率,结果发现KU63F/KU1484R引物对最适用于植物内生菌的PCR扩增。虽然已有实验证明该种方法能够降低植物内生菌16S-seq中宿主基因的污染率,但其对植物的普适性还有待深入研究。
4.3 Cas-16S-seq方法
Song等[64]在实际应用PNA-PCR钳位技术的过程中,发现该技术不高效且对微生物群落分析时会引起偏差,因此开发了Cas-16S-seq方法。该方法利用Cas9核酸酶和特异性导向RNA(gRNA)在文库构建过程中剪切靶向16S rRNA基因,从而去除16S-seq中的宿主基因污染。在实际应用过程中,Cas-16S-seq方法基于常规的16S-seq方法,使用两步PCR来扩增和标记16S rRNA基因:第一轮PCR扩增,使用带接头的通用引物(Rd-universal-F/R)扩增16S rRNA基因的可变区域,并用Cas9和特异性gRNA剪切PCR扩增产物中的宿主细胞器16S rRNA基因;第二轮PCR扩增,使用含标签序列和Illumina测序仪接头序列的引物(P5-index-Rd-F和P7-index-Rd-R)来扩增酶解产物,获得最终扩增子库。宿主细胞器的16S rRNA基因片段在第二轮PCR扩增中不能进行扩增,从而在最后的16S-seq数据中被去除。此外,他还比较了Cas-16S-seq方法与常规的16S-seq方法在研究稻田土、水稻根和叶际样品细菌群落结构的效果,结果发现:对比常规的16S-seq方法,利用Cas-16S-seq方法处理的水稻根中宿主基因的污染率从63.2%降低到2.9%,在叶际样品中宿主基因的污染率也从99.4%降低到11.6%,两者几乎显示了相同的土壤细菌群落。可见,Cas-16S-seq方法可以有效地阻断水稻内生细菌16S-seq测序过程中宿主基因造成的污染,同时不会对细菌群落结构结果分析造成偏差。
4.4 巢式PCR技术
巢式PCR技术可以通过两套引物对有限的DNA模板进行两轮PCR扩增,能够很大程度地提高对靶DNA的特异性和灵敏度。如Chelius等[51]研究认为在扩增效率低下或初始模板浓度较低的情况下,可以使用巢式PCR方法来增强扩增效率;Dos Santos等[66]对巢式PCR扩增和直接PCR扩增进行了比对,直接PCR扩增使用通用引物27F/1492R,而巢式PCR扩增以第一轮通用引物27F/1492R进行PCR扩增的产物为模板,使用799F和U1492R嵌套引物进行第二轮PCR扩增,结果发现巢式PCR扩增降低了叶绿体基因序列在扩增产物中的比例;渝江等[65]首先利用LNA-PCR钳位技术进行第一轮PCR扩增,得到扩增产物后纯化,再以纯化扩增产物稀释液为模板并以引物对341F/907R进行了第二轮PCR扩增。目前很多研究人员利用巢式PCR方法,在第一轮PCR扩增中减少宿主基因污染,纯化后再使用特异性引物扩增出更多的细菌16S rRNA基因序列。
Lundberg等[67]引入了宿主基因相关微生物PCR(ham PCR)扩增流程,同样需要两步PCR扩增流程。首先需要引物共扩增宿主基因和一个或多个微生物区域,如16S rRNA基因,以得到微生物种群大小相对于宿主组织叶绿体和线粒体数量的比率,即微生物负荷;然后在完成测序文库后,扩增子能被纯化并以任一比例进行混合,通过这一步PCR扩增,可以得出下一步PCR圹增是否需要调整引物比例,或者对宿主与微生物比例不理想的样本进行调整。此外,他还利用ham PCR技术准确检测出模式植物拟南芥的细菌群落结构,且该技术不会引起细菌组成偏差。
5 总结与展望
植物内生菌普遍存在于各种植物当中,可以改善植物健康状态,促进植物生长,也可以作为病原体为宿主植物提供生物防治和作为宿主植物的生长促进剂。研究植物内生菌,对于我们理解植物生长情况、健康状态具有重要的意义。研究植物内生菌最常使用16S rRNA基因扩增子高通量测序(16S-seq)技术,但这项技术伴随着宿主基因的污染问题,目前解决这个问题的办法主要有以下4种方法:①寻找特异性错配引物,使引物能特异性结合植物内生菌16S rRNA基因,扩增出足够丰富的细菌OTUs,并能够抑制宿主细胞器基因序列扩增;②添加特异性阻断物用来阻断植物叶绿体和线粒体基因序列扩增,如PNA-PCR和LAN-PCR钳位技术;③在文库构建过程中剪切宿主细胞器的16S rRNA基因,如Cas-16S-seq方法;④改变PCR扩增流程,以尽可能减少宿主细胞器基因序列扩增,如巢式PCR方法和ham PCR方法。
但是上述这些方法在应用过程中都有一定的缺陷,如:特异性错配引物应用于不同的植物样品时,减少宿主基因污染的效果各异;添加特异性阻断物能够阻断宿主细胞器基因序列扩增,但最常用的PNA-PCR钳位技术在研究过程中也出现了阻断效果变差的问题;巢式PCR方法和ham PCR方法在现有的研究中虽均有很好的减少宿主细胞器基因污染的效果,但其普适性还有待证明。因此,目前还没有一种方法能够对不同种类的植物、不同的植物部位、不同的植物生长时期都有很好的减少宿主基因污染的效果。在后续植物内生菌研究中,要想降低16S-seq中宿主细胞器基因序列的污染,还需要对不同植物样本选择相应的减少宿主细胞器基因污染的方法,并根据宿主细胞器基因细胞器序列选择或设计相应的特异性引物或阻断物,同时尝试将不同方法相结合,用于弥补单一方法的缺陷,在加强对宿主细胞器基因序列抑制的同时,以保证植物内生菌基因序列的大量扩增。

