大白菜生物钟突变体 lcc-1 突变表型的遗传分析
马孝颖 王浩 任桂康 张云芹 李岩 赵姣姣 闫奕彤 李昊轩 杜佳宁 于新册 崔维霞 甄艺博 卢银 冯大领





摘要:对甲基磺酸乙酯(EMS)诱变获得的生物钟长周期突变体lcc-1、野生型WT、杂交F2群体及回交B1和B2群体进行田间表型性状调查,并对下胚轴长度、现蕾时间2个突变性状进行遗传分析。结果表明,lcc-1下胚轴长度、株高、开展度、外叶长、中肋长度均极显著小于WT,现蕾时间极显著长于WT。F2代分离群体遗传分析结果表明,下胚轴长度及现蕾时间性状均符合2对加性-显性-上位性主基因+加性-显性多基因模型。结果可为调控生物钟和现蕾时间关键基因的挖掘和基因功能深入研究提供数据支持。
关键词:大白菜;生物钟突变体;遗传分析;下胚轴长度
中图分类号:S634.103 文献标志码: A
文章编号:1002-1302(2022)05-0117-06
收稿日期:2021-06-27
基金项目:河北省高等学校科学技术研究项目(编号:BJ2019020);大学生创新创业训练计划项目(编号:2020201)。
作者简介:马孝颖(1998—),女,河北张家口人,硕士研究生,主要从事园艺植物育种研究,E-mail:mxy1367234461@163.com;共同第一作者:王 浩(1991—),男,河北石家庄人,硕士研究生,主要从事植物种质资源创新及育种应用研究,E-mail:1731251173@qq.com。
通信作者:卢 银,博士,讲师,主要从事蔬菜分子染色体工程、蔬菜种质资源评价与创新利用研究,E-mail:luagzoujidong@163.com;冯大领,博士,副教授,主要从事大白菜种质资源创新及育种应用,E-mail:bjdalingfeng@163.com。
大白菜是我国重要的叶用蔬菜,也是我国栽培面积和种植区域最广的蔬菜作物之一,深受人们的喜爱。随着大白菜全基因组测序的完成,其功能基因组学的研究得到快速发展,尤其是甲基磺酸乙酯(EMS)突变体库的构建为大白菜农艺性状相关优异基因的挖掘提供了很好的研究材料。Liu等从大白菜EMS诱变群体中获得了一株蜡质缺失突变体cer1[1]。刘文杰等从EMS突变体库中筛选获得了雄性不育、叶面刺毛突变体[2]。河北农业大学研究人员获得了不同叶色、不同叶球、不同植株大小以及长生物钟周期等多种类型的突变体[3-5]。
昼夜节律钟(circadian clock)即生物钟,是植物生命活动的内在节律,可参与调控植物的营养生长、生殖生长、应对非生物胁迫、代谢活动等生长代谢过程,增强植物的环境适应性[6]。Lei等阐述了生物钟ASSOCIATED1(CCA1)和LATE ELONGATED HYPOCOTYL(LHY)是拟南芥生物钟的核心组成部分,影响植物对生物胁迫的响应[7]。现阶段对于生物钟突变体的表型性状已有大量试验分析,前人以模式植物拟南芥为试材,探讨了生物钟突变体营养生长时相的转变、光合作用和根吸收速率的变化等[8-9]。大白菜与拟南芥相比,基因組经历了三倍化事件,其基因功能及调控机制较模式植物拟南芥复杂的多,而大白菜的研究报道还较少。笔者所在实验室筛选到一个大白菜长生物钟周期的突变体,其表型表现为胚轴伸长,现蕾开花时间延迟。哪些基因发生了突变引起表型的变化有待于进一步研究。遗传分析(genetic analysis)是突变体突变基因挖掘研究的重要途径。通过调查突变体与野生型杂交、回交群体突变表型分离情况,分析突变基因的遗传特性。Elston首次提出,主基因+多基因混合遗传模型[10];盖钧镒利用此遗传模型建立了可同时鉴别1~3个主基因和多基因整体效应的分析方法[11]。对表型性状进行遗传分析可确定该性状的遗传规律。
本研究以生物钟长周期突变体lcc-1(Long-period circadian clock-1)及野生型WT为材料,通过构建突变体与野生型的F2代及回交群体,并对亲本、F1代及群体的突变表型性状及分离情况进行调查,利用主基因+多基因混合遗传模型进行遗传分析,该研究为探索各突变表型的遗传规律及突变基因的深入挖掘奠定了基础。
1 材料与方法
1.1 供试材料
本研究以野生型WT、EMS诱变获得的长生物钟突变体lcc-1、野生型与突变体杂交F1代、F2代、回交群体B1和B2为试验材料(图1-a)。突变体lcc-1与野生型WT相比具有下胚轴长(图1-b)、延迟现蕾和开花(图1-c)、生物钟周期延长1.43 h的突变表型。
1.2 试验方法
1.2.1 大白菜田间表型性状调查方法
本试验材料以穴盘育苗、成苗后定植在河北农业大学教学试验基地,分2个时间播种调查。2018年1月16日播种,3月7日定植于露地,调查生殖生长阶段表型;2018年8月5日播种,9月1日定植于露地,调查营养生长阶段表型。调查性状及方法参考国家标准GB/T 19557.5—2004《植物新品种特异性、一致性和稳定性测试指南 大白菜》并略作调整(表1)。生殖生长时期调查的表型包括现蕾时间、薹长、开花时间;营养生长时期调查的表型包括下胚轴长度、株高、开展度、外叶长、外叶宽、外叶叶柄长。
1.2.2 数据统计与分析方法
使用Microsoft Excel软件和IBM SPSS Statistics 19.0软件对lcc-1的9个表型进行分析,设置3个重复,计算平均值,并进行t测验。
依据统计学方法整理春季4世代P1、P2、F1、F2和秋季6世代P1、P2、F1、F2、B1、B2各群体表型数据,参照盖钧镒鉴别1~3个主基因和多基因整体效应的分析方法[11-12],使用华中农业大学植物数量性状分离分析软件包SEA,对本试验拟分析的3个数量性状进行主基因-多基因模型的多世代联合分析,得到这3个数量性状的遗传模型以及与之相对应的AIC值,对备选模型进行一组(U21、U22、U23、nW2、Dn)适合性检验,选择统计量达到显著水平个数较少的模型作为最优模型,计算出遗传率。调查F2分离群体中现蕾时间突变型与野生型的植株数,再根据卡方检测方法,测定其结果,确定分离比例,进而推导出相应基因的遗传规律。
2 结果与分析
2.1 野生型WT与突变体lcc-1的表型特征差异
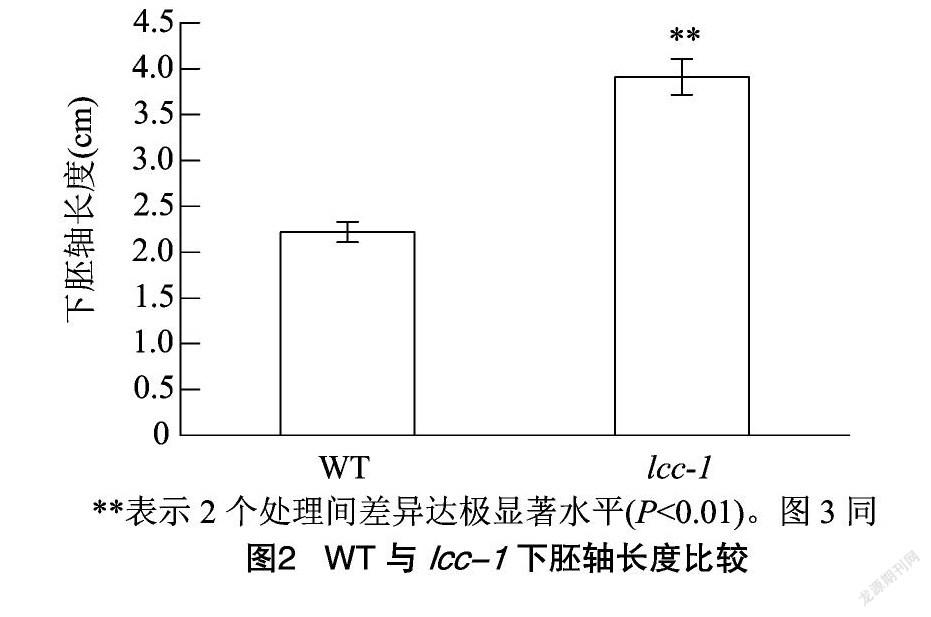
由图2可知,WT下胚轴平均长度为2.22 cm,lcc-1下胚轴平均长度为3.91 cm,lcc-1下胚轴极显著长于WT(P<0.01)。
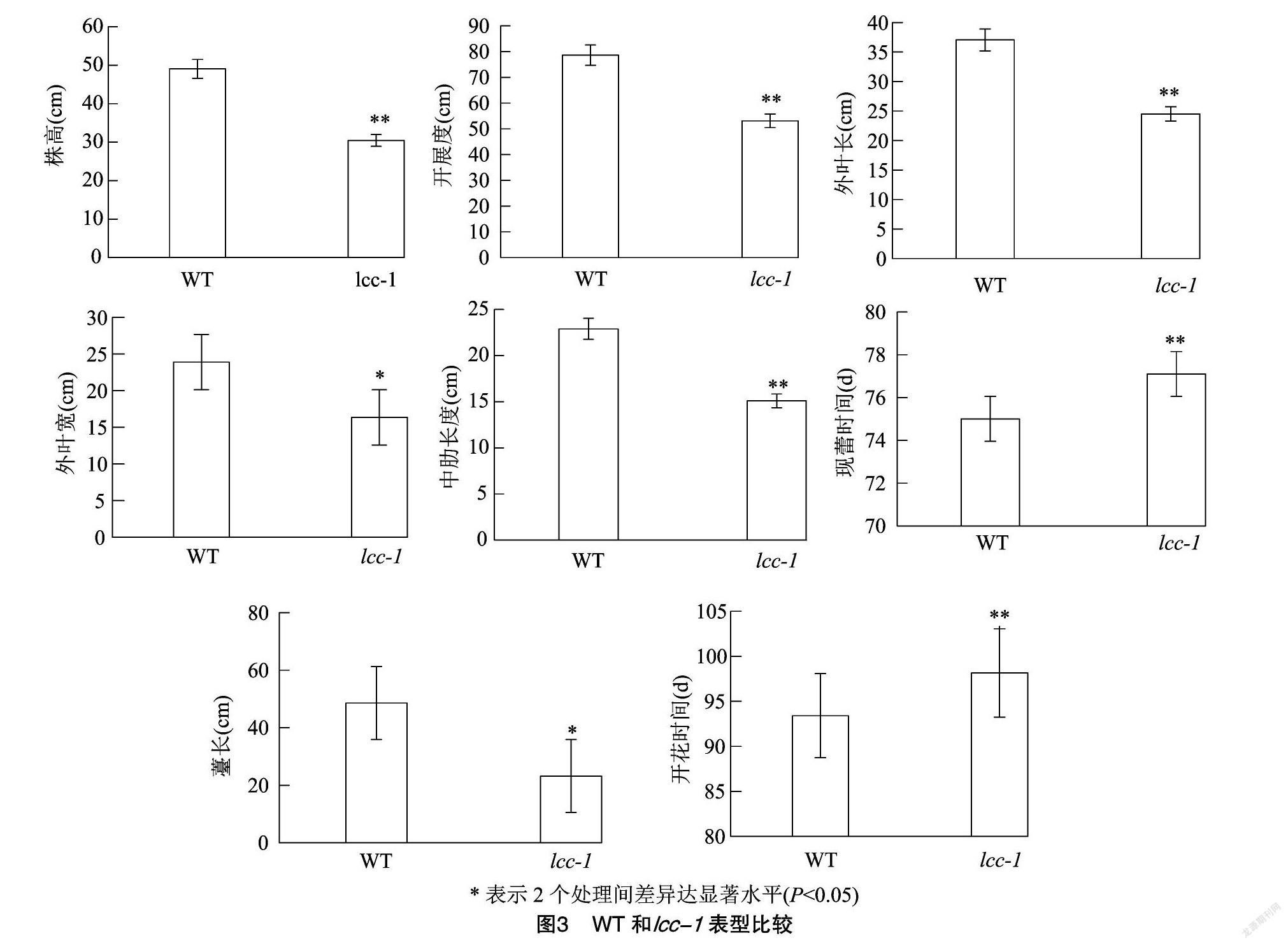
由圖3可知,WT平均株高49.08 cm,lcc-1平均株高30.46 cm,WT平均开展度78.59 cm,lcc-1平均开展度53.10 cm,WT平均外叶长37.04 cm,lcc-1平均外叶长24.50 cm,WT平均中肋长度22.90 cm,lcc-1平均中肋长度15.10 cm,以上表型lcc-1均较WT明显减小,差异达极显著水平;WT平均现蕾时间75.0 d,lcc-1平均现蕾时间77.1 d,WT平均开花时间93.4 d,lcc-1平均开花时间98.15 d,以上表型lcc-1均较WT明显增加,差异达极显著水平;WT薹长48.6 cm,lcc-1薹长23.22 cm,WT叶片宽 23.88 cm,lcc-1叶片宽16.33 cm,以上表型lcc-1均较WT明显减少,差异达显著水平。从株高、开展度、外叶长、外叶宽、中肋长度和薹长的数据看,lcc-1植株显著或极显著小于WT。从自然春化条件下的现蕾时间和开花时间看,lcc-1现蕾和开花时间极显著长于WT。
2.2 突变体lcc-1下胚轴长度的遗传分析
lcc-1下胚轴平均长度为3.91 cm,WT下胚轴平均长度为2.22 cm,WT平均下胚轴长度仅为lcc-1的56.78%,t测验结果表明,2个亲本的下胚轴长度存在极显著差异,F1平均下胚轴长度为 2.68 cm,偏向于短下胚轴WT。F2、B1、B2的下胚轴长度均呈现偏正态分布(图4-a、图4-b、图4-c)。
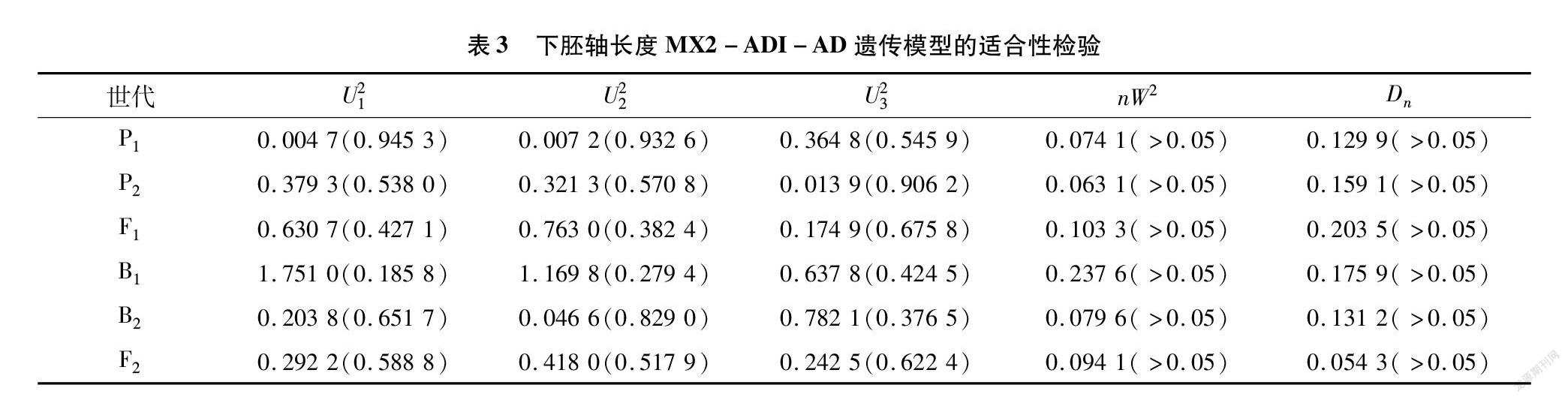
用植物数量性状主基因+多基因遗传模型的多世代联合分析方法对6个世代群体下胚轴长度进行联合分析,分别计算6个世代群体在24种遗传模型下的极大似然函数值(MLV)和AIC值。根据AIC准则,在备选遗传模型中,AIC最小者为最优模型。由表2可知,AIC值较低的是2MG-ADI(2对加性-显性-上位性主基因模型)、PG-ADI(加性-显性-上位性多基因模型)、MX1-AD-ADI (1对加性-显性主基因+加性-显性多基因模型)、MX2-ADI-ADI(2对加性-显性-上位性主基因和加性-显性-上位性多基因模型)、MX2-ADI-AD(2对加性-显性-上位性主基因+加性-显性多基因模型),共5个模型,其AIC值分别为432.277 2、405.791 6、408.246 5、419.434 3、420225 0。
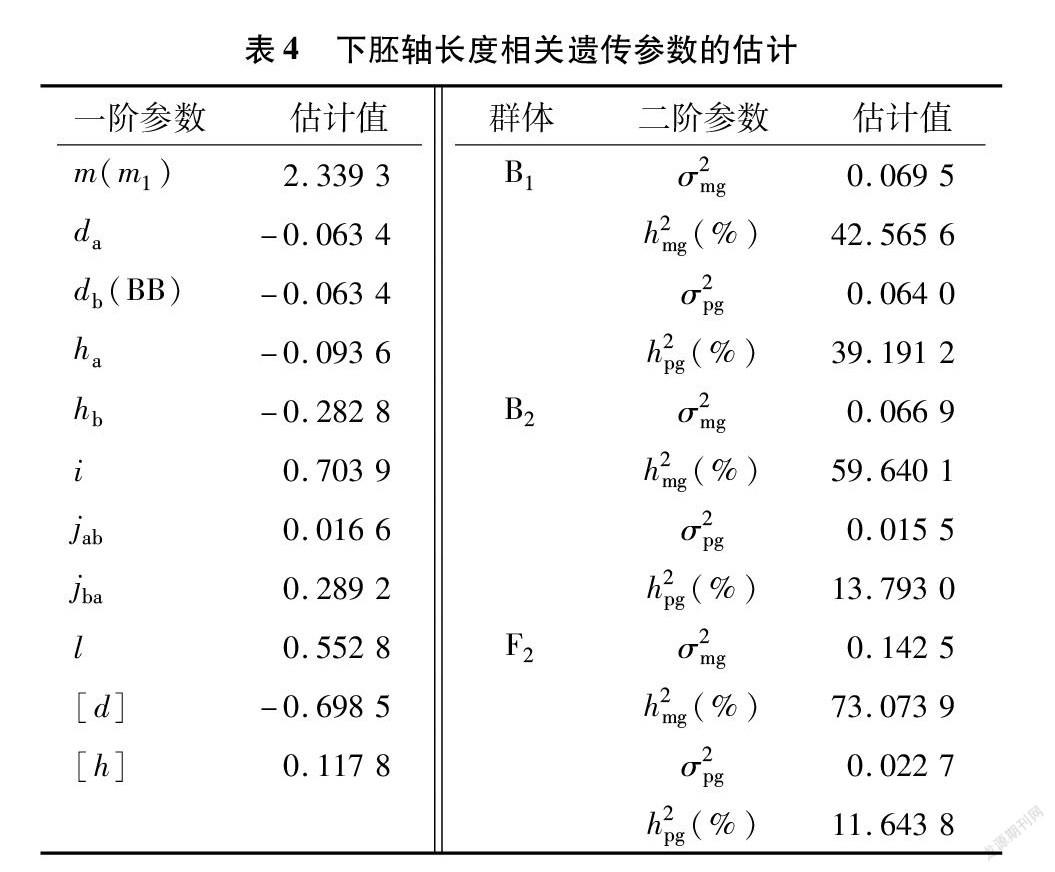
适合性检验结果(表3)表明,5个模型均符合,但MX2-ADI-AD模型适合性检验效果最佳,且AIC值较小。因此,可确定 MX2-ADI-AD(2对加性-显性-上位性主基因+加性-显性多基因模型)为大白菜下胚轴长度的最佳遗传模型。
由表4可知,MX2-ADI-AD模型中2对主基因的加性效应值均为-0.063 4,显性效应分别为-0.093 6和-0.282 8,显性效应值大于加性效应值,说明2对主基因遗传以显性效应为主。在B1、B2、F2群体中,主基因的遗传率各不相同。在F2群体中,主基因遗传率最高,为73.073 9%。在B1群体中主基因遗传率为42.565 6%,低于50%。在B2群体中主基因遗传率为59.640 1%。B1、B2、F2多基因的遗传率分别为39.191 2%、13.793 0%、11.643 8%,主基因遗传率均大于多基因遗传率:环境因素引起的遗传变异较小。
2.3 突变体lcc-1现蕾时间的遗传分析
lcc-1现蕾时间平均值为77.1 d,WT现蕾时间平均值为75.0 d,lcc-1现蕾时间比WT晚2.1 d。对2个亲本的现蕾时间平均值进行t测验后可知,2个亲本间的现蕾时间差异达到极显著水平,说明亲本间存在显著的遗传差异。F1代现蕾时间平均值为75.75 d,偏向于WT。由F2现蕾时间的次数分布(图5)可知,F2世代现蕾时间的分布偏正态分布。
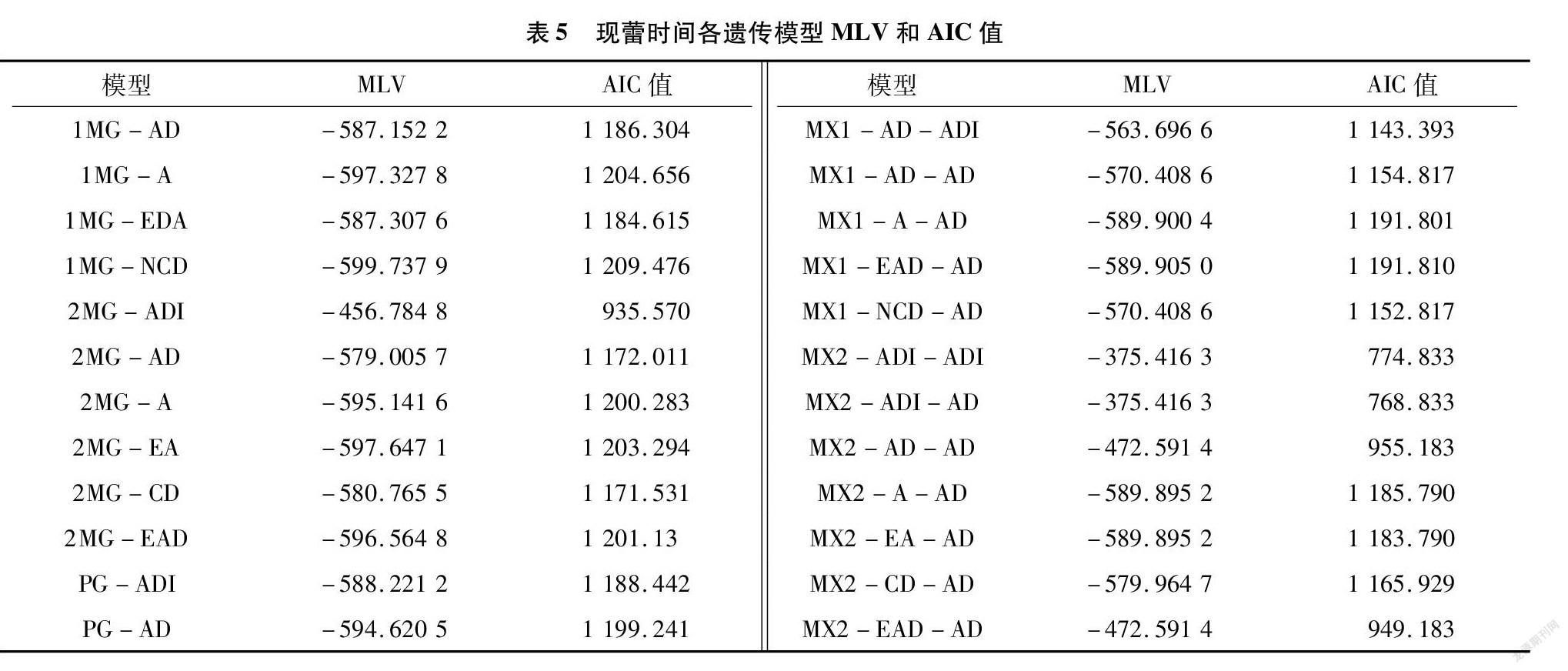
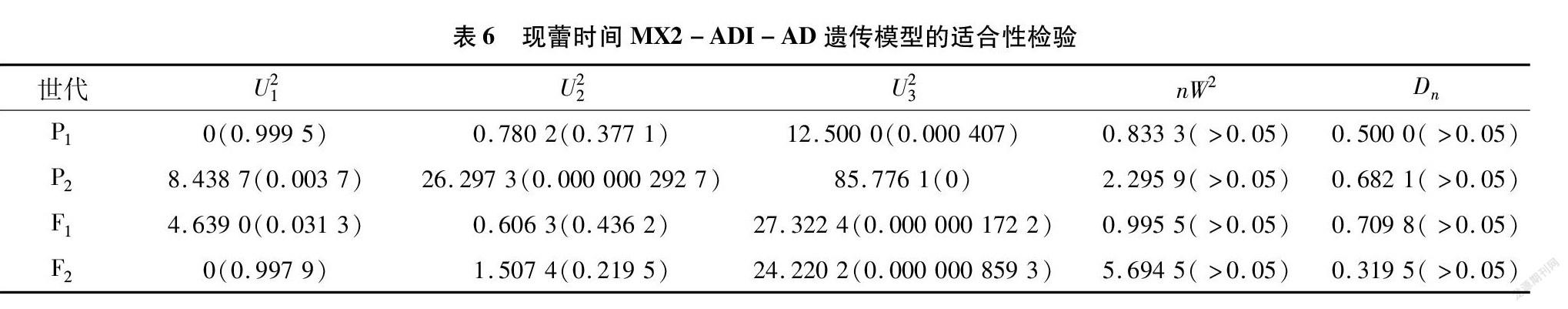
用植物数量性状主基因+多基因遗传模型的多世代联合分析方法对4个世代群体开花时间进行联合分析,分别计算4个世代群体在24种遗传模型下的MLV和AIC值。根据AIC准则,在备选遗传模型中,AIC最小者为最优模型。由表5可知,AIC值较低的是MX2-ADI-AD、MX2-ADI-ADI 这2个模型,其AIC值分别为768.832 5、774.832 5。故初步确定这2个模型为4世代群体现蕾时间遗传的候选模型。
适合性检验结果(表6)表明,5个模型均通过适合性测验,但MX2-ADI-AD适合性检验效果最佳,且AIC值和MLV均较小。因此,综合以上分析,确定MX2-ADI-AD(2对加性-显性-上位性主基因+加性-显性多基因模型)为调控大白菜突变体现蕾时间的最佳遗传模型。
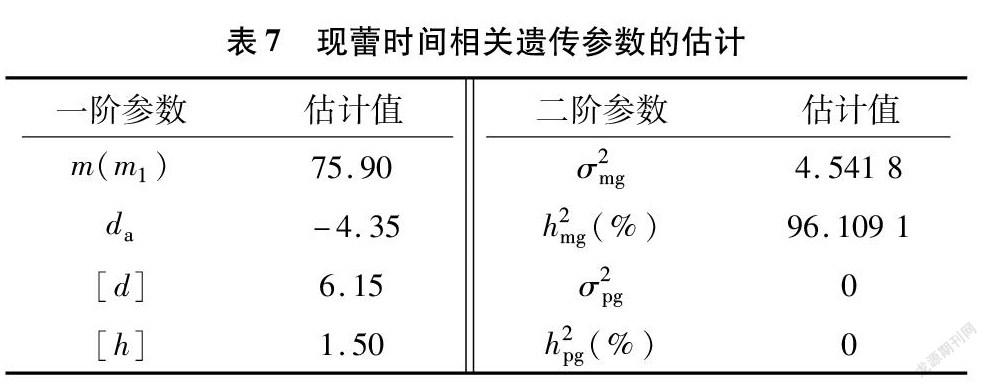
由表7可知,MX2-ADI-AD模型下的遗传参数,现蕾时间是由2对主基因+多基因控制的,且第1个主基因具有负向的加性效应,在F2群体中主基因遗传率是96.109 1%,多基因遗传率未检测出,说明F2群体中现蕾时间以主基因遗传为主。
3 结论与讨论
筛选获得,该方法以获得SNP单碱基突变为主,无大片段DNA变异,而调查结果表明,lcc-1突变体却同时具有生物钟周期变长、下胚轴变长、晚花等多个不同突变表型,且相关性状均存在显著差异。因此,可能存在一因多效和多基因突变2种情况。在已有研究中,生物钟变化导致植物下胚轴长度、开花时间和植株大小的改变均有报道。前人研究发现,拟南芥隐花色素CRY2蛋白大量积累可获得早花突变体,在低强度蓝光下下胚轴明显伸长[13];TCP2蓝光依赖性地抑制拟南芥下胚轴的伸长,其功能缺失突变体具有晚花的表型[14];GmPHYB1过表达使拟南芥株型矮化紧凑,在短日条件下提前开花并强烈抑制下胚轴的伸长[15];GI和CO基因受生物钟调控,在长日照条件下,GI和CO基因会促进拟南芥开花[16]。拟南芥ZEITLUPE(ZTL) 家族成员的突变会影响昼夜节律和开花时间[17]。本研究中对下胚轴长度和现蕾时间2个突变性状的遗传分析结果均符合2对加性-显性-上位性主基因+加性-显性多基因的遗传模型,可推测这些性状可能由调控生物钟相关基因的突变引起,但须要进一步借助Mutmap、重测序、转基因等技术手段深入挖掘研究。
参考文献:
[1]Liu C H,Song G X,Wang N,et al. A single SNP in Brcer1 results in wax deficiency in Chinese cabbage (Brassica campestris L. ssp. pekinensis)[J]. Scientia Horticulturae,2021,282:110019.
[2]刘文杰,黄胜楠,刘志勇,等. 大白菜雌不育突变体fsm花蕾激素代谢的转录组分析[J]. 沈阳农业大学学报,2019,50(2):138-145.
[3]Lu Y,Dai S Y,Gu A X,et al. Microspore induced doubled haploids production from ethyl methanesulfonate (EMS) soaked flower buds is an efficient strategy for mutagenesis in Chinese cabbage[J]. Frontiers in Plant Science,2016,7:1780.
[4]王 浩,卢 银,顾爱侠,等. 大白菜lcc-1突变体生物钟核心基因在不同光周期下的表达分析[J]. 河北农业大学学报,2019,42(4):21-28.
[5]Li J R,Zhang X M,Lu Y,et al. Characterization of non-heading mutation in heading Chinese cabbage (Brassica rapa L.ssp.pekinensis)[J]. Frontiers in Plant Science,2019,10:112.
[6]Steed G,Ramirez D C,Hannah M A,et al. Chronoculture,harnessing the circadian clock to improve crop yield and sustainability[J]. Science,2021,372(6541):9141.
[7]Lei J X,Zhu-Salzman K.LATE ELONGATED HYPOCOTYL potentiates resistance conferred by CIRCADIAN CLOCK ASSOCIATED1 to aphid by co-regulating the expression of indole glucosinolate biosynthetic genes[J]. Plant Signaling & Behavior,2021,16(6):1908708.
[8]傅 钰,王 苓,龙 鸿.拟南芥生物钟双突变体lhycca1营养生长时相转变[J]. 热带作物学报,2019,40(6):1089-1094.
[9]Xu G,Jiang Z M,Wang H Y,et al. The central circadian clock proteins CCA1 and LHY regulate iron homeostasis in Arabidopsis[J]. Journal of Integrative Plant Biology,2019,61(2):168-181.
[10]Elston R C. The genetic analysis of quantitative trait differences between two homozygous lines[J]. Genetics,1984,108(3):733.
[11]盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传,2005,27(1):130-136.
[12]Faure S,Turner A S,Gruszka D,et al. Mutation at the circadian clock gene EARLY MATURITY 8 adapts domesticated barley (Hordeum vulgare) to short growing seasons[J]. PNAS,2012,109(21):8328-8333.
[13]郭亚蓉,王艳艳,刘 军,等. 拟南芥隐花色素CRY2调控因子PRP8基因的功能分析[J]. 生物技术进展,2019,9(2):169-177.
[14]何志敏. 拟南芥转录因子TCP2与CRY1相互作用的遗传学与生化分析[D]. 长沙:湖南大学,2016.
[15]吳发强. 大豆光敏色素基因的克隆和功能研究[D]. 北京:中国农业科学院,2011.
[16]帅敏敏,黄有军. 光周期途径成花关键基因GIGANTEA和CONSTANS的研究进展[J]. 分子植物育种,2018,16(17):5601-5607.
[17]柯海燕. 大豆生物钟基因——ZEITLUPE同源基因的克隆及其功能分析[D]. 福州:福建农林大学,2006.

