基于重水拉曼技术的白色念珠菌对变异链球菌代谢活性和耐药性影响的研究
李修珍姜明张颖刘育含李帆曾飞,5马玉莹,5杨加震,5杨芳
1.青岛大学口腔医学院,青岛266003;
2.青岛大学附属青岛市市立医院口腔医学中心,青岛266071;
3.中国人民解放军东部战区总医院,南京210002;
4.天津医科大学口腔医学院,天津300070;
5.大连医科大学口腔医学院,大连116044
氟化钠(sodium fluoride,NaF)是一种用于防龋的常见局部氟化物[1]。NaF防龋的主要作用机制:氟离子能与釉质中的羟磷灰石发生反应取代磷灰石结晶的羟离子,而形成难溶于水的氟磷灰石,增强耐酸力,促进再矿化[2];抑制主要致龋菌的生长代谢以及胞外多糖的生成,阻碍细菌在牙面上的黏附与定植[3];有效的抑酶剂,能抑制细菌胞内烯醇酶和三磷酸腺苷酶(adenosine triphosphatase,ATPase)的活性[4],减少有机酸的形成。
在龋病的四联因素学说中,病原微生物的作用占主导地位;了解微生物之间相互协作、相互竞争的关系有助于探索防治微生物感染的新策略[5]。变异链球菌(Streptococcus mutans,S.mutans)是重要的致龋菌株,可通过细胞代谢作用将饮食中的碳水化合物转化为酸并造成牙齿硬组织脱矿,最终导致龋齿的发生[6]。白色念珠菌(Candida albicans,C.albicans)是龋齿菌斑样本中最常分离到的条件致病真菌种类[7],尤其是在低龄儿童龋样本中常与变异链球菌一同被检出[8-10]。这种细菌和真菌的共生关系是否促进生物膜毒力增强有待进一步阐明[11]。因此,目前针对变异链球菌和白色念珠菌的相关性研究受到国内外学者的广泛重视。
随着细菌耐药性问题的日益突出,临床亟需新型抗菌剂以及创新型的药物评价体系[12]。传统药物评价体系采用稀释法和扩散法来进行监测,通过最小抑制浓度(minimum inhibitory concentration,MIC)对目标药物进行定量评价[13],但是不生长不代表微生物无代谢活性,此类不生长但有代谢活性(non-growing but metabolically active,NGMA)的微生物细胞往往是感染复发的关键[14],增加细菌感染性疾病的治疗难度。另外该评价体系只能将微生物视为表型一致的群体却忽略细胞异质性的存在,而药物作用下细胞的异质性正是产生耐药性的重要途径。重水拉曼技术则不需要外源性标记且能揭示细菌细胞的代谢活性信息,反映细胞对药物的应激模式并评价药物疗效。其原理是当细菌摄入比胞内元素质量更大的同位素时,相应物质所对应的拉曼峰会向波数减少的方向漂移,使拉曼图谱特定区域(2 040~2 300 cm-1)出现重水峰。同位素的特异性漂移则作为微生物是否摄入同位素标记底物和摄入量的指示标志,这与微生物在单细胞层面上的细胞功能存在密切联系。
重水拉曼技术基于ΔC-D ratio测定的最小代谢抑制浓度(minimum inhibitory concentration based on metabolic activity,MIC-MA)可定量评价抗菌剂对目标菌种的代谢活性抑制作用[15-16]。该技术已成功应用于评价抗菌剂对细菌、真菌代谢活性的影响[16],但是多种微生物的代谢互作以及耐药性研究相对较少见。因此,本研究采用重水拉曼技术在单细胞尺度下,系统研究白色念珠菌对变异链球菌代谢活性及耐药性的影响,为预防和治疗由这两种微生物为主引起的口腔疾病提供新的启示和思路。
1 材料和方法
1.1 实验材料和菌株培养
1.1.1 实验材料 实验用标准菌株变异链球菌UA159、白色念珠菌ATCC10231购自中国医学菌种保藏中心;脑心浸液培养基(brian heart infusion,BHI)固体培养基:称取BHI粉3.85 g,1.5 g琼脂粉,溶于100 mL双蒸水,121℃下高温高压灭菌15 min,待琼脂稍冷后超净台内倒平板,凝固后封口膜封口,4℃冰箱保存;BHI液体培养基:称取BHI粉3.85 g,溶于100 mL双蒸水,121℃下高温高压灭菌15 min,待冷却至室温时于4℃冰箱保存;NaF溶液:称取NaF粉120 mg,溶于10 mL双蒸水,0.22μm针头式滤膜过滤除菌,配制成1.2 g·L-1NaF溶液,-20℃冰箱保存。
1.1.2 实验菌株的培养 将变异链球菌UA159和白色念珠菌ATCC10231划线接种到BHI固体培养基,变异链球菌37℃厌氧培养36 h;白色念珠菌37℃培养24 h。分别挑取变异链球菌和白色念珠菌菌落转种于BHI液体培养基中,变异链球菌37℃厌氧活化12 h,白色念珠菌37℃活化12 h备用。
1.2 变异链球菌纯培养体系中MIC和MIC-MA的测定
采用肉汤稀释法测定NaF对变异链球菌的MIC。用分光光度计分别测定培养前后600 nm波长处的光密度(optical density,OD)值。调整菌液密度至OD600=0.5,将所获菌液加入不同浓度NaF实验组(0、0.2、0.4、0.6、0.8、1.2、1.6、2.0 g·L-1)及空白对照组中,37℃厌氧培养24 h。ΔOD600(0和24 h OD600的变化)≤0.05,对应的最低药物浓度,即NaF对变异链球菌的MIC[17]。
采用重水拉曼技术测定NaF对变异链球菌的MIC-MA。将变异链球菌菌液按培养体系总体积的10%接 种 至 含0、0.4、0.8、1.2、1.6、2.0 g·L-1NaF的BHI培养基(含30%重水)中,37℃厌氧培养,按0、1、2、4、8、12 h时间梯度取样,每次取待测样品1 000μL,用ddH2O洗涤3次,离心转速为12 000 r·min-1,离心2 min,最后用ddH2O重悬细菌沉淀。取1.5μL重悬菌液,滴入CaF2玻片,自然风干。利用LabRam HR型的改良后共聚焦拉曼荧光显微镜,在100倍物镜下随机收集30个拉曼图谱。参数设定如下:激光源为532 nm的Nd:YAG激光源,样品上激光强度50 mW,照射时间1 s,分光光栅300 grooves·mm-1,拉曼图谱范围400~3 500 cm-1。图谱经过减背景,基线归一化,最大值标准化处理。计算ΔC-D ratio(培养0与8 h的C-D ratio差值),当ΔC-D ratio≤0且标准差<0.005,即为NaF对变异链球菌的MIC-MA[16]。实验重复3次。
1.3 不同浓度的白色念珠菌上清液对变异链球菌重水代谢能力的影响
白色念珠菌上清液的制备:取活化后的白色念珠菌菌液配置初始OD600=4的白色念珠菌菌液,作为母液,按照浓度梯度进行稀释。将不同浓度的菌液进行离心,13 000 r·min-1离心3 min,吸取上清液并用0.22μm孔径的过滤器进行过滤去除全部细胞后,置于4℃备用。
变异链球菌菌液(OD600=0.5)离心后将沉淀置于含30%浓度重水的BHI培养基中培养,同时按培养体系总体积10%的比例加入不同浓度的白色念珠菌上清液(OD600为0.05、0.1、0.5、2.5、4.0)刺激,阴性对照为纯培养变异链球菌。将菌液放置于37℃培养箱中厌氧培养,按0、1、2、4、8、12 h时间梯度取样,每次取待测样品1 000μL,用ddH2O洗涤3次,离心转速为12 000 r·min-1,离心2 min,最后用ddH2O重悬细菌沉淀。取1.5μL重悬菌液,滴入CaF2玻片,自然风干。拉曼采集条件设置详见1.2。实验重复3次。
1.4 混合培养体系中白色念珠菌上清液对变异链球菌的耐药性影响
白色念珠菌上清液的制备方法见1.3。将变异链球菌接种至含不同浓度NaF(0、0.4、0.8、1.2、1.6、2.0 g·L-1)的BHI培养基(含30%重水)中,同时按培养体系总体积的10%加入OD600=0.5的白色念珠菌上清液刺激。将菌液放置于37℃培养箱中厌氧培养,按0、1、2、4、8、12 h时间梯度取样,每次取待测样品1 000μL,用ddH2O洗涤3次,离心转速为12 000 r·min-1,离心2 min,最后用ddH2O重悬细菌沉淀。取1.5μL重悬菌液,滴入CaF2玻片,自然风干。100倍物镜下在不同视野内随机采集30个拉曼图谱,实验重复3次。
1.5 统计学分析
实验中定量数据均采用均数±标准差表示。采用SPSS 17.0软件进行统计学分析,统计方法采用T检验,检验水准为双侧α=0.05。实验结果采用R Version 3.6.1软件包进行统计学分析,拉曼图谱之间的比较采用Wilcoxon秩和检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 NaF对纯培养变异链球菌MIC和MIC-MA的测定
不同浓度NaF对于纯培养变异链球菌的MIC测定结果。ΔOD600(0 h和24 h OD600的变化)≤0.05,对应的最低药物浓度,即NaF对变异链球菌的MIC。当NaF浓度为0、0.2 g·L-1时,测得的ΔOD600分别为0.293、0.278,即ΔOD600>0.05;而当NaF浓度为0.4、0.6、0.8、1.2、1.6、2.0 g·L-1时,测得的ΔOD600分别为0.014、0.002、0.002、0.003、0.001、0.003,即ΔOD600<0.05。因此,NaF对变异链球菌的MIC为0.4 g·L-1。
不同浓度NaF对于纯培养变异链球菌的MICMA测定结果见图1。当ΔC-D ratio(培养0与8 h的C-D ratio差值)≤0且标准差<0.005,即为NaF对变异链球菌的MIC-MA。当NaF浓度在MIC(0.4 g·L-1),2×MIC(0.8 g·L-1)时,ΔC-D ratio>0;在3×MIC(1.2 g·L-1),4×MIC(1.6 g·L-1),5×MIC(2.0 g·L-1)时,ΔC-D ratio<0。因此,NaF对变异链球菌的MIC-MA为1.2 g·L-1,即3×MIC。即NaF在MIC-MA浓度作用下变异链球菌的代谢活性才得到完全抑制。
变异链球菌UA159在不同浓度药物[0、MIC(0.4 g·L-1)、MIC-MA(1.2 g·L-1)]刺激下,作用8 h后的C-D ratio强度见图2所示。随着NaF浓度升高,C-D ratio逐渐降低。

图2 变异链球菌UA159在不同浓度NaF作用8 h的单细胞拉曼图谱Fig 2 The temporal change of SCRS for S.mutans UA159 under different concentrationsof NaFat 8 h
随着NaF浓度的升高,ΔC-D ratio呈下降趋势,表现为负相关。当药物浓度达到MIC-MA时,绝大多数变异链球菌进入小于0的“代谢静止区”,而在MIC浓度下,大部分细菌仍存在一定的代谢活性。变异链球菌在不同浓度NaF作用下C-D ratio的时间梯度曲线显示见图3,MIC浓度下的变异链球菌UA159的C-D ratio有一定幅度的回升(27.2%),此时的NaF对变异链球菌的抑制代谢活性程度仅达72.8%,而药物浓度在MIC-MA时,变异链球菌的代谢活性在12 h内始终保持在基线水平(抑制代谢活性程度=X0-X1/X0-X2,X0为12 h时对照组的C-D ratio,X1为12 h时NaF在MIC浓度下的C-D ratio,X2为12 h时NaF在MIC-MA浓度下的C-D ratio)。

图3 12 h内变异链球菌在不同浓度NaF作用下C-D ratio的时间梯度曲线Fig 3 Temporal dynamics of C-D ratio of S.mutans UA159 under different concentrationsof NaFin 12 h
2.2 不同浓度的白色念珠菌上清液对变异链球菌重水代谢能力的影响
无药物刺激下,变异链球菌在不同浓度的白色念珠菌上清液作用下C-D ratio的时间梯度曲线见图4。当白色念珠菌上清液OD600<0.5时,混合体系中变异链球菌的重水代谢能力与纯培养相比差异无统计学意义(P>0.05)。当OD600≥0.5时,变异链球菌的重水代谢能力明显高于纯培养体系,且在不同时间点差异均有统计学意义(P<0.05),提示低浓度(OD600<0.5)的白色念珠菌上清液并未引起变异链球菌的代谢改变。而当上清液OD=2.5、OD=4.0时,变异链球菌的重水代谢活性在生长稳定期(8、12 h)时与OD600=0.5时相比差异不存在统计学意义(P>0.05)。因此OD600=0.5默认为引起变异链球菌UA159代谢活性升高的浓度阈值,且已经饱和。因此,本研究选取OD600=0.5来进行下一步白色念珠菌上清液对变异链球菌的耐药性研究。

图4 变异链球菌UA159在不同浓度的白色念珠菌上清液作用下C-D ratio的时间梯度曲线Fig 4 Temporal dynamics of C-D ratio of S.mutans UA159 under different concentrationsof C.albicans supernatant
2.3 混合培养体系中NaF对变异链球菌的抑菌效能评价
不同浓度NaF刺激下,变异链球菌在OD600=
0.5的白色念珠菌上清液作用下C-D ratio的时间梯度曲线见图5。结果显示在NaF浓度≤1.2 g·L-1的刺激时,白色念珠菌上清液与变异链球菌的混合体系重水代谢能力均较纯培养体系有一定的提高,不同时间点差异均有统计学意义(P<0.05)。而当NaF浓度>1.2 g·L-1,这种促进作用被抑制,不同时间点差异无统计学意义(P>0.05)。因此,白色念珠菌上清液的加入使变异链球菌的代谢活性升高,从而降低了其对NaF的药物敏感性;但当NaF浓度足够高时(4×MIC、5×MIC),混合体系中的变异链球菌的代谢活性同样可得到完全的抑制,并在监测周期内未见恢复代谢活性。
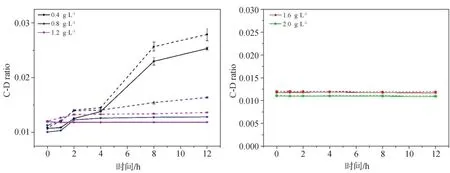
图5 不同NaF浓度时,变异链球菌在加或不加白色念珠菌上清液体系中的C-D ratio时间梯度曲线Fig 5 Temporal dynamicsof C-D ratio of S.mutans UA159 under different concentrationsof NaFwith or without adding the C.albicans supernatant
加入白色念珠菌上清液的混合培养体系中,NaF对变异链球菌的MIC-MA测定结果见图6。随着NaF浓度的升高,ΔC-D ratio呈下降趋势,表现为负相关。当药物浓度达到纯培养体系的MICMA,即1.2 g·L-1,此时的变异链球菌仍存在一定的代谢活性,直到1.6 g·L-1,绝大多数细菌进入小于0的“代谢静止区”。因此,混合培养体系中,NaF对变异链球菌的MIC-MA较纯培养体系升高,即1.6 g·L-1,提示白色念珠菌上清液的加入协同增强了变异链球菌的毒力,使其对NaF的药物敏感性降低。
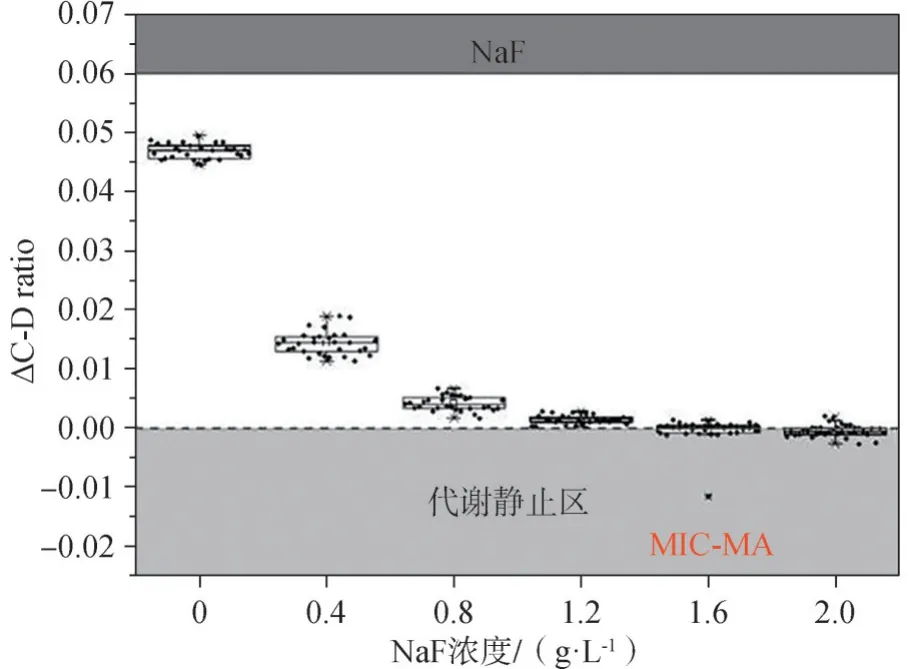
图6 混合体系中,NaF对变异链球菌UA159的MIC-MA测量Fig 6 Themeasurement of MIC-MA of NaFfor S.mutans UA159 in themixed system
3 讨论
本研究采用肉汤稀释法和重水拉曼技术,确定了纯培养条件下NaF对变异链球菌的MIC及MICMA,定量评价NaF对变异链球菌的抑菌效能。同时本文建立了细菌-真菌互作模型,系统研究白色念珠菌对变异链球菌代谢活性及耐药性的影响,旨在为后期探讨两菌的相互作用及产物利用关系奠定基础。
由于在龋齿菌斑生物膜样本的大量存在,变异链球菌是目前公认与龋病关系最密切的口腔细菌。变异链球菌的关键毒力因素是通过葡糖基转移酶(glucosyltransferases,Gtfs)将膳食中的蔗糖转化为胞外多糖,而富含胞外多糖的基质可作为一种限制扩散的屏障,加速生物膜和牙面之间酸性微环境的创建[9]。白色念珠菌是口腔常见的条件致病真菌之一,也常在龋齿菌斑样本中被检出。白色念珠菌和变异链球菌的相关性研究已有诸多报道。Falsetta等[11]通过建立啮齿动物模型证明,变异链球菌和白色念珠菌之间建立了一种共生关系,协同增强牙齿表面菌斑生物膜的毒性。白色念珠菌细胞壁可提供更丰富的Gtfs结合位点,明显提高变异链球菌的不溶性胞外多糖产量,从而提供大量碳源且增强变异链球菌在釉质表面的黏附定植,加速龋病的进展[18]。上述研究均证明白色念珠菌与变异链球菌之间存在协同共生效应,但也有研究持不同观点。Willems等[19]发现在双菌种生物膜中白色念珠菌可主动调节变异链球菌产酸引起的pH值降低,延缓矿物质的丢失来预防龋病。因此,这种细菌-真菌的共生关系是否促进生物膜毒力增强目前尚无定论,有待进一步的研究进行阐明。
本课题组将重水同位素标记和单细胞拉曼技术相结合,并提出新的定量指标即MIC-MA衡量药物对细胞代谢活性的影响,在不依赖细胞培养、不改变细胞组分的基础上,快速、定量、无损地完成目标微生物实时代谢活性的评价[15]。该技术已经成功应用于评价抗菌剂对细菌、真菌代谢活性的影响,普适性评价亦证实该技术手段敏感度高且省时的独特优势[17]。Tao等[16]报道变异链球菌UA159在≤30%重水中,生长未受到明显抑制,且该菌活跃代谢重水并通过拉曼图谱检测。因此本研究选取不影响实验菌株生长又能产生明显重水峰的重水浓度,即30%作为后续实验的默认浓度。
为评估NaF对变异链球菌的抑菌效能,笔者通过肉汤稀释法和重水拉曼技术确定了NaF对变异链球菌的MIC及MIC-MA。结果显示在MIC浓度的药物刺激作用下细菌生长虽然受到抑制,但代谢抑制程度仅达72.8%,仍存在部分代谢活性,这一现象的出现是由于大部分细胞只是进入了NGMA的状态[20],这种状态往往会增加细菌感染性疾病治疗的难度,是导致感染复发的关键。而在基于重水拉曼技术的MIC-MA浓度下,细菌的生长和代谢在一定时间内均被完全抑制。重水拉曼技术立足于细胞代谢活性角度可对药物作用效能做出精确的判定和评估,在细菌耐药性研究方面有重要意义。
本研究通过建立细菌-真菌互作模型,研究白色念珠菌对变异链球菌代谢活性和耐药性的影响。实验结果显示,白色念珠菌上清液的加入在一定程度上提高了变异链球菌的代谢活性,并且降低其对NaF的药物敏感性。但是当NaF的浓度足够高时(4×MIC、5×MIC),混合体系中的变异链球菌的代谢活性同样可得到完全的抑制,并在一定时间内未见恢复代谢活性。这也从单细胞药物评价层面证实了白色念珠菌和变异链球菌之间的协同关系,细菌-真菌的相互作用可以使微生物对抗菌剂的敏感性发生变化。有研究支持白色念珠菌可分解碳水化合物产生乙酸等短链羧酸,支持酸性环境的形成从而有利于S.mutans的生长。另外白色念珠菌可产生水解酶、磷脂酶、酸性蛋白酶等细胞外酶,释放到培养基中产生催化作用[21],这与本研究结果一致。因此了解这种特殊的相互作用有助于理解口腔感染性疾病的发生、发展、疾病本质,从而开发新的治疗策略,有针对性的预防和治疗口腔感染性疾病[22]。本研究发现即使混合体系测定的MIC-MA同样远低于临床局部涂氟所用NaF浓度,即2%。这是由于目前实验数据是在实验室纯培养条件下获得的,而菌斑生物膜的微生物群落存在更加错综复杂的信息传递和能量转换[23]。后续重水拉曼技术将致力于评价多菌种生物膜对于抗菌剂的反应,为减少耐药菌株的产生,更好地指导临床用药奠定基础。
利益冲突声明:作者声明本文无利益冲突。

