内向整流钾2.1通道蛋白对人牙囊细胞成骨分化的影响及其机制研究
张鹏左东川牟思宇钟宇彤袁小平曾锦
1.西南医科大学附属口腔医院正畸科,泸州646000;
2.西南医科大学口颌面修复重建和再生实验室,泸州646000;
3.西南医科大学电生理学教育部重点实验室,心血管医学研究所,泸州646000
基于干细胞的组织工程为组织的修复与再生提供了全新的思路[1-2],但目前调节干细胞生物学特性的众多分子生物学机制尚不清楚,严重阻碍了组织工程的研究进展[3]。牙囊细胞是一种来源于牙囊组织的间充质干细胞,可分化形成牙周膜、牙骨质和牙槽骨[4]。鉴于牙囊细胞在牙周组织分化发育中的特点、显著的多向分化潜能以及在临床上较易获得,使其成为了一种值得考虑的种子细胞[5]。
钾离子是机体内重要的电解质之一,是维持可兴奋细胞静息膜电位超极化的重要的物质基础,对细胞增殖、迁移、分化、新陈代谢、渗透压等生理功能具有广泛的调控作用。内向整流钾(inward rectifier potassium,Kir)2.1通道蛋白属于Kir家族,由KCNJ2基因编码,是维持可兴奋性细胞节律性、传导性以及兴奋性的主要钾离子通道。生理条件下细胞内钾离子浓度约为140 mmol·L-1,而细胞外钾离子浓度约为4.5 mmol·L-1。可兴奋细胞如心肌细胞等表达Kir2.1通道,钾离子顺着化学浓度差,经Kir2.1通道介导,由细胞内流向细胞外,从而维持细胞静息膜电位超极化。Kir2.1通道调控细胞生理学功能的基础在于其具有典型的内向整流特性,其表现为从钾平衡电位超极化的内向电导增大,而去极化时外向电导减小,产生一个特征性的负斜率电导区,这一特性决定了其对细胞静息膜电位超极化的维持[6]。Kir2.1的内向整流特性对钾离子浓度具有高度依赖性,当细胞外钾离子浓度升高时,电流-电压曲线会沿电压轴向右平移,产生跨交现象,外向电流不减小反而增大,导致细胞膜电位去极化[7]。已有研究表明,Kir2.1通道在非兴奋性细胞也发挥了重要的作用。例如,Zhang等[8]报道,抑制Kir2.1通道的功能会引起晚期内皮祖细胞膜电位去极化,从而促进细胞分化;Komarova等[9]以及Weidema等[10]报道Kir
2.1通道通过维持细胞膜电位的稳定参与破骨细胞生理功能的调控。目前在间充质干细胞上已发现包括钙激活钾通道、电压门控钾通道在内的多种钾通道,均有功能性的表达[11-12],但目前Kir2.1通道在间充质干细胞的生理功能尚不明确。本研究以人牙囊细胞(human dental follicle cell,hDFC)为研究对象,探讨Kir2.1通道对间充质干细胞成骨分化的影响及其机制,以期为应用hDFC修复重建牙周组织提供理论基础。
1 材料和方法
1.1 主要试剂
α-MEM低(高)糖培养基、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)(Gibco公司,美国),胰蛋白酶(上海碧云天生物技术有限公司),Ⅰ型胶原酶(合肥白鲨生物科技有限公司),青霉素-链霉素溶液、4%多聚甲醛固定液、成骨诱导液(Cyagen公司,美国),氯化铯(cesium chloride,CsCl)、4-甲氧基苄基-1-萘基甲基-胺盐(ML133)(Abmole公司,美国),电解质(Sigma公司,美国),碱性磷酸酶显色和活性测定试剂盒、Trizol试剂、二甲基亚砜(dimethyl sulfoxide,DMSO)(上海碧云天生物技术有限公司),琼脂糖(北京亚米生物科技有限公司),总RNA提取试剂盒(北京天根生化科技有限公司),一步法逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增试剂盒、定量逆转录聚合酶链反应(quantitative reverse transcription PCR,RT-qPCR)试剂盒(Toyobo公司,日本)。成骨诱导液的组成成分为10%FBS、10 mmol·L-1β-甘油磷酸钠、10 nmol·L-1地塞米松、50μg·mL-1抗坏血酸、10 nmol·L-1维生素D3。
1.2 实验方法
1.2.1 细胞的分离、培养及鉴定 西南医科大学附属口腔医院伦理委员会批准(伦理审批号:2021-1118005)hDFC培养,所有研究对象知情同意。选取因正畸需要,于西南医科大学附属口腔医院口腔颌面外科门诊部拔除的牙根发育未完全的第三磨牙牙胚中的牙囊组织,于无菌条件下,立刻收集于含有10%青霉素-链霉素双抗的α-MEM培养基中,在超净工作台中,用含有20%双抗的PBS反复冲洗干净,换干净无菌剪剪碎成1 mm3的组织块,收集于离心管中离心,去上清,加入1 mLⅠ型胶原酶于37℃恒温水浴中消化30 min,消化期间每隔10 min适当震荡促使充分消化,消化完成后可见组织块呈絮状,再加入等量的含有10%FBS的α-MEM培养液终止消化,离心,去上清,吸取组织块均匀铺于培养瓶底部,倒置,加入含有15%FBS的α-MEM培养液3 mL,30 min后翻瓶,于37℃、5%CO2的恒温孵育箱中培养,大约培养5~7 d可见细胞从组织块周围爬出,通过连续传代培养,细胞被分离扩展用于后续实验。流式细胞术检测hDFC的免疫表型,主要检测hDFC与间充质干细胞相关表面标记物,包括CD73、CD90、CD105、CD31、CD45、CD3(上海艾博抗贸易有限公司),流式细胞术采用Beckman Coulter Cytomics FC 500 MPL系统(Beckman Coulter公司,美国)。
1.2.2 Kir2.1通道蛋白在hDFC中的表达情况 1)RT-PCR检测Kir2.1的编码基因KCNJ2在hDFC的表达:hDFC传至第三代时,均匀接种于小皿中(密度为每孔2×104个细胞),培养细胞7 d后,使用Trizol法提取总RNA(试验中严格执行无酶操作),提取完成后,取1μL样品使用分光光度计检测RNA的浓度和纯度。采用一步法RT-PCR扩增试剂盒,用提取的RNA为模板,在冰浴中加入RT-PCR反应混合物,反应体系如下:缓冲液5μL,基因正向引物(10μmol·L-1)2μL,基因反向引 物(10μmol·L-1)2μL,逆 转 录 酶0.5μL,RNA酶抑制剂0.5μL,热启动DNA聚合酶0.5μL,模板RNA 2μL,去RNA酶水37.5μL,反应体系总共为50μL,在PCR仪上按下列条件进行逆转录反应,条件设定:45℃30 min、94℃5 min、(94℃30 s、60℃30 s、72℃1 min循环40次)、72℃10 min,反应结束后取5~10μL进行琼脂糖凝胶电泳检测。
2)RT-qPCR检测Kir2.1在hDFC成骨诱导前后KCNJ2的基因表达量:hDFC传至第三代时,均匀接种于小皿中(密度为每孔2×104个细胞),待细胞生长到60%~70%时,分别对对照组(含10%FBS的α-MEM低糖培养基)和成骨诱导分化(osteogenic differentiation,OS)组(加入1.5 mL成骨诱导液的α-MEM低糖培养基)细胞进行培养,每3 d换液1次,每次1.5 mL,第七天时,提取总RNA和测量其浓度及纯度,取10μL变性,变性后的RNA通过一步法RT-PCR扩增试剂盒逆转录成互补脱氧核糖核酸(complementary DNA,cDNA),逆转录完成后加入等体积的ddH2O稀释,通过RT-qPCR试剂盒进行扩增。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,根据公式F=2-ΔΔCT计算目的基因(KCNJ2)的相对表达量,ΔΔCT=(试验组目的基因平均CT值-试验组内参基因平均CT值)-(对照组目的基因平均CT值-对照组内参基因平均CT值),其中目的基因KCNJ2的引物序列为:F5’-TGCCCGATTGCTGTTTTC-3’和R5’-GGCTGTCTTCGTCTATTT-3’。
1.2.3 膜片钳技术检测hDFC在成骨诱导分化前、后的细胞膜电位变化 hDFC传至第三代时,在培养基中加入成骨诱导液对hDFC进行成骨诱导分化,于诱导前、诱导7 d后,采用HEKA膜片钳系统,在电流钳模式下连续记录细胞的膜电位。采用电阻为2~3 mΩ的玻璃电极,形成封接,破膜后进行记录。记录hDFC膜电位的电极内液各电解质浓度为140 mmol·L-1氯化钾、1 mmol·L-1氯化镁、10 mmol·L-1乙二醇双(2-氨基乙基醚)四乙酸、1 mmol·L-1三磷酸腺苷二钾盐、5 mmol·L-1羟乙基哌嗪乙磺酸(pH=7.4),电极外液各电解质浓度为135 mmol·L-1氯化钠、5.4 mmol·L-1氯化钾、2 mmol·L-1氯化钙、1 mmol·L-1氯化镁、15 mmol·L-1葡萄糖、10 mmol·L-1羟乙基哌嗪乙磺酸(pH=7.4)。所记录电生理数据采用IgorPro软件分析。
1.2.4 膜电位去极化或抑制Kir2.1通道功能对hDFC成骨分化的影响 实验分为:OS组(成骨诱导液),K+组(成骨诱导液+50 mmol·L-1钾),CsCl组(成骨诱导液+10 mmol·L-1CsCl),ML133组(成骨诱导液+20μmol·L-1ML133)。
1)茜素红染色及矿化结节定量分析:hDFC传至第三代时,均匀种板于6孔板中(密度为每孔2×104个细胞)培养,待细胞生长到60%~70%时,去除基础培养基,PBS轻柔清洗2~3次,各组细胞于37℃、5%CO2的孵育箱中避光培养,每3 d换液1次,每次1.5 mL,培养14 d后,吸取诱导液,PBS反复冲洗2~3次,吸干,4%多聚甲醛固定细胞15 min,再次用PBS反复轻柔冲洗2~3次,吸干,进行茜素红染色3 min,PBS冲洗多余染液,于摇床上轻微摇荡10 min,更换为新PBS,于肉眼下观察染色情况,并于显微镜下采图,观察钙结节形成情况,再行茜素红染色半定量分析,向各组孔板中加入10%氯化十六烷基吡啶2 mL,充分混匀后,吸取100μL置于96孔板中,于562 nm处下检测吸光度值。
2)碱性磷酸酶染色及活性测定:hDFC以每孔2×104个细胞的密度接种于6孔板中,待细胞生长到60%~70%时,分别对各组细胞进行成骨分化诱导,每3 d换液1次,每次1.5 mL,第七天时按照试剂盒说明书进行碱性磷酸酶染色及活性测定,用酶标仪在405 nm处测定吸光度,计算碱性磷酸酶活性比。碱性磷酸酶活性的定量数据根据成骨分化第七天的对照结果进行校准。
3)成骨分化相关基因[RUNX相关转录因子(Runt related transcription factor,RUNX)2、骨钙素(osteocalcin,OC)]的表达:hDFC传至第三代时,均匀接种于小皿中(密度为每孔2×104个细胞),待细胞生长到60%~70%时,分别对各组细胞进行成骨分化诱导,每3 d换液1次,14 d时同样以上述1.2.2中的方法检测和计算目的基因RUNX2、OCN的相对表达量,基因引物序列如下:RUNX2:F5’-GCAGCAGCAGCAGCAGGAG-3’和R5’-GCACCGAGCACAGGAAGTTGG-3’,OCN:F5’-GCCAGGCAGGTGCGAAGC-3’和R5’-GTCAGCCAACTCGTCACAGTCC-3’。
1.2.5 钙离子成像检测膜电位变化对细胞内钙离子浓度的影响 hDFC传至第三代时,细胞均匀接种于小皿中的玻片上(密度为每孔2×104个细胞),于孵育箱中培养1 d,待hDFC贴壁于玻片上,用钙离子荧光染料(Fura-2/AM)负载细胞30 min,然后用PBS冲洗掉剩余染料,将染色好的细胞玻片置于倒置显微镜载物台检测皿中,组装好循环系统,通过循环系统连续灌流标准(含5.4 mmol·L-1钾)的细胞外液,然后用40倍油镜观察并选取hDFC,待hDFC细胞内钙信号基线稳定后,记录胞内钙离子荧光强度,再灌流含有低钾(2 mmol·L-1)的细胞外液,观察和记录钙信号的改变情况,其中钙信号采用TILL vision软件观察和记录2种波长340 nm和380 nm激发下荧光强度的比值(F340/380),转换频率为0.2 Hz,发射光波长为510 nm,曝光时间为5 ms。
1.3 统计学分析
数据以均数±标准差表示,利用SPSS 17.0软件进行统计学分析,多组数据统计学分析采用单因素方差分析,P<0.05时记为差异有统计学意义。
2 结果
2.1 hDFC的分离、培养及鉴定
hDFC经原代培养5 d后,观察可见已具有典型的间充质干细胞形态,hDFC呈长梭形,以放射状或旋涡状从组织块向周围生长(图1A)。利用酶消化法进行分离纯化后观察可见,传至第三代的hDFC形态均一,多呈长梭形,呈鱼群状或放射状排列(图1B)。hDFC具有较强的成骨分化能力,成骨诱导14 d后经茜素红染色,镜下观察可见大量红色矿物结节(图1C)。流式细胞结果显示:hDFC表面抗原CD73(97.93%)、CD90(99.96%)和CD105(82.98%)表达量高,而CD31(1.58%)、CD45(3.55%)和CD3(4.36%)表达量极低(图2),证实培养获得的hDFC为间充质来源的干细胞。

图1 hDFC培养及鉴定 ×40Fig 1 Cultivation and identification of hDFCs ×40
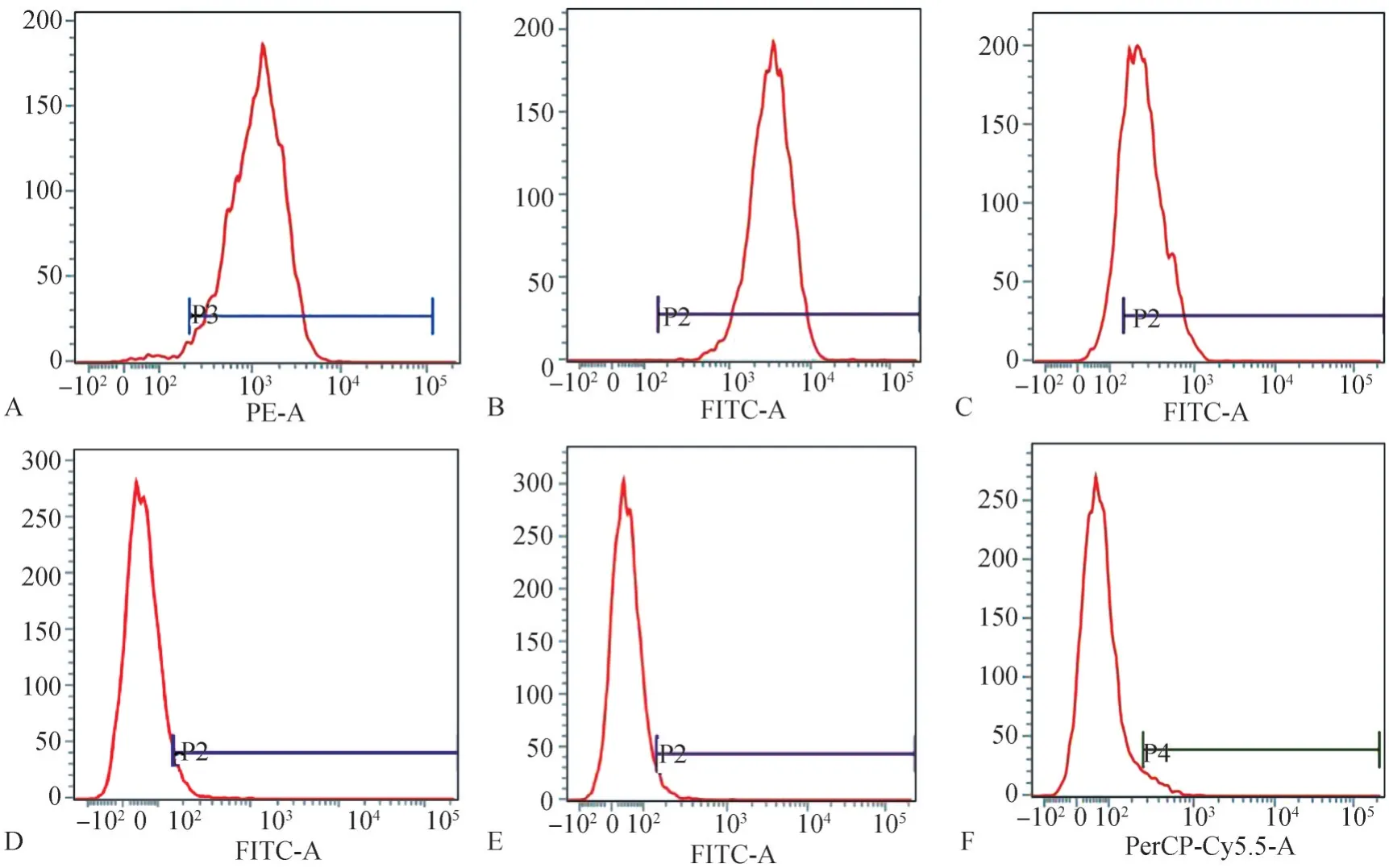
图2 细胞表面抗原表达的流式细胞术检测结果Fig 2 Results of cell surface antigen expression by flow cytometry
2.2 Kir2.1通道蛋白在hDFC中的表达情况
RT-PCR结果显示:hDFC表达Kir2.1基因KCNJ2(图3A);RT-qPCR结果显示:与对照组细胞相比较,OS组细胞的Kir2.1基因KCNJ2的表达上调(图3B)。

图3 Kir2.1基因KCNJ2的表达情况Fig 3 KCNJ2 expression of Kir2.1 channel
2.3 成骨诱导前后hDFC的膜电位变化
全细胞膜片钳结果显示,成骨诱导前hDFC的膜电位约为(-12±3.2)mV,成骨诱导后的膜电位约为(-47±5.2)mV(图4),这一结果说明,hDFC成骨分化的过程中伴随着细胞膜电位超极化的发生。
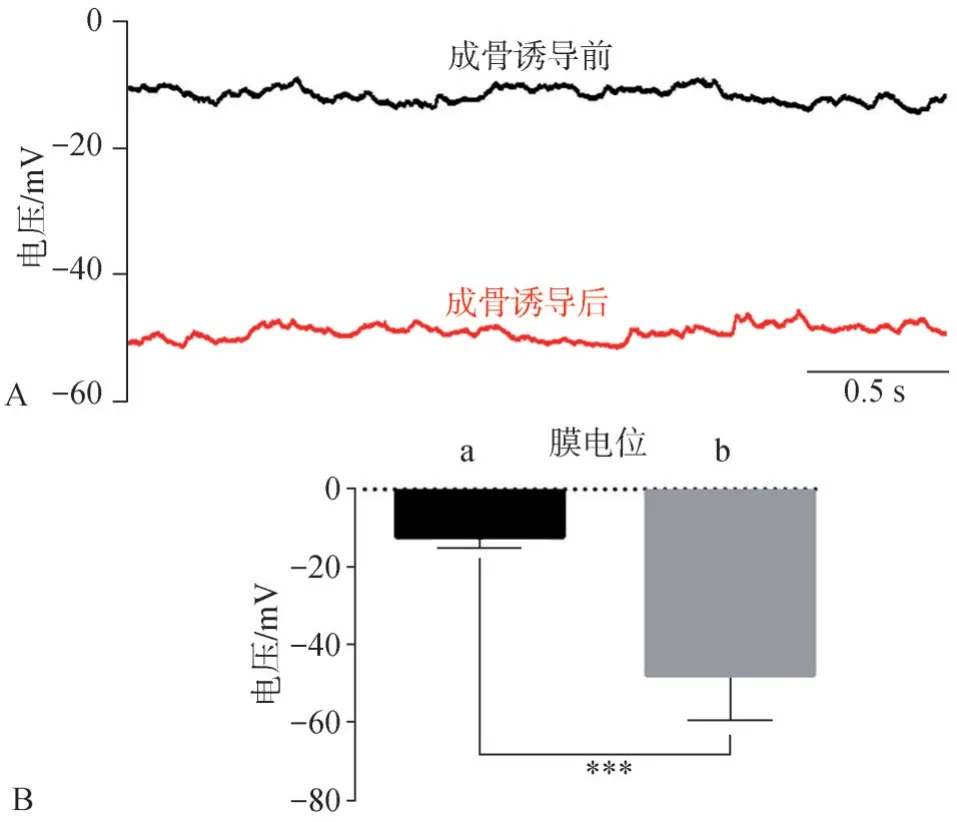
图4 hDFC成骨诱导前后的膜电位变化Fig 4 Membrane potential changes of the hDFCs before and after osteogenic induction
2.4 膜电位去极化或抑制Kir2.1通道功能对hDFC成骨分化的影响
茜素红染色及矿化结节定量分析结果显示:经成骨诱导14 d后,OS组细胞镜下观察可见大量红色矿物结节,而K+组、CsCl组和ML133组细胞的红色矿物结节数量明显减少。肉眼观察结果见图5A~D;镜下观察结果见图5E~H,茜素红染色半定量分析见图6。
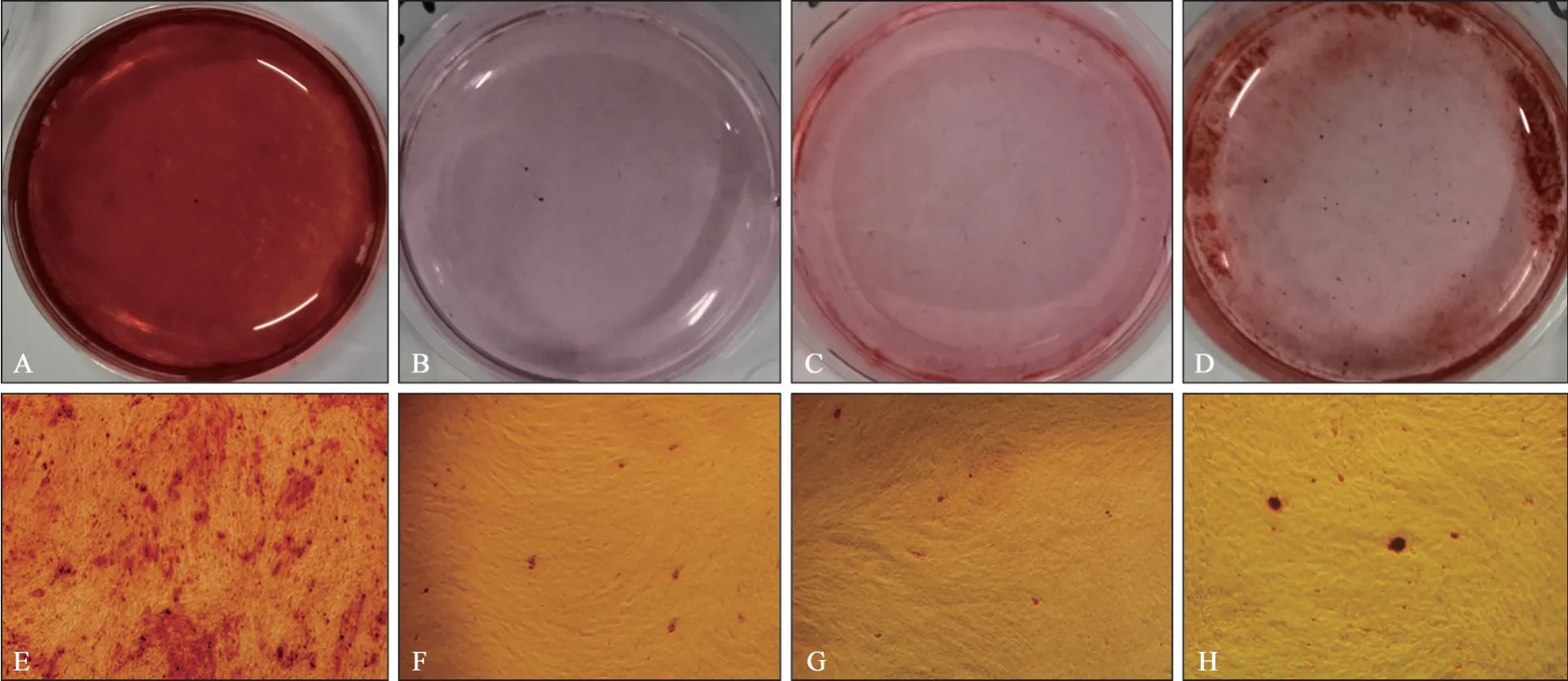
图5 茜素红染色结果 ×40Fig 5 Resultsof alizarin red staining ×40

图6 茜素红染色半定量分析结果Fig 6 Semi-quantitative analysis result of alizarin red staining
碱性磷酸酶染色结果显示:经成骨诱导7 d后,与OS组细胞相比较,K+组CsCl组和ML133组细胞的碱性磷酸酶活性明显降低,肉眼观察结果见图7A~D,镜下观察结果见图7E~H,碱性磷酸酶活性测定分析结果见图8。

图7 碱性磷酸酶染色结果 ×40Fig 7 Resultsof alkalinephosphatasestaining ×40
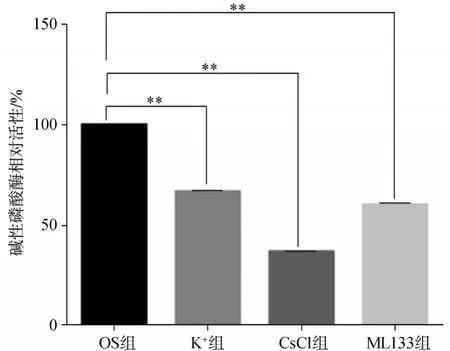
图8 碱性磷酸酶活性测定结果Fig 8 Activity measurement results of alkalinephosphatase
2.5 成骨分化相关基因的表达情况
RT-qPCR结果显示:经成骨诱导14 d后,与OS组细胞相比较,K+组、CsCl组、ML133组细胞的RUNX2、OCN基因表达明显降低(图9)。
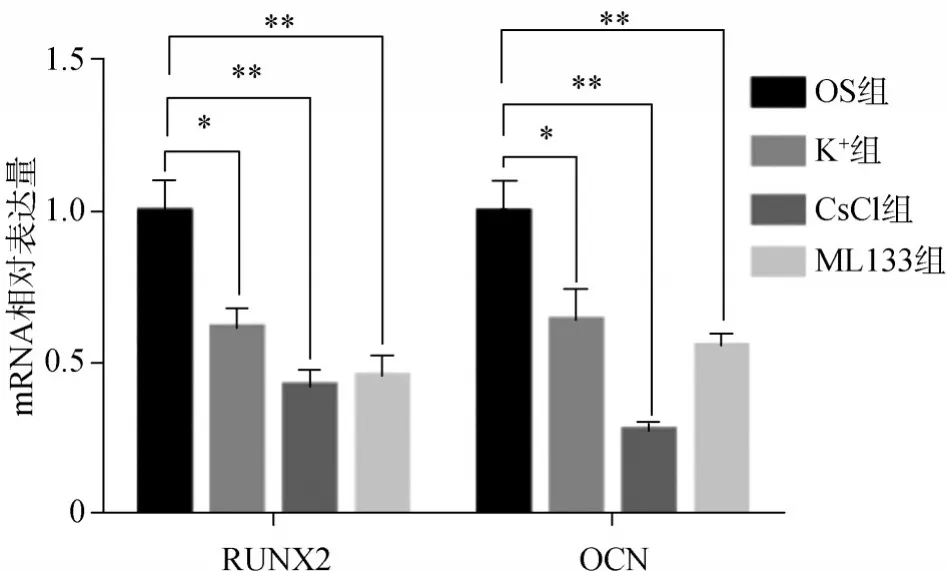
图9 RT-qPCR检测成骨分化相关基因RUNX2、OCN的表达情况Fig 9 Detection of osteogenic differentiation-related genes RUNX2 and OCN expression by RT-qPCR
2.6 膜电位超极化对hDFC胞内钙离子浓度的影响
钙离子成像结果显示,当细胞外钾离子的浓度从5.4 mmol·L-1降为2 mmol·L-1时,hDFC胞内钙离子荧光强度显著增强(图10),F340/380的比值见图11,上述结果表明,膜电位超极化会引起hDFC胞内钙离子浓度的升高。

图10 钙离子荧光染色结果 ×40Fig 10 Results of calcium ion fluorescent staining ×40

图11 F340/380比值的分析结果Fig 11 The analysis result of F340/380 ratio
3 讨论
自2005年Morsczeck等[13]从人的牙囊组织中首次分离出hDFC以来,该细胞因其较好的干细胞特性以及再生牙周组织的潜力而受到广泛关注。
本研究中的hDFC提取于因正畸需要而拔除的健康第三磨牙牙胚,经原代培养后具有典型的间充质干细胞形态,通过流式细胞术鉴定细胞表面标志物,证明其为纯化的间充质干细胞。hDFC是来源于牙囊组织的间充质干细胞,具有较强的成骨分化潜能,本研究培养获得的hDFC在成骨诱导后,经茜素红染色可见大量的成骨矿化结节,这与以往相关的报道[14]一致。
有研究表明,间充质干细胞的成骨分化过程受细胞膜电位的调控。例如,Kirkham等[15]报道,通过电刺激的方法使人骨髓间充质干细胞膜电位超极化能够促进细胞成骨分化;Sundelacruz等[16]和Bhavsar等[17]报道,人骨髓间充质干细胞在成骨分化的过程中伴随着膜电位的超极化,并且他们发现,通过提高细胞外钾离子的浓度使细胞膜电位去极化,能够抑制细胞的成骨分化过程。本研究中,首先检测了hDFC成骨分化过程中膜电位的变化;膜片钳结果显示,细胞成骨诱导前的膜电位约为(-12±3.2)mV,经成骨诱导7 d后,膜电位约为(-47±5.2)mV,这一结果说明,hDFC成骨分化的过程中伴随着膜电位的超极化;其次,观察了膜电位去极化对hDFC成骨分化的影响,提高细胞外钾离子的浓度是使细胞膜电位去极化常用的方法[16]。
本研究结果显示,OS组细胞经成骨诱导后可见大量矿化结节,而提高细胞外钾离子的浓度后,细胞的成骨矿化能力显著降低。上述结果说明,细胞膜电位超极化的发生在hDFC成骨分化的过程中起到了重要的作用。
Kir2.1通道蛋白在兴奋性细胞发挥了至关重要的作用,但近年来越来越多的证据显示,Kir2.1通道蛋白在非兴奋性细胞如内皮细胞、神经胶质细胞、多能干细胞等也发挥了重要的作用。如Kito等[18]报道,Kir2.1通道蛋白的表达上调在内质网应激引起的脑毛细血管内皮细胞死亡过程中起到了重要的作用;Gattlen等[19]报道,抑制Kir2.1通道蛋白在小胶质细胞中的表达,能够抑制细胞的增殖能力从而减轻神经痛。
Pini等[20]发现,Kir2.1通道功能的丧失影响多能干细胞成骨和软骨形成过程。在本研究中,通过RT-PCR的方法首先证明了hDFC表达Kir2.1,并且成骨诱导后Kir2.1的基因表达量明显上调;其次,应用Kir2.1通道选择性阻断剂(CsCl)和特异性阻断剂(ML133)都证明了抑制Kir2.1通道的功能能够抑制hDFC的成骨矿化能力。因此,根据以往文献报道以及本研究的实验结果,证明了Kir2.1通道蛋白介导的膜电位超极化在hDFC成骨分化的过程中起到了关键的作用。Kirkham等[15]和Pchelintseva等[21]在人间充质干细胞的研究表明,膜电位超极化可以引起细胞内钙离子浓度的升高继而调控成骨分化,本研究中确实发现膜电位超极化能够引起hDFC细胞内钙离子浓度的升高,这一结果与以往在间充质干细胞的研究相一致。
牙槽骨缺损的修复、再生一直是牙周组织工程研究的热点,牙囊细胞作为牙周组织工程的种子细胞,具有间充质干细胞的特征,表现出强大的多向分化能力及再生能力[22],是骨缺损修复值得考虑的种子细胞。有学者[23]报道Kir2.1通道蛋白的功能与成骨密切相关,基因突变导致的Kir2.1功能丧失,临床上会出现安德森综合征,临床表现之一为骨骼发育异常[20]。本研究的研究结果也表明抑制Kir2.1通道蛋白的功能可以抑制hDFC成骨分化。在将来的动物实验中,可针对Kir2.1通道蛋白这一靶点进行调控,从而为促进骨缺损的修复、再生提供理论基础。
利益冲突声明:作者声明本文无利益冲突。

