A 型主动脉壁间血肿的单中心治疗经验
唐滔,董阿兰,唐浩,宋国宝,张剑锋,周新民
主动脉壁间血肿(intramural hematoma,IMH)是急性主动脉综合征的一个特殊类型,约占急性主动脉综合征的5%~18%[1]。根据Standford 标准,IMH可分为 A 型IMH 和B 型IMH[2-3]。目前,对于B 型IMH,治疗意见已基本统一;但对于A 型IMH,治疗方案尚存在一定争论。本研究回顾性总结我院对于A 型IMH 患者的治疗经验。
1 资料与方法
研究对象:回顾性纳入2015 年1 月至2020 年12 月我院收治的急性A 型IMH 患者共135 例(约占同期收治的A 型急性主动脉综合征患者的9%),根据病情分为稳定型(n=43)和不稳定型(n=92)A 型IMH 患者。所有急性A 型IMH 患者均经全主动脉CT 血管造影(CTA)检查证实:(1)新月形或环行主动脉壁增厚>5 mm;(2)平扫呈略高于主动脉管壁组织密度的软组织阴影,增强时表现为相对于管腔的低密度影;(3)无内膜片及真、假腔形成。
诊治流程(图1):所有A 型IMH 患者入院后均绝对卧床休息,予吗啡镇痛,予静脉泵入药物控制血压、心率,维持目标收缩压<120 mmHg(1 mmHg=0.133 kPa),目标心率60~80 次/min。对于入院后病情稳定、无胸痛或其他相关不适、血压和心率控制良好以及CTA 显示壁间血肿厚度<11 mm、升主动脉直径<50 mm、升主动脉无破口或溃疡、无心包积液的患者,将其归为稳定型A 型IMH。对于该类患者,采取药物治疗、同时“等待并观察”的策略。如治疗期间无异常,分别于发病后7 d 和14 d复查CTA,若血肿厚度变薄,认为药物治疗有效。当病情进入亚急性期后,患者出院回当地继续药物治疗。如治疗期间患者胸痛难以控制,再发胸痛或出现其他相关不适,或血压、心率控制不佳,或CTA 显示壁间血肿厚度增加,出现心包或胸腔积液,则转为手术治疗或介入治疗。而对于入院后胸痛难以控制或出现其他相关不适,或血压、心率控制不佳,或CTA 显示壁间血肿厚度>11 mm、升主动脉直径>50 mm,或出现心包积液的患者,将其归为不稳定型A型IMH。对于该类患者,采取急诊手术治疗。

图1 急性A 型IMH 患者的诊治流程
随访:出院后1~3 个月、6 个月、12 个月以及此后每年复查一次全主动脉CTA。采用门诊、电话、微信等方法进行随访。随访6 个月至6 年,平均随访(4.6±0.8)年。
统计学方法:使用SPSS 22.0 软件进行统计学分析,计量资料采用均数±标准差表示,组间比较使用非配对t检验;计数资料使用例数和百分比表示。P<0.05 为差异有统计学意义。
2 结果
患者的一般情况:在135 例急性A 型IMH 患者中,男性90 例,女性45 例;年龄32~77 岁,平均为(56.1±9.3)岁;稳定型A 型IMH 患者43 例(31.9%),不稳定型A 型IMH 患者92 例(68.1%)。
患者的治疗和死亡情况:43 例稳定型A 型IMH患者中,31 例经严格药物治疗后好转出院,药物治疗有效率为72.1%;6 例(14.0%)在观察期转为手术治疗,另有6 例(14.0%)转为介入治疗,无住院死亡。40 例患者成功接受随访(失访3 例,随访率93.0%),均存活。92 例不稳定型A 型IMH 患者中,69 例(75.0%)接受急诊外科手术,无住院死亡,术后随访67 例(失访2 例,随访率97.1%),死亡4例,死亡率为5.8%(4/69);另外23 例(25.0%)患者虽医生建议外科手术治疗,但因手术禁忌、经济困难或患者家属不愿承担手术风险而选择药物治疗,其中住院死亡2 例,出院后随访21 例(随访率100%),其中死亡3 例,余均存活,死亡率21.7%(5/23)。不稳定型A 型IMH 患者的总死亡率为9.8%(9/92)。
患者的外科手术治疗情况及预后(表1):共75例患者接受外科手术治疗,其中6 例稳定型A 型IMH 患者由药物治疗转为外科手术,另外69 例为不稳定型A 型IMH 患者。在这75 例患者中,44 例(58.7%)术中可见破口,破口多数位于主动脉弓部(63.6%,28/44)。A 型IMH 的手术方式基本与主动脉夹层手术相同,涵盖常见术式,但以“升主动脉置换+全弓置换+降主动脉支架象鼻术(37 例)”和“主动脉窦成形+升主动脉置换+全弓置换+降主动脉支架象鼻术(14 例)”为主(68.0%,51/75)。术后主要并发症为苏醒延迟(10 例,13.3%)和肺部感染(7 例,9.3%)。在接受外科手术治疗的75 例患者中,总死亡率为5.3%(4/75)。
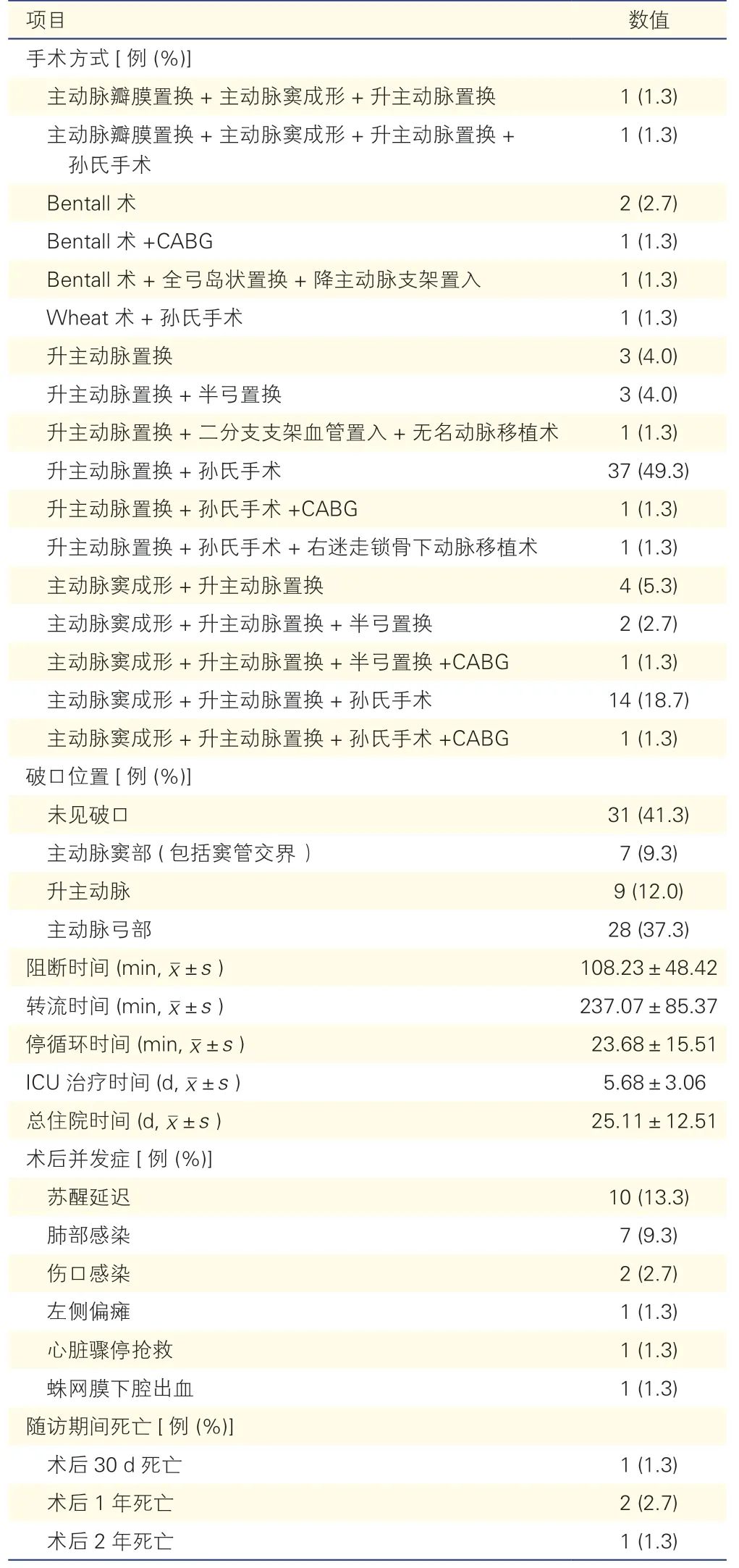
表1 75 例A 型IMH 患者的外科手术情况及预后
3 讨论
多数西方国家将IMH 归为急性主动脉综合征的一个亚型,诊断上将其与主动脉夹层并列而有所区别,治疗上建议所有A 型IMH 患者进行急诊手术治疗[4-5]。而一些亚洲国家则将IMH 视为急性主动脉夹层的一个病理过程,提出部分A 型IMH 患者可以首选药物治疗[2,6-7]。笔者认为,IMH 和主动脉夹层主要是影像学上存在差别。但从临床表现而言,IMH 和主动脉夹层基本一致。在病理上,虽然传统的IMH 定义为“主动脉壁内出血或局限血肿形成但无内膜破口”[8],但近年来的研究发现,大多数IMH 存在内膜片破口或微小破口,因此将其定义更改为“具有闭合血栓化假腔的主动脉夹层”[9]。术中检查也证实,除了病变范围和内膜质量有差别外,IMH 本质上也是主动脉夹层。在转归上,IMH 可部分或完全吸收好转,也可进展成为典型的夹层甚至破裂。因此,笔者认为,将IMH 视为主动脉夹层的一个病理阶段更为合理。
自2015 年起,在欧洲和日本相关指南的基础上[5,10],结合本团队以往的经验,我们将A 型IMH患者分为稳定型和不稳定型A 型IMH 患者。对于稳定型A 型IMH 患者,主要采用药物治疗、同时“等待并观察”的策略。这一策略有两个关键要点:一是在联合使用多种药物的基础上,辅以严格的临床护理和有效的心理治疗,确保患者病情稳定,尤其要保持其血压、心率控制良好;二是注意密切观察患者的病情变化,如出现胸痛难以控制,再发胸痛或出现其他相关不适,或血压、心率控制不佳等,及时复查全主动脉CTA,以帮助判定是否需介入或外科干预。只有患者临床和CTA 表现均改善,才证明药物治疗有效。本研究发现,对于稳定型A 型IMH患者,药物治疗效果良好,72.1%的患者经单纯药物治疗后好转出院且随访满意。即使在药物治疗观察期间发现病变进展,也能及时有效干预。43 例稳定型A 型IMH 患者中,6 例(14.0%)在观察期发现升主动脉壁间血肿进展,转为手术治疗;另有6 例(14.0%)为B 型夹层逆向撕裂引起A 型壁间血肿,复查发现升主动脉壁间血肿有所吸收,但弓降部溃疡或破口加重,遂转为介入治疗。所有转为手术治疗和介入治疗的患者均顺利恢复,无住院死亡。上述经验表明,这一治疗策略合理、有效,同时也说明,现有稳定型A 型IMH 的判定标准是可靠的。然而,令我们惊奇的是,拒绝手术而被动接受药物治疗的多数不稳定型A 型IMH 患者也存活,说明药物治疗对这些患者也有效,但其死亡率高于本院2020 年所有A 型主动脉夹层手术的死亡率(21.7%vs.11.0%),提醒手术对于这类患者的必要性和优先性。
大约45%的A 型IMH 可进展为主动脉夹层甚至破裂,急诊手术治疗依然是不稳定型A 型IMH患者的首选治疗策略[11]。本中心的经验表明,因为IMH 的范围可局限或弥散,A 型IMH 的手术方式基本涵盖了主动脉夹层的所有术式。但多数IMH 很少累及主动脉瓣叶和冠状动脉,导致手术以“主动脉窦成形/升主动脉置换+全弓置换+降主动脉支架象鼻术”为主,手术复杂性较主动脉夹层手术有所降低。同时IMH 内膜撕裂的程度较低,内膜组织的坚韧度也更好,这有利于手术吻合,减少出血。所以,相对于急性A 型主动脉夹层而言,A 型IMH 手术风险有所降低。本研究结果也证实,接受外科手术的患者术后无住院死亡,术后随访总死亡率为5.3%。与主动脉夹层手术相比,A 型IMH 手术死亡率更低,术后并发症也更少。除了人种差异,或许正是由于较好的手术结果,使得西方国家倾向于对所有A 型IMH 患者采取急诊手术的治疗方案[12]。
总之,本中心的经验表明,对于A 型IMH 患者的治疗,可根据其可能的转归来相应处理。对于稳定型A 型IMH 患者,可首选药物治疗,同时“等待并观察”;而对于不稳定型A 型IMH 患者,宜首选急诊手术治疗。
利益冲突:所有作者均声明不存在利益冲突

