胃肠胰神经内分泌肿瘤的CT表现与病理分级的相关性分析
梁春雨 马伶玉 杨国辉 沈新平,*
1.香港大学深圳医院放射科 (广东 深圳 518009)
2.香港大学深圳医院临床肿瘤中心 (广东 深圳 518009)
神经内分泌肿瘤(neuroendocrineneoplasm,NEN)是一组起源于胚胎的神经内分泌细胞的罕见肿瘤,可发生于身体任何部位[1-2],胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine tumors,GEP-NET)是神经内分泌肿瘤中相对常见的类型[3],根据肿瘤分泌的激素是否导致症状可将GEP-NEN分为有功能性和无功能性两类,功能性GEP-NET临床表现主要与肿瘤分泌的激素有关,如类癌多伴有5-羟色胺分泌过多的表现,包括皮肤潮红、腹痛、腹泻等,胰岛素瘤表现为反复低血糖,临床上大部分为无功能性GEP-NET,仅表现为局部的肿块或(和)转移病灶。
2010 年世界卫生组织内分泌肿瘤国际组织学会根据核分裂象及Ki-67增殖指数[4-5],将GEP-NET病理学上分为高分化神经内分泌瘤(neuroendocrine tumors,NET)和低分化的神经内分泌癌(neuroendocrine carcinomas,NEC),高分化神经内分泌瘤(NET)又根据细胞增殖活性分为G1和G2两个级别,低分化的神经内分泌癌(NEC)为G3级别,所以,GEPNET病理学上分为G1、G2、G3共3个级别,肿瘤病理级别越高,细胞增殖活性越大,越表现为恶性倾向。同时,GEPNET影像学表现也变化多样,可表现为形态规则、生长缓慢的局限性肿块,也可以表现为侵袭性肿块伴远处转移。目前为止,国内外仅有为数不多的文献探讨GEP-NET的影像学表现与病理分级的相关性[6-7]。因此,本文回顾性分析 22例经活检穿刺及术后病理证实的GEP-NET的CT征象及病理资料,分析高分化神经内分泌瘤(NET)与低分化的神经内分泌癌(NEC)的CT形态学表现及血供特点有无差异,探讨不同级别GEPNET的影像学表现差异。因GEP-NET的病理分级影响患者的手术方式及手术处理,也影响患者的预后判断,因此,如术前能够通过临床及影像学征象判断GEP-NET的病理分级,则可以指导临床作出合理的病情判断及处理方案。
1 资料与方法
1.1 临床资料回顾性分析22例(24个病灶)经手术或穿刺活检后病理证实的GEP-NET患者,男10例,女12例,年龄31~81岁,平均年龄(49.33±13.47)岁。22例GEP-NET患者中,包括2例食管、3例胃壁、1例空肠、5例直结肠、11例胰腺。其中有2例患者分别检查2枚病灶,其中1例为空肠肠系膜及肠壁各见1枚病灶,另一例为直肠发现2枚病灶。22例中有3例(13.6%)为功能性GEP-NET,2例发生在胰腺,1例发生在胃壁,患者主要表现为低血糖。其余为非功能性GEP-NET。发生于肠道者症状包括腹痛、便血、排便次数增多,发生于胰腺者症状主要为黄疸及腹部不适,发生于食管及胃壁者症状包括吞咽困难、呕血,另有部分病例无明显症状,为体检发现。
1.2 检查方法所有患者术前均行腹部螺旋CT增强扫描,采用Siemens SOMATOM Definition多层螺旋CT扫描仪,扫描过程如下:先平扫,后行动脉期、实质期、延迟期三期增强扫描。扫描条件:管电压120kV,管电流100~120mAs,层厚5mm,间隔5mm,重建层厚1mm。以高压注射器于右肘部静脉团注非离子型对比剂碘帕醇(100mL:37gL)后行多期增强扫描,注射流率3mL/s,三期扫描时间分别为开始注射对比剂后25~30s、60~65s和175~180s。扫描范围上至膈顶下至坐骨结节。扫描前肠道准备及口服阴性对比剂均按常规进行。
图像均已传送至PACS,所有患者的CT特征分析均由1位副主任医师和1位资深主治医师独自完成,采用单盲(阅片人未知患者资料及病理结果)评估,当两人意见不一致时,讨论后得出结果。
主要在静脉期图像上观察病变特点。病灶的影像学数据分析包括肿瘤部位、最大径、形态(圆形或卵圆形/不规则形)、生长方式(局限性结节肿块/浸润性生长)、边界(清晰/模糊)、坏死囊变溃疡(有/无)、周围侵犯(有/无)、淋巴结转移(有/无)、远处转移(有/无)、强化方式(均匀/不均匀)、强化程度(强化程度由强化峰值对比平扫CT值差异决定,强化峰值CT值增加≤40HU为轻中度强化;>40HU为明显强化)。
1.3 病理诊断标准根据2010年世界卫生组织内分泌肿瘤国际组织学会对神经内分泌肿瘤的新分类标准,根据增殖指数(Ki-67)和核分裂象数将GEP-NET分为3级:(1)G1级:分裂象<2个/10hpf(10个高倍镜视野),Ki-67增殖指数≤2%。(2)G2级:分裂象为2~20个/10hpf,Ki-67增殖指数为3%~20%。(3)G3级:核异型性明显,分裂象>20个/10hpf,Ki-67增殖指数>20%。病理级别越高,肿瘤越表现为恶性倾向。
1.4 统计学方法采用SPSS 25.0软件(SPSS,version 25.0,IBM Software)进行统计分析。计量资料以(±s)表示,采用Kolmogorov-Smirnova法评估分布特征,对符合正态分布、方差齐性的计量资料采用Student's t检验,计数资料以频数(构成比)(n(%))表示,应用χ2检验比较不同病理影像特征的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料22例患者中有2例患者各检出2个病灶,其中1例为空肠肠系膜及肠壁各见1枚病灶,另一例为直肠发现2枚病灶。其余20例为单发病灶,共检出24个病灶。24个病灶中,病理证实为高分化神经内分泌瘤(G1+G2)共17个病灶,其中6个病灶为男性,11个病灶为女性,平均年龄(45.88±11.27)岁;病理证实为低分化神经内分泌癌(G3)共7个病灶,其中5个病灶为男性,2个病灶为女性,平均年龄(57.71±15.51)岁。患者一般情况见表1。患者发病年龄均大于30岁,NEC组患者平均年龄显著高于NET组(独立样本t检验,t=-2.096,P=0.048),两组患者性别构成无显著性差异(χ2=2.608,P= 0.106)。

表1 患者的一般资料
2.2 CT征象与病理分级相关性研究结果24个GEP-NET病灶大小、形态均差异较大,瘤体横径最大径介于6~109mm,平均最大径(43.29±32.64)mm,高分化神经内分泌肿瘤最大径>40mm者4例,低分化神经内分泌癌最大径>40mm为6例。大部分(80%以上)的高分化神经内分泌肿瘤表现为形态较规则的圆形或卵圆形肿块,局限性生长、边界清楚,而低分化神经内分泌癌(100%)均表现为分叶状或不规则肿块,浸润性生长、边界欠清晰。高分化神经内分泌肿瘤及低分化神经内分泌癌出现坏死囊变的几率均较高,分别为64.70%、85.71%。动态增强扫描观察,共有18例肿瘤为显著强化,其中15例为高分化神经内分泌肿瘤,强化较著者动脉期强化程度与主动脉类似,CT值升至202HU。有2枚病灶为轻度强化,CT值峰值增加小于20HU。共有17例肿瘤呈不均匀强化,其中12例为高分化神经内分泌肿瘤。高分化神经内分泌肿瘤有1例出现邻近组织器官侵犯,3例出现局部或远处淋巴结转移,4例出现远处器官转移。低分化神经内分泌癌有4例出现周围组织器官侵犯、7例出现局部或远处淋巴转移,6例出现远处器官转移。远处器官转移最常见为肝转移,另外还包括肺转移、腹壁、肠系膜、双侧附件转移。部分不同级别神经内分泌肿瘤病例见图1~图4。
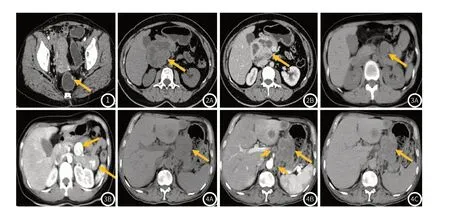
图1 女,53岁,直肠高分化无功能神经内分泌肿瘤(G1级),动脉期示直肠左前壁一局限性结节(箭头),边缘清晰,明显强化。图2 女,48岁,胰头高分化功能性神经内分泌肿瘤(G1级),平扫(图2A)示胰头一较大分叶状肿块(箭头),呈囊实性,边界尚清晰,静脉期(图2B)示病灶实性部分明显强化,伴多发灶性无强化囊变区。图3 女,34岁,空肠高分化无功能神经内分泌肿瘤(G2级),平扫(图3A)示空肠系膜一类圆形局限性肿块(箭头),呈实性软组织密度,静脉期(图3B)示病灶呈明显均匀强化,同层面肠壁另见一明显强化肿块(箭头),2处病灶强化程度均与主动脉相仿。图4 男,67岁,胃小弯低分化无功能神经内分泌癌(G3级),平扫(图4A)示胃小弯一不规则局限性肿块(长箭头),呈实性软组织密度,动脉期(图4B)、静脉期(图4C)示病灶呈不均匀轻度强化强化,同层面肝左叶见2枚乏血供结节,为转移瘤,同层面小网膜囊及腹膜后见多枚肿大淋巴结(短箭头)。
χ2检验比较高分化神经内分泌肿瘤和低分化神经内分泌癌CT特征的差异,结果显示,肿瘤大小、形态、生长方式、肿瘤边界、淋巴结转移、远处转移方面在两组分布有显著差异(P<0.05)。肿瘤的坏死囊变、周围侵犯、强化方式、强化程度方面在两组分布无显著差异(P>0.05),见表2。
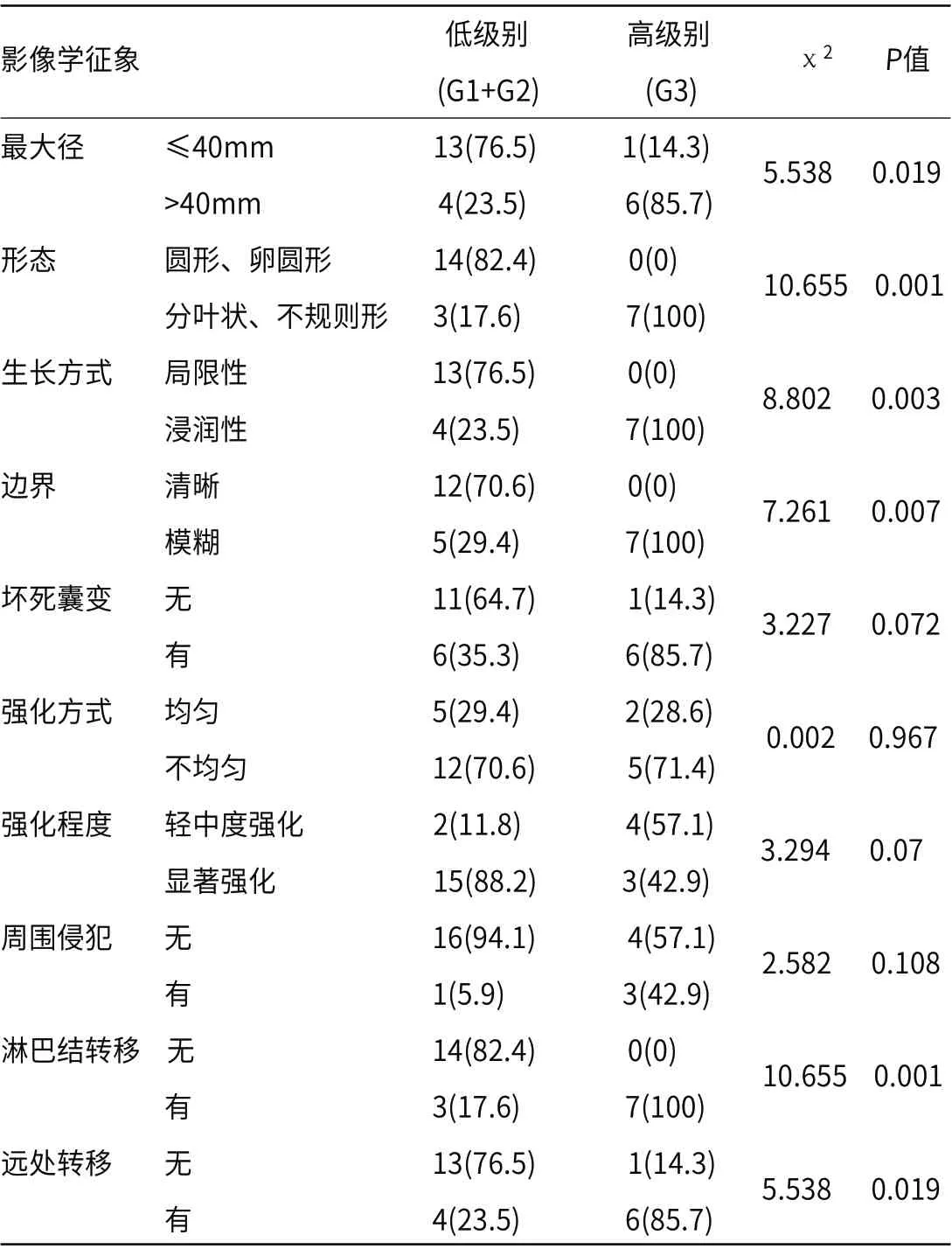
表2 GEP-NET的影像学征象与病理分级的相关性[n(%)]
3 讨 论
胃肠胰神经内分泌肿瘤(GEP-NEN)起源于消化系统神经内分泌细胞,曾称为“类癌”,可发生于消化系统任何部位,据报道[8],GEP-NEN以胰腺最为好发,其余好发部位还包括大小肠、阑尾、胃、食管和胆囊,本研究病例发病部位最多为胰腺,占病例总数的45.83%,接近一半,其次为结直肠、小肠、胃、食管,从发病部位来说,本研究病例与文献报道基本是符合的。GEP-NEN可发生于任何年龄,平均发病年龄约50岁,男性多于女性。本文GEP-NEN病例平均发病年龄约49岁, 与文献报道相符合[9],本文低分化神经内分泌癌患者平均年龄显著高于高分化神经内分泌肿瘤患者,两组患者性别构成无显著性差异。
大约80%的GEP-NEN为非功能性的,没有神经内分泌症状,这给GEP-NEN的诊断带来困难。本研究病例中有3例为功能性GEP-NET,其余均为非功能性GEP-NET,临床症状包括腹痛、便血、排便次数增多、黄疸、吞咽困难、呕血等,临床症状没有特异性,依据临床症状无法对病灶的良恶性作出判断,因此,通过影像学手段术前识别GEP-NEN的恶性征象及判断良恶性显得尤为重要,因为术前判断GEP-NET的病理分级能够为临床进行术式选择及切除范围提供参考依据。本研究探讨CT征象与GEP-NET的病理分级的相关性,发现一些CT征象与GEP-NET的分级有显著相关性,包括最大径、形态、生长方式、边界、淋巴结转移、远处转移,而另一些CT征象与GEP-NET的分级无显著相关性,包括坏死囊变、强化方式、强化程度、周围侵犯。这是国内外为数不多的探讨GEP-NET的影像学表现与病理分级的相关性的文章。
本文证实不同病理分级的肿瘤最大径有显著差异(P=0.019),本研究病例中,高分化神经内分泌肿瘤直径>40mm的有4例,占23.52%,低分化神经内分泌癌直径>40mm的有6例,占85.71%。这表明肿瘤越大,低分化神经内分泌癌的可能性越大,这与既往文献报道是一致的。比如敖炜群等[10]回顾性分析19例经手术病理证实的囊实性胰腺神经内分泌肿瘤(CPNETs)的CT特征与Ki-67表达的相关性,发现Ki-67的表达与肿瘤的直径呈正相关,提示肿瘤越大,恶性可能性越高。韩冬等[11]回顾性分析45例经手术病理证实的胃肠道神经内分泌肿瘤(GE-NEN),分析肿瘤的CT影像特征对良恶性判断的准确性,发现肿瘤的最大径及体积与病理分级之间均存在相关性,并且经统计学处理,获得的“肿瘤体积”的最佳临界值为6.5cm,敏感度为0.833,特异度为0.905。
肿块的形态、生长方式、边界与病理分级均有显著相关性。本研究病例中,高分化神经内分泌肿瘤大多表现为形态较规则的圆形或卵圆形肿块,局限性生长、边界清楚,低分化神经内分泌癌表现为分叶状或不规则肿块,浸润性生长、边界欠清晰。理论上来说,肿瘤越不规则、边界越模糊,恶性可能性越高,所以本研究结果理论上是合理的,但是既往文献在这方面的报道并不完全一致。张雪辉等[12]回顾性分析54例胃肠道神经内分泌肿瘤患者,把患者按病理学分为高分化神经内分泌肿瘤(G1+G2)及低分化神经内分泌肿瘤(G3)两组,分析其影像特点并与病理进行对照,发现两组病例在肿瘤边界(清晰或模糊)、生长方式(浸润性生长或局限性肿块)方面差异均无显著性。所以,肿块的形态、生长方式、边界的差异对病理分级的意义有待更进一步研究。
动态增强时,高分化神经内分泌肿瘤及低分化神经内分泌癌均有较大比例呈不均匀强化及显著强化,强化方式及强化程度均与病理分级无显著相关性。本研究结果显示,增强扫描对高分化神经内分泌肿瘤及低分化神经内分泌癌的鉴别诊断价值有限,即使是高分化神经内分泌肿瘤,也大部分是富血供肿块,且较易发生不均匀强化。既往江少凡等[7]研究也发现神经内分泌肿瘤大部分呈显著强化,强化程度均与神经内分泌肿瘤分级无显著相关性,这与本研究是一致的,所以临床工作中遇到典型的明显强化的肿瘤,可以作为神经内分泌肿瘤与其他肿瘤的一个鉴别点。江少凡等[7]研究结果表明神经内分泌肿瘤是否出现囊变坏死与分级有显著相关性,低分化神经内分泌癌较高分化神经内分泌肿瘤更容易出现囊变坏死。韩冬等[11]研究也发现是否发生囊变、坏死或溃疡与肿瘤病理之间存在显著性差异,并且与患者的生存时间存在相关性。但是,段小玲等[13]回顾性分析16例经手术病理证实的胰腺神经内分泌肿瘤,发现肿瘤病理级别与囊实性及强化方式无明显的相关性,同样,本研究结果并未发现是否出现坏死囊变在两组间有显著差异(P=0.072)。因此,对于GEP-NET内部成分与病理分级的相关性,目前还没有统一的结论,还有待进一步研究。
高分化神经内分泌肿瘤及低分化神经内分泌癌均出现肿瘤侵犯邻近组织,两组肿瘤对邻近器官侵犯的比例分别为5.88%、42.86%,理论上来说,低分化的神经内分泌癌较易累及邻近器官,但是在本研究中,并未发现邻近器官侵犯在两组间存在显著差异(P=0.108)。10例肿瘤出现淋巴结转移,7例为低分化的神经内分泌癌,3例为高分化的神经内分泌肿瘤。10例肿瘤出现远处器官转移,6例为低分化的神经内分泌癌,4例为高分化的神经内分泌肿瘤。淋巴结转移及远处器官转移均与肿瘤病理分级有显著相关性。此外,在本研究中,小部分病理偏良性的GEP-NEN亦发生恶性肿瘤的生物学行为,包括侵犯邻近器官、淋巴结转移及远处器官转移。所以,在临床工作中不能因为肿瘤侵犯邻近器官、淋巴结转移或远处器官转移,就直接判断为低分化的神经内分泌癌,让患者失去手术治疗机会。有研究发现,即使患者已发生转移,手术切除肿瘤仍能使患者生存期明显延长[14-15]。
综上所述,利用增强CT观察肿瘤大小、形态、生长方式、边界、淋巴结转移、远处转移,进而评估GEP-NEN的病理分级及恶性倾向,有一定的可行性,可以为临床制定治疗方案、判断患者预后提供帮助。但本研究病例数相对较少,且不同病理分级的GEP-NEN影像表现有一定的交叉。另外,磁共振(MRI)对腹部占位性病变的观察比CT有一定的优越性,具有良好的软组织对比度和分辨力,可多方位成像,能提供更多的信息,包括弥散受限情况、ADC值,且MRI能更好的显示病灶内部成分比如脂肪、血肿等,也有部分文献探讨MRI在神经内分泌肿瘤术前分级中的应用价值[16-17]。而本研究病例只有少数术前同时行腹部增强MRI检查,所以接下来应进一步加大样本量,并且结合CT、MRI及病理综合分析,对于术前判断GEP-NEN的病理分级具有一定作用,并对治疗和判断预后有一定的指导作用。

