急性盐度胁迫下黄鳍棘鲷NKCC1a分子特征及其表达
李亚玲,朱克诚,刘宝锁,郭华阳,郭 梁,张 楠,杨静文,江世贵,张殿昌
急性盐度胁迫下黄鳍棘鲷分子特征及其表达
李亚玲1,2,朱克诚1,3,刘宝锁1,3,郭华阳1,3,郭 梁1,3,张 楠1,3,杨静文1,3,江世贵1,3,张殿昌1,3
(1.中国水产科学研究院南海水产研究所/农业部南海渔业资源开发利用重点实验室,广东 广州 510300;2.中国农业科学院研究生院,北京 100089;3.广东省海洋生物种业工程技术研究中心,广东 广州 510300)
【目的】研究基因在急性盐度胁迫下对黄鳍棘鲷()的渗透压调控机理。【方法】用生物信息学软件分析的序列特征,用实时荧光定量PCR(qRT-PCR)技术检测其在黄鳍棘鲷各组织内的表达情况及其在盐度0、8、16、24(对照)和32条件下的表达模式。【结果】开放阅读框(ORF)大小为3 435 bp,共编码1 144个氨基酸,存在一个经典的Na+-K+-Cl-协同转运蛋白SLC12A结构域,且在不同物种中有高保守性。在13个组织中均有表达,在脑中表达量最高,显著高于其他组织(< 0.05);其次为鳃,在性腺和肝脏中表达量则显著低于其他组织(< 0.05)。盐度胁迫6 h时,在淡水组(盐度0)中表达量显著上升(< 0.05);在盐度为8和16处理组中,表达量先降低后逐渐升高,随后趋于平稳;在盐度32处理组,表达量呈先升高后降低最后又升高趋势,在24 h时最大。【结论】基因在黄鳍棘鲷盐度适应中发挥重要作用。
黄鳍棘鲷;;基因表达;急性盐度胁迫
Na+/K+/2Cl-协同转运蛋白(Na+/K+/2Cl-Cotransporter,NKCC)是促进Na+、K+、Cl-进出细胞的跨膜转运蛋白,广泛存在于多种动物。NKCC有NKCC1和NKCC2两种亚型,同属于溶质载体12转运家族Na+依赖性亚群[1]。其中,NKCC1含有NKCC1a和NKCC1b两个亚型[2-3]。参与鱼类渗透压调节的相关过程,且在维持细胞体积稳态、电解质含量等方面发挥重要作用。
目前,在底鳉()[4]、鲻()[5]、玛丽鱼()[6]、绿腹丽鱼()[7]、舌齿鲈()[8]、莫桑比克罗非鱼()[9-12]、欧洲鳗鲡()[2]、青鳉()[13]、大西洋鲑()[14-15]和攀鲈()[16]等海水硬骨鱼类中已有报道,表明在鱼体渗透压调节过程中起关键性作用。底鳉()移入淡水后,各组织表达均受抑制;在半咸水转海水后,表达增加[17]。海水驯化后,日本鳗鲡()鳃的mRNA水平出现明显上调[2]。在慢性盐度胁迫条件下,“吉丽”罗非鱼 [萨罗罗非鱼()♂×尼罗罗非鱼()♀] 鳃内的表达量和外界水体盐度呈正相关关系[18],其他海水硬骨鱼类有类似结果[3,19,20]。宋慧[21]提出,在一定盐度范围内,随水体盐度升高,大银鱼()胚胎表达量升高。而不同急性盐度胁迫下,卵形鲳鲹()鳃、肠和肾的表达量显著上升[22]。在急性低盐胁迫条件下,红鳍东方鲀()幼鱼基因的表达量因盐度变化和持续时间的差异而不同[23]。由此可见,在鱼类适应盐度变化的过程中,NKCC是一种负责离子渗透的关键转运蛋白,在鱼类渗透调节中发挥关键性作用。
黄鳍棘鲷()属浅海暖水性底层鱼类,是重要的海水经济鱼类。近年来,由于过度捕捞、环境污染严重、鱼病频发等,黄鳍棘鲷种质退化严重,天然黄鳍棘鲷苗种远不能满足实际需要[24]。黄鳍棘鲷苗种培育已取得一定进展,但育苗技术还不稳定。稚鱼培育是黄鳍棘鲷苗种培育的关键阶段,盐度是影响苗种成活与健康生长最重要的环境因子之一。目前对黄鳍棘鲷的抗盐胁迫相关基因的研究还未见报道,为深入研究基因在急性盐度胁迫下对黄鳍棘鲷的渗透压调控机理,笔者用生物信息学软件分析其序列特征,并用实时荧光定量PCR(qRT-PCR)技术检测在黄鳍棘鲷各组织内的表达情况及其在急性盐度胁迫条件下的表达模式,以期为解析基因在黄鳍棘鲷稚鱼调节渗透压和离子平衡过程中的功能机制奠定基础,并为黄鳍棘鲷早期苗种培育提供一定参考。
1 材料与方法
1.1 材料和实验设计
实验用黄鳍棘鲷稚鱼由中国水产科学研究院南海水产研究所深圳试验基地提供,体长(13.76 ± 0.74)mm、体质量(0.042 ± 0.022)g(= 80),实验前暂养一周,保持充氧,水温(23 ± 2)℃。健康黄鳍棘鲷购自水产市场,随机取鱼3尾,取脑、鳃、鳍、眼、脾、胃、心、肠、皮肤、肾、肌、肝和性腺等13个组织,经液氮速冻后置于-80℃备用。
设置0、8、16、24(对照组)和32等5个盐度梯度,每梯度设3个平行组。取暂养的规格相近健康黄鳍棘鲷稚鱼120尾,分别于各盐度条件下胁迫0、6、12、24、48、72和96 h,每组每时间点随机取稚鱼6尾,经液氮速冻后置于-80℃备用。
1.2 总RNA提取与cDNA合成
按照HiPure UnIversal RNA Mini Kit(Megen,广州)试剂盒说明书抽提上述黄鳍棘鲷的总RNA。通过琼脂糖凝胶电泳、NanoDrop 2000(Thermo Fisher,美国)检测其完整性及浓度和纯度。参照RT Kit with gDNA Clean for qPCR Ⅱ(瑞真,广州)试剂盒说明书把上述RNA样品逆转录为cDNA用于qRT-PCR。
1.3 NKCC1a序列的获取
本课题组采用全基因组测序技术获得黄鳍棘鲷序列[25],经GenBank数据库数据比对后发现,其与其他鱼类的同源性较高。此外,利用Primer Premier 5.0设计特异性引物(表1)对其开放阅读框(ORF)进行验证。以黄鳍棘鲷cDNA为模板进行PCR,25 μL反应体系包括:16.7 μL ddH2O,2.5 μL 10×buffer,2 μL dNTPs,1.5 μL MgCl2,100 μmol•L–1上下游引物各0.5 μL,0.3 μL rTaq酶,(50 ± 5) ng模板cDNA;反应程序:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 60 s,35个循环;72℃ 10 min。PCR产物送至广州睿博生物有限公司测序。

表1 实验用引物
1.4 NKCC1a基因生物信息学分析
用DNAman拼接测序片段,用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测开放阅读框,用ExPASy-Compute pI/Mw tool(https://web.expasy.org/compute_pi/)预测等电点和分子质量,用NetNGlyc 1.0 Server(hrvices/NetNGlyc/)预测糖基化位点,用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点,用TMHMM Server, v.2.0(htts/TMHMM/)预测跨膜结构域,用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/ SignalP/)预测信号肽,通过NCBI(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测结构域,用SWISS-MODEL(https://swissmodel.expasy.org/)预测三维结构,用ClustalW、GENEDOC进行多重序列比对,用MEGA7.0构建系统进化树。
1.5 实时荧光定量PCR (qRT-PCR)
采用Primer Premier 5.0设计的荧光定量引物(表1)。选择黄鳍棘鲷作为内参基因并设计引物(表1)。对健康黄鳍棘鲷的脑、鳃、鳍、眼、脾、胃、心、肠、皮肤、肾、肌、肝和性腺组织进行定量分析。采用qPCR检测在急性盐度胁迫下,黄鳍棘鲷稚鱼在0、6、12、24、48、72和96 h时的表达水平。
根据SYBR Green Premix Pro Taq HS qPCR Kit(瑞真,广州)说明书在Roche LightCycler®480Ⅱ(Roche)上进行qPCR反应。反应体系:2×SYBR Green Pro Taq HS Premix 6.25 µL、cDNA模板(50 ± 5) ng,-qF、-qR各0.5 µL(100 μmol·L–1),ddH2O 4.25 µL。反应程序:95℃30 s;95℃ 10 s,60℃ 30 s,72℃ 30 s,40个循环。每个样品设3个重复。PCR结束后确认扩增曲线及熔解曲线,以确保其特异性。
1.6 数据处理
实时荧光定量PCR数据处理使用2-ΔΔCT法。运用SPSS 20.0软件进行单因素方差分析(One-Way ANOVA),并采用Duncan检验多重比较,结果用平均值 ± 标准差表示,显著性水平为0.05。用Graphpad Prism软件作图。
2 结果与分析
2.1 NKCC1a生物信息学分析
基因的开放阅读框(ORF,GenBank登录号:OK324137)为3 435 bp,编码1 144个氨基酸,分子质量约124.5 ku,理论等电点为5.75。在预测的氨基酸序列中发现有3个N-糖基化位点,15个保守的半胱氨酸残基和107个磷酸化位点(其中包括64个丝氨酸位点和43个苏氨酸位点)。SignalP5.0分析显示,NKCC1a无信号肽(图1)。

方框内为起始密码子ATG,用*标记终止密码子TAA;下划线部分代表跨膜结构域;阴影部分代表糖基化位点;圆圈表示保守的半胱氨酸
图1显示,黄鳍棘鲷NKCC1a含有11个疏水性跨膜(TM)结构域,分别位于第232 ~ 254、264 ~ 286、306 ~ 328、348 ~ 370、377 ~ 399、428 ~ 450、457 ~ 479、541 ~ 563、598 ~ 620、624 ~ 643和656 ~ 678位氨基酸。其中,在TM7和TM8之间存在N-糖基化位点。分析表明,在第158 ~ 1 144位氨基酸是2a30蛋白超家族结构域,典型的NKCC1协同转运蛋白氨基酸通透酶结构域和Na+-K+-Cl-共同转运蛋白SLC12A结构域分别位于第232 ~ 734和743 ~ 1 144位氨基酸。NKCC1a的二级蛋白结构表明,β折叠(4.55%)、α螺旋(42.83%)、无规则卷曲(38.20%)和延伸主链(14.42%)。其预测的三维结构如图2所示。
氨基酸序列比对表明,黄鳍棘鲷NKCC1a氨基酸与金头鲷() 的同源性最高(98.51%),其次为舌齿鲈(,93.79%)、眼斑拟石首鱼(,93.27%)、大黄鱼(,92.57%)、莫桑比克罗非鱼(,90.38%)。与人()、非洲爪蟾()和小鼠()的同源性较低,分别是75.35%、75.14%和74.98%,表明NKCC1a基因在鱼类中较为保守(图3)。

图2 黄鳍棘鲷NKCC1a三级结构

黑色下划线表示11个跨膜结构域(TMD1-11);虚线表示Na+-K+-Cl-协同转运蛋白SLC12A结构域
Black underline indicates 11 transmembrane domains (TMD1-11); The dotted line indicates the Na+-K+-Cl- cotransporter SLC12A domain
图3 黄鳍棘鲷NKCC1a与其他物种NKCC氨基酸序列比对
Fig.3 Alignment of amino acid sequence of NKCC fromand other species
系统进化分析显示,24个物种的NKCC序列分成NKCC1和NKCC2两个进化支。其中,黄鳍棘鲷NKCC1a聚集到NKCC1a分支中(图4)。
2.2 NKCC1a组织表达
图5表明,黄鳍棘鲷13个组织中均有表达,其中表达量最高的组织为脑,且显著高于其他组织(< 0.05),其次为鳃,而在性腺和肝脏中的表达量则显著低于其他组织(< 0.05)。

图4 NKCC1a系统进化树

不同小写字母表示两组间差异显著(P<0.05)
2.3 在急性盐度胁迫后NKCC1a基因的表达
图6可见,随着胁迫时间的增加,不同盐度组表达量的增减趋势不同。自胁迫6 h起,淡水组(盐度0)表达量显著上升(< 0.05);盐度8和16组先降后升,随后趋于平稳;盐度32组呈先升高后降低最后又升高趋势,在24、96 h时显著高于其他时间点(< 0.05)。。
相同时间点,各实验组表达量与盐度24组(对照)均有显著差异。在6 h时,盐度0组表达量显著高于对照组(< 0.05);而盐度8和16组表达量显著低于对照组(< 0.05)。在24和96 h时,盐度32组的表达量均显著高于对照组(< 0.05)。
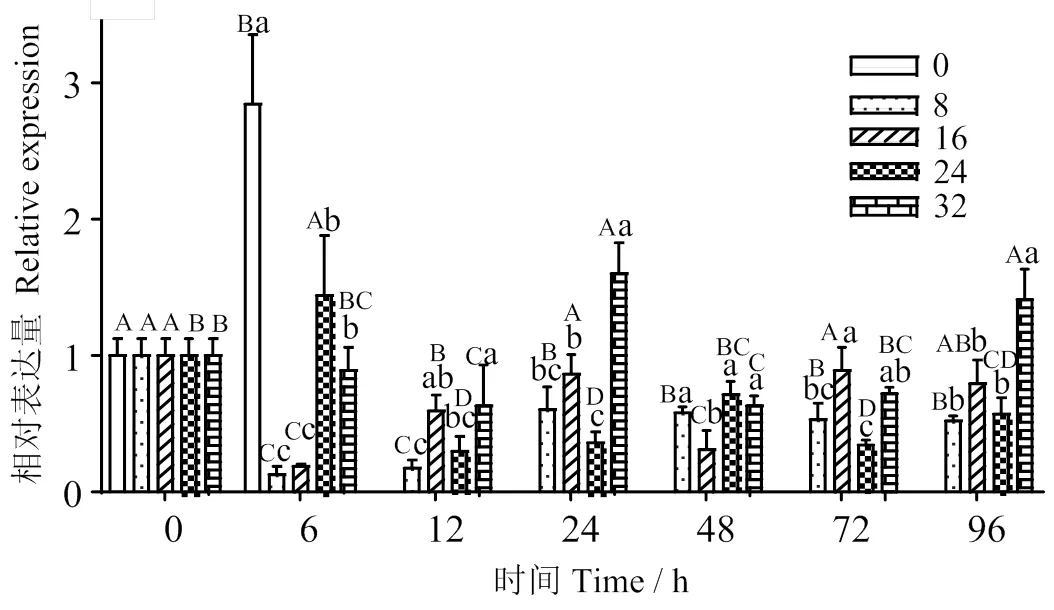
不同小写字母表示同一时间下不同处理组之间差异显著(P < 0.05);不同大写字母表示同一盐度下不同时间之间差异显著(P < 0.05)
3 讨论
NKCC1a是上皮细胞内的电中性跨膜转运蛋白。本研究表明,黄鳍棘鲷NKCC1a N端氨基酸无信号肽,为非分泌型蛋白,中心疏水区由11个疏水性跨膜(TM)结构域组成。TM2与阳离子亲和力有关,TM4和TM7主要影响阴离子亲和力[26]。糖基化位点位于TM7-8的胞外环,该糖基化对细胞转运活性至关重要[27]。当水体盐度发生改变时,鱼体通过改变跨膜结构域的离子亲和力,控制胞内离子的排泄和吸收而维持稳态平衡。在第743 ~ 1 144位氨基酸有经典的Na+-K+-Cl-共同转运蛋白SLC12A结构域,与金头鲷、舌齿鲈、斑马鱼()等的NKCC1a结构域高度一致,表明NKCC1a结构域在不同物种中高度保守,黄鳍棘鲷NKCC1a与其他物种一样,有潜在的Na+-K+-Cl-离子共同转运功能。
在莫桑比克罗非鱼[3]、卵形鲳鲹[22]、大西洋鲑[28]和舌齿鲈[8]等硬骨鱼类组织中均有表达。本研究中,黄鳍棘鲷组织表达谱有广泛性,在13个组织中均有表达。脑中表达量最高,显著高于其他组织(<0.05),其次为鳃,而在性腺和肝脏中表达量则显著低于其他组织(<0.05)。NKCC是依靠Na+-K+-ATPase产生的Na+跨膜电化学势能差,跨膜运输Na+、K+、Cl-的继发性转运蛋白[29]。在生物生长发育过程中,细胞内外Na+、K+浓度会短暂性变化,因此,为满足黄鳍棘鲷脑组织在生长发育过程中对能量及离子等的需求,在脑中会出现高表达现象[30];此外,鳃组织是大部分海水鱼类维持体内渗透压平衡的重要调节器官[31]。由此推断,黄鳍棘鲷在渗透调节器官中有一定功能。
本研究表明,对盐度变化反应迅速,在转入淡水后6 h时表达量显著上升,与卵形鲳鲹()肠的结果[22]类似。海水硬骨鱼类对盐度适应机制为渗透调节型[32],先通过吞饮大量海水吸取水分,后经肠道消化吸收,最后由肾和鳃排泄大量离子维持体内渗透压。置淡水环境时,吞食水的反射和水分的扩散使鱼机体肠内水量增加。为进一步阻止反射和促进水分排泄,鱼体内NKCC被激活,基因表达量升高,从而促进离子进入细胞,导致胞内离子浓度增加[22]。黄鳍棘鲷虽有较强的渗透压调节能力,但不能在急性条件下很好地适应淡水[33],即会激活基因以适应低盐胁迫。在高盐胁迫下,黄鳍棘鲷表达量增加,表明在黄鳍棘鲷适应高盐环境时发挥一定作用。在欧洲鳗鲡[2]、黑鲷()[34]、底鳉[17]、莫桑比克罗非鱼[9]和龟纹圆鲀()[35]中也有类似结果。另外,有学者曾解释,表达量增加与高失水细胞体积恢复相关,表达量增加提高了NKCC活性,将离子从胞外转运进胞内,使细胞内离子浓度升高,从而有助于高盐失水后的细胞吸取水分,最终使细胞体积恢复到正常状态[35]。本研究高盐度(盐度32)胁迫后期,黄鳍棘鲷表达量增加也可能与高失水细胞的体积恢复相关。综上,该研究有助于揭示黄鳍棘鲷参与细胞渗透压调节的功能机理,为鱼类渗透压调节研究提供一定理论基础。
[1] CASTROP H, SCHNERMANN J.Isoforms of renal Na-K-2Cl cotransporter NKCC2: expression and functional significance[J].American Journal of Physiology - Renal Physiology, 2008, 295(4): F859-F866.
[2] CUTLER C P, CRAMB G.Two isoforms of the Na+/K+/2Cl−cotransporter are expressed in the European eel ()[J].Biochimica et Biophysica Acta (BBA) - Biomembranes, 2002, 1566(1/2): 92-103.
[3] HIROI J, YASUMASU S, MCCORMICK S D, et al.Evidence for an apical Na-Cl cotransporter involved in ion uptake in a teleost fish[J].The Journal of Experimental Biology, 2008, 211(Pt 16): 2584-2599.
[4] FLEMMER A W, MONETTE M Y, DJURISIC M, et al.Phosphorylation state of the Na+-K+-Cl-cotransporter (NKCC1) in the gills of Atlantic killifish () during acclimation to water of varying salinity[J].The Journal of Experimental Biology, 2010, 213(Pt 9): 1558-1566.
[5] LI L, JIANG M, SHEN X Q.Gene expressions levels of 14-3-3a, NKCCla, A PO-14, and Na+-K+-ATPaseβ in gill tissue ofacclimated to low salinity[J].Genetics and Molecular Research: GMR, 2017, 16(1): 2017,16(1).doi: 10.4238/gmr16019444
[6] YANG W K, KANG C K, CHEN T Y, et al.Salinity-dependent expression of the branchial Na+/K+/2Cl−cotransporter and Na+/K+-ATPase in the sailfin molly correlates with hypoosmoregulatory endurance[J].Journal of Comparative Physiology B, 2011, 181(7): 953-964.
[7] CHANDRASEKAR S, NICH T, TRIPATHI G, et al.Acclimation of brackish water pearl spot () to various salinities: relative changes in abundance of branchial Na+/K+-ATPase and Na+/K+/2Cl-co-transporter in relation to osmoregulatory parameters[J].Fish Physiology and Biochemistry, 2014, 40(3): 983-996.
[8] LORIN-NEBEL C, BOULO V, BODINIER C, et al.The Na+/K+/2Cl-cotransporter in the sea bassduring ontogeny: involvement in osmoregulation[J].The Journal of Experimental Biology, 2006, 209(Pt 24): 4908-4922.
[9] INOKUCHI M, HIROI J, WATANABE S, et al.Gene expression and morphological localization of NHE3,and NKCC1a in branchial mitochondria-rich cells of Mozambique tilapia () acclimated to a wide range of salinities[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 151(2): 151-158.
[10] BAYSOY E, ATLI G, CANLI M.The effects of salinity and salinity+metal (chromium and lead) exposure on ATPase activity in the gill and intestine of tilapia[J].Archives of Environmental Contamination and Toxicology, 2013, 64(2): 291-300.
[11] QIANG J, WANG H, KPUNDEH M D, et al.Effect of water temperature, salinity, and their interaction on growth, plasma osmolality, and gill Na+, K+-ATPase activity in juvenile GIFT tilapia(L.)[J].Journal of Thermal Biology, 2013, 38(6): 331-338.
[12] LI Z J, LUI E Y, WILSON J M, et al.Expression of key ion transporters in the gill and esophageal-gastrointestinal tract of euryhaline Mozambique tilapiaacclimated to fresh water, seawater and hypersaline water[J].PLoS One, 2014, 9(1): e87591.
[13] KANG C K, YANG W K, LIN S T, et al.The acute and regulatory phases of time-course changes in gill mitochondrion-rich cells of seawater-acclimated medaka () when exposed to hypoosmotic environments[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2013, 164(1): 181-191.
[14] NILSEN T O, EBBESSON L O E, MADSEN S S, et al.Differential expression of gill Na+, K+-ATPase alpha- and beta-subunits, Na+, K+, 2Cl-cotransporter and CFTR anion channel in juvenile anadromous and landlocked Atlantic salmon[J].The Journal of Experimental Biology, 2007, 210(Pt 16): 2885-2896.
[15] BYSTRIANSKY J S, SCHULTE P M.Changes in gill H+-ATPase and Na+/K+-ATPase expression and activity during freshwater acclimation of Atlantic salmon ()[J].The Journal of Experimental Biology, 2011, 214(Pt 14): 2435-2442.
[16] LOONG A M, CHEW S F, WONG W P, et al.Both seawater acclimation and environmental ammonia exposure lead to increases in mRNA expression and protein abundance of Na⁺: K⁺: 2Cl⁻ cotransporter in the gills of the climbing perch,[J].Journal of Comparative Physiology B, Biochemical, Systemic, and Environmental Physiology, 2012, 182(4): 491-506.
[17] SCOTT G R, RICHARDS J G, FORBUSH B, et al.Changes in gene expression in gills of the euryhaline killifishafter abrupt salinity transfer[J].American Journal of Physiology Cell Physiology, 2004, 287(2): C300-C309.
[18] 王兵, 范武江, 李思发.不同盐度下“吉丽”罗非鱼(尼罗罗非鱼♀×萨罗罗非鱼♂)NKCC1a mRNA的组织特异性表达[J].中国水产科学, 2011, 18(3): 515-522.
[19] SCOTT G R, CLAIBORNE J B, EDWARDS S L, et al.Gene expression after freshwater transfer in gills and opercular epithelia of killifish: insight into divergent mechanisms of ion transport[J].The Journal of Experimental Biology, 2005, 208(Pt 14): 2719-2729.
[20] TIPSMARK C K, MADSEN S S, BORSKI R J.Effect of salinity on expression of branchial ion transporters in striped bass ()[J].Journal of Experimental Zoology, 2004, 301A(12): 979-991.
[21] 宋慧.基于转录组测序技术的大银鱼胚胎盐胁迫适应分子机理研究[D].太谷: 山西农业大学, 2014.
[22] ZHAO C P, GUO H Y, ZHU K C, et al.Molecular characterization of Na+/K+/2Cl−cotransporter 1 alpha from(Linnaeus, 1758) and its expression responses to acute salinity stress[J].Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2018, 223: 29-38.
[23] 孙梦蕾, 吕绘倩, 暴宁, 等.急性低盐胁迫下红鳍东方鲀幼鱼IgM、NKCC1和Hsp70基因的表达[J].中国水产科学, 2017, 24(1): 65-72.
[24] 朱克诚, 宋岭, 刘宝锁, 等.黄鳍棘鲷家系亲缘关系鉴定[J].水产学报, 2020, 44(3): 351-357.
[25] ZHU K C, ZHANG N, LIU B S, et al.A chromosome-level genome assembly of the yellowfin seabream (; Hottuyn, 1782) provides insights into its osmoregulation and sex reversal[J].Genomics, 2021, 113(4): 1617-1627.
[26] HWANG P P, LEE T H, LIN L Y.Ion regulation in fish gills: recent progress in the cellular and molecular mechanisms[J].American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2011, 301(1): R28-R47.
[27] SUVITAYAVAT W, DUNHAM P B, HAAS M, et al.Characterization of the proteins of the intestinal Na+-K+-2Cl-cotransporter[J].American Journal of Physiology-Cell Physiology, 1994, 267(2): C375-C384.
[28] SUNDH H, NILSEN T O, LINDSTRÖM J, et al.Development of intestinal ion-transporting mechanisms during smoltification and seawater acclimation in Atlantic salmon[J].Journal of Fish Biology, 2014, 85(4): 1227-1252.
[29] HAMILTON K L, DEVOR D C.Ion Channels and Transporters of Epithelia in Health and Disease[M].New York: Springer New York, 2016.
[30] CORTAS N, ARNAOUT M, SALON J, et al.Isoforms of Na, K-ATPase in: II.Tissue distribution and kinetic characterization[J].The Journal of Membrane Biology, 1989, 108(2): 187-195.
[31] SHIVAKUMAR K, JAYARAMAN J.Salinity adaptation in fish: interaction of thyroxine with fish gill mitochondria[J].Archives of Biochemistry and Biophysics, 1986, 245(2): 356-362.
[32] 谢从新, 张家波, 刁晓明, 等.鱼类学[M].北京: 中国农业出版社, 2010: 395.
[33] 崔淼, 王梓斌, 李钰杰, 等.黄鳍鲷苗种淡化技术研究[J].水产养殖, 2021, 42(6): 67-69.
[34] 林李泉, 刘明珠, 林国荣, 等.黑鲷NKCC1分子特征及其对急性盐度胁迫的表达响应[J].广西科学院学报, 2021, 37(2): 133-143.
[35] PRODOCIMO V, FREIRE C A.The Na+, K+, 2Cl−cotransporter of estuarine pufferfishes (and) in hypo- and hyper-regulation of plasma osmolality[J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2006, 142(3/4): 347-355.
Molecular Characteristics and Expression Analysis offromunder Acute Salinity Stress
LI Ya-ling1,2, ZHU Ke-cheng1,3, LIU Bao-suo1,3, GUO Hua-yang1,3, GUO Liang1,3, ZHANG Nan1,3, YANG Jing-wen1,3, JIANG Shi-gui1,3, ZHANG Dian-chang1,3
(1./&,,510300,; 2.,100089,; 3.,510300,)
【Objective】To study the role ofin the osmoregulation ofunder acute salinity stress.【Method】Bioinformatic approach was used to analyze the sequence of, and real-time quantitative PCR (qRT-PCR) was used to study the expression pattern ofin 13 tissues under acute salinity stress [salinity 0, 8, 16, 24 (control) and 32].【Result】 The open reading frame ofis 3435 bpencoding a 1 144 amino acids protein and has a classic Na+/K+/2Cl-co-transporter SLC12A domain, which is highly conserved in different species.Tissue expression analysis shows thatwas expressed in the 13 tested tissues, highest in the brain and then in gill, lowest in gonads and liver (< 0.05).Under acute salinity stress, the expression level ofin fresh-water group (salinity 0) increased significantly from the 6th hour.In the 8 and 16 salinity group, the expression level ofdecreased initially, then gradually increased, and then leveled off; In the 32 salinity group, the expression level ofshowed an increasing-decreasing-increasing trend, and reached the maximum at the 24th hour.【Conclusion】The results suggest that thegene plays an important role insalinity adaptation.
;; gene expression; acute salinity stress
S917.4
A
1673-9159(2022)02-0020-09
10.3969/j.issn.1673-9159.2022.02.003
2021-11-03
农业部财政重大专项 (NHYYSWZZZYKZX2020);广东省现代农业产业技术体系海水鱼产业创新项目 (2019KJ143)
李亚玲(1996―),女,硕士研究生,研究方向为水产养殖和遗传育种。E-mail:940971037@qq.com
张殿昌(1977―),男,博士,研究员,从事水产种质资源与遗传育种研究。E-mail:zhangdch@scsfri.ac.cn
李亚玲,朱克诚,刘宝锁,等.急性盐度胁迫下黄鳍棘鲷分子特征及其表达[J].广东海洋大学学报,2022,42(2):20-28.
(责任编辑:刘庆颖)

