甲酸对酿酒酵母的细胞毒性
曾令杰,黄锦翔,丰丕雪,安佳星,佀再勇,龙秀锋,伍时华,易 弋
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西 柳州 545006)
燃料乙醇因其具有清洁、可持续、可再生等特性,被认为是目前取代化石燃料的最有潜力的可再生能源之一[1]。木质纤维素是地球上贮量最为丰富、分布广泛且价格低廉的可再生资源,通过其生产燃料乙醇不仅能满足当前的能源需求,而且能有效减少环境污染[2]。木质纤维素由纤维素、半纤维素和木质素3 种物质组成,这3 种组分之间由共价键和氢键相互作用而紧密结合。利用木质纤维素原料进行乙醇发酵需要对其进行预处理,破坏纤维素复杂结构,但在预处理过程中会产生对细胞有毒害作用的抑制物。基于这些细胞抑制物的来源,通常将这些抑制物分为3 大类:糖降解产生的糠醛和5-羟甲基糠醛等呋喃类化合物,木质素分解产生的儿茶酚、丁香醛等酚类化合物,以及甲酸和乙酸等弱酸类化合物[3-4]。这些抑制物会对酵母细胞的生长、代谢和乙醇生产产生负面影响[5]。甲酸是木质纤维素原料水解液中一种常见的弱酸类抑制物,由呋喃类化合物进一步降解形成。在水解液中常见的几种弱酸,如甲酸、乙酸、乙酰丙酸,其中虽然甲酸的浓度比较低,但其对细胞抑制能力最强[6-7]。Li Yuncheng等[8]研究表明在相同浓度(30 mmol/L)弱酸胁迫下,甲酸对酿酒酵母(Saccharomyces cerevisiae)细胞的抑制作用强于乙酸和乙酰丙酸。甲酸分子质量低且pKa值较小,因此被认为是木质纤维素水解产物中毒性最强的弱酸[9-10]。Larsson等[11]研究表明甲酸的毒性强于乙酸和乙酰丙酸是因为甲酸具有更低的pKa值和解离程度小引起。
为探究甲酸对酿酒酵母的毒性机理,通过测定甲酸处理前后酿酒酵母的生长情况、葡萄糖消耗、乙醇的含量、细胞膜通透性、丙二醛(malondialdehyde,MDA)含量和己糖激酶(hexokinase,HK)活力,并结合扫描电子显微镜(scanning electron microscope,SEM)和傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)进行分析。本研究旨在了解甲酸对酵母细胞的生理毒性机制,为进一步研究提高酿酒酵母对木质纤维素水解液抑制物耐受性的方法提供理论依据。
1 材料与方法
1.1 菌种与试剂
酿酒酵母GGSF16由广西科技大学微生物研究所提供。
甲酸、三氯乙酸(均为分析纯) 西陇科学股份有限公司;戊二醛(分析纯) 天津市科密欧化学试剂有限公司;HK活性检测试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
Alpha1-2LDplus真空冷冻干燥机 德国CHRIST公司;飞纳phenom台式SEM 复纳科学仪器(上海)有限公司;Frontier FTIR仪 兴和仪器(上海)有限公司;UV-8000S紫外-可见分光光度计 上海元析仪器有限公司;SZT-15T手动粉末压片机 天津市众拓科技发展有限公司;JY91-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ZWYR-2402叠式恒温调速摇床上海智诚分析仪器制造有限公司;H2100R低温高速离心机 湖南湘仪离心机仪器有限公司。
1.3 方法
1.3.1 培养基
种子培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L;酵母膏蛋白胨葡萄糖(yeast extract peptone extrose,YEPD)培养基:葡萄糖100 g/L,蛋白胨20 g/L,酵母浸粉10 g/L;发酵培养基:葡萄糖160 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,121 ℃灭菌20 min,pH值自然。
1.3.2 酵母细胞菌悬液的制备
从斜面试管中挑取1~2 环酿酒酵母GGSF16接种到种子培养基中,在30 ℃、150 r/min摇床中培养14 h,采用血球计数对酵母细胞进行计数并稀释使其菌悬液浓度约为1×108CFU/mL。
1.3.3 甲酸对酵母细胞生长的影响
将酵母菌悬液按照10%接种量接入到YEPD培养基中,分别吸取一定量40 g/L的甲酸母液于培养基中,将甲酸配制成质量浓度分别为1.0、1.2、1.4、1.6、1.8、2.0 g/L,以未添加甲酸的菌液作为对照组,添加甲酸的菌液为处理组,30 ℃、150 r/min摇床中进行培养,每隔2 h取样,在600 nm波长处测定光密度,以时间为横坐标、光密度为纵坐标绘制生长曲线,并采用次甲基蓝染色法测定细胞死亡率[12]。每个样品进行3 次生物学重复。
1.3.4 甲酸对酵母乙醇发酵的影响
根据1.3.3节酵母细胞的生长情况,选择甲酸质量浓度1.8 g/L做后续实验。按照10%接种量将酵母细胞菌悬液接入到新鲜种子培养基中培养6 h后取30 mL菌液离心弃上清液,并用无菌水稀释至合适体积并振荡混匀,再以10%接种量将3 mL浓缩种子液加入至300 mL发酵培养基中,初始酵母细胞数为3.7×107CFU/mL。将甲酸添加到发酵培养基中使其终质量浓度为1.8 g/L作为处理组,以未添加甲酸的菌液作为对照组,在30 ℃、150 r/min摇床中培养24 h,每隔2 h取样,并用高效液相色谱仪和气相色谱仪分别测定葡萄糖和乙醇含量。液相色谱条件:Alltima Amino色谱柱(250 mm×4.6 mm,5 μm);乙腈-超纯水(80∶20,V/V)的混合液作为流动相,流速为1 mL/min,进样量为20 μL。气相色谱条件:色谱柱为TM-930(25 m×0.53 mm,1 μm);初始温度40 ℃,以5 ℃/min速率升至80 ℃,保持2 min,再以10 ℃速率升至150 ℃,进样量0.5 μL。每个样品进行3 次生物学重复。
1.3.5 甲酸对酵母细胞膜通透性的影响
按照10%接种量将酵母细胞菌悬液接入到250 mL YEPD培养基中培养8 h,添加甲酸到YEPD培养基中使其终质量浓度为1.8 g/L作为处理组,以未添加甲酸的为对照组,在30 ℃、150 r/min摇床中培养6 h,每隔2 h取样。取5 mL发酵液,在80 ℃水浴锅中灭酶5 min,然后取经水浴后的发酵液于3 000 r/min离心20 min,将上清液分别标记置于4 ℃冰箱保存。在260、280 nm波长处测定测定核酸、蛋白质的光密度,并记录好实验数据[13-14]。每个样品进行3 次生物学重复。
1.3.6 甲酸对酵母细胞MDA含量的影响
按1.3.5节培养方法,MDA含量的测定参考Howlett等[15]方法。离心收集酵母细胞,经无菌水洗涤3 次后弃上清液,加入1 mL无菌ddH2O,重悬酵母细胞,另加入2 mL 0.6%硫代巴比妥酸溶液,充分混匀并封口后于95~100 ℃水浴煮沸20 min,冷却后10 000 r/min离心5 min,取上清液分别测定450、532、600 nm波长处吸光度(A)。测定细胞干质量,根据式(1)、(2)计算MDA浓度与含量。每个样品进行3 次生物学重复。

式中:V为反应体系溶液体积/mL;W为样品质量/g。
1.3.7 甲酸对酵母细胞形态的影响
按照1.3.5节培养方法,在30 ℃、150 r/min摇床中培养4 h,取发酵液8 000 r/min、4 ℃离心10 min收集菌体,用磷酸盐缓冲液洗涤3 次,每次静置10 min,将菌体固定于体积分数2.5%的戊二醛溶液中,4 ℃过夜固定,8 000 r/min、4 ℃离心10 min,收集菌体,以20%、50%、70%、80%、100%的乙醇按照顺序依次洗涤,每个浓度处理10 min,8 000 r/min、4 ℃离心10 min收集菌体,最后使用真空冷冻干溶液燥机干燥,喷金后在SEM下观察、拍照。
1.3.8 FTIR分析
按照1.3.5节培养方法,离心收集菌体,用磷酸盐缓冲液清洗细胞3 次,冷冻干燥,本实验采用溴化钾压片法[16]。将冻干的酵母菌体与溴化钾按1∶20的质量比混合,然后用玛瑙研钵研成均匀粉末状。扫描条件设置为光谱范围400~4 000 cm-1、分辨率4 cm-1,采用溴化钾作为空白对照,每个样品在相同条件下重复3 次。
1.3.9 甲酸对酵母细胞HK活力的影响
按照1.3.5节培养方法,在30 ℃、150 r/min摇床中培养1 h,离心收集菌体,超声波破碎(功率20%,超声3 s,间隔10 s,重复30 次),8 000 r/min、4 ℃离心10 min收集上清液,置冰上待测。采用Solarbio公司HK试剂盒检测HK活力,每个样品进行3 次生物学重复。酶活性单位的定义(U/104cell):每1万 个细胞每分钟生成1 nmol NADPH定义为1 个酶活力单位。
1.4 数据统计与分析
实验数据采用GraphPad Prism 8.1软件(单因素方差分析)和Origin 9.5软件对数据进行图表的制作。
2 结果与分析
2.1 甲酸对酵母细胞生长的影响
由图1A可知,不同质量浓度甲酸对酵母细胞的生长抑制不同,且随着质量浓度的增加抑制作用加强。对照组在培养2 h开始进入对数期,6 h进入对数中期,8 h进入稳定期;添加1.4 g/L甲酸处理组在培养10 h进入稳定期,与对照组相比滞后了2 h;添加1.6 g/L甲酸处理组发现酵母细胞生长缓慢,与对照组相比,延滞期和对数期都延长了2 h,稳定期滞后了4 h;添加1.8 g/L甲酸处理组在培养6 h进入对数期,14 h进入稳定期,与对照组相比,稳定期滞后6 h。而在整个细胞生长过程中,1.8 g/L甲酸处理组的死亡率都比对照组高(图1B),尤其是在0~2 h的延滞期细胞死亡率更明显;添加2.0 g/L甲酸处理组,酿酒酵母细胞的生长完全被抑制。综上所述,甲酸对酵母细胞的生长繁殖具有一定的毒害作用。为保证后续实验的研究,选择质量浓度为1.8 g/L的甲酸作为处理组。
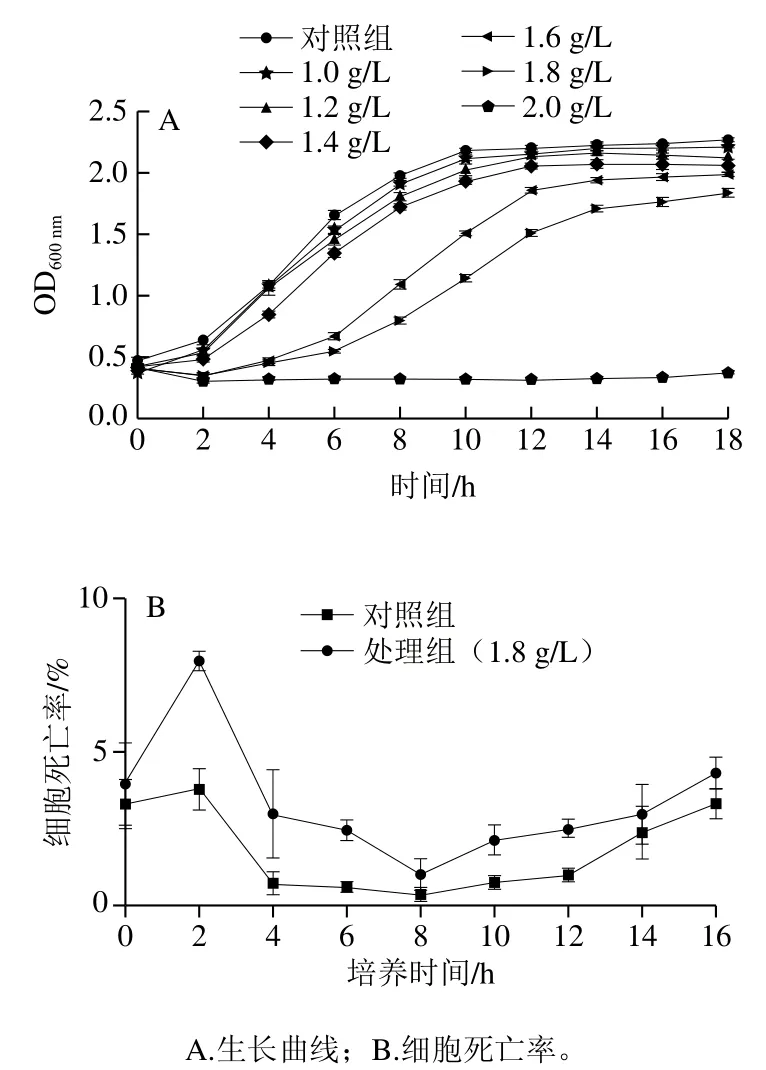
图1 甲酸对酵母细胞生长的影响Fig. 1 Effect of formic acid on the growth of yeast cells
2.2 甲酸对酵母乙醇发酵过程的影响
酵母细胞能够通过葡萄糖发酵生产乙醇,而甲酸的添加会抑制酵母细胞的生长,从而影响乙醇的生成。由图2可知,对照组在6 h后开始快速消耗葡萄糖,16 h葡萄糖消耗完全。而1.8 g/L甲酸处理在发酵前期抑制了酵母细胞对葡萄糖的利用,在10 h才开始消耗糖,与对照组相比葡萄糖消耗延长了4 h,在20 h葡萄糖才基本消耗完,延长了细胞发酵的周期,且甲酸处理组乙醇生成量显著低于对照组。说明1.8 g/L甲酸处理组在发酵前期抑制酵母细胞对糖的利用,乙醇发酵速率缓慢,在发酵中后期,酵母可能会对甲酸产生耐性,保持较高的存活率,进一步促进了对糖的利用,但甲酸的添加明显延长了酵母细胞发酵的周期,降低了乙醇产量。

图2 甲酸对酵母细胞乙醇发酵过程的影响Fig. 2 Effect of formic acid on alcohol fermentation characteristics of yeast cells
2.3 甲酸对酿酒酵母细胞膜通透性的影响
细胞膜是隔离胞内外物质的天然屏障,细胞膜通透性的增强会导致胞内重要物质泄露,从而使细胞失去活性[17]。因此,可以通过检测菌液在260 nm和280 nm波长处的光密度分析其对细胞膜的破坏程度[18]。由图3可知,甲酸处理后的酵母细胞的蛋白质和核酸释放量明显增加,OD260nm的增加比OD280nm更为明显,且随着甲酸处理时间的延长,胞外核酸和蛋白质的含量随之增加,且与对照组相比,核酸和蛋白质分别增加到1.4 倍和1.67 倍,这与蓝蔚青等[19]研究ε-聚赖氨酸使腐生葡萄球菌菌液中胞外核酸含量的增加趋势结论相似。由此推测甲酸与酵母细胞接触后,破坏了酵母细胞膜,使得细胞膜通透性增加,导致胞内物质外泄,从而使酿酒酵母的活性较低,甚至死亡。
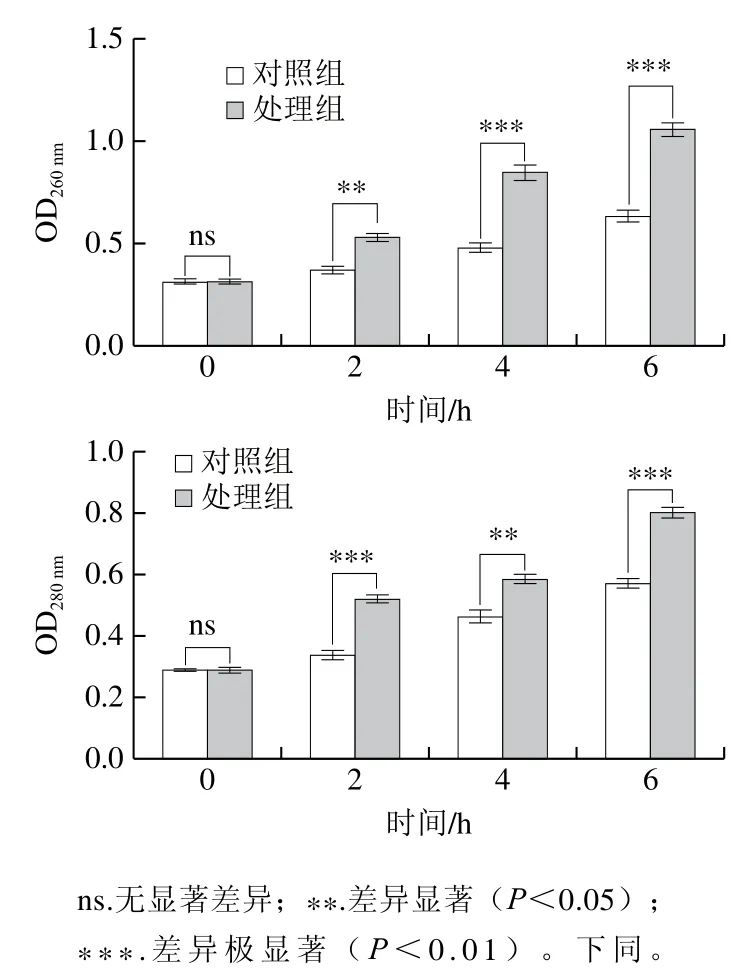
图3 甲酸对酵母细胞膜通透性的影响Fig. 3 Effect of formic acid on cell membrane permeability of yeast cells
2.4 甲酸对酵母细胞MDA含量的影响
MDA是生物体内脂质与自由基发生过氧化反应的产物,其含量可以一定程度上反映酵母细胞受胁迫损伤的程度,也能反映细胞膜所受伤害程度[20]。由图4可以看出,酵母细胞经甲酸胁迫后MDA含量随着甲酸处理时间的延长而逐渐增加。甲酸处理的第2小时,酵母细胞内MDA含量增加缓慢,随后4 h,MDA含量显著升高,与对照组相比,分别增加到3.7 倍和5.3 倍。表明短时间内甲酸不会对酵母细胞造成严重的氧化损伤,这可能是酵母对逆境的适应性反应。而随着时间的延长,细胞膜脂质过氧化程度加剧,MDA含量升高,对酵母细胞造成氧化损伤,进一步加速了细胞的死亡。这与李函彤等[21]研究不同种类的硫对酵母富铬以及体内氧化应激影响的结论相似。
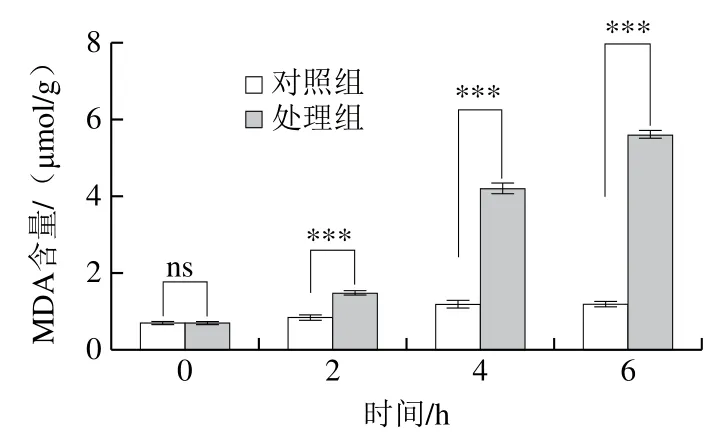
图4 甲酸对酵母细胞MDA含量的影响Fig. 4 Effect of formic acid on MDA content of yeast cells
2.5 甲酸对酵母细胞形态的影响
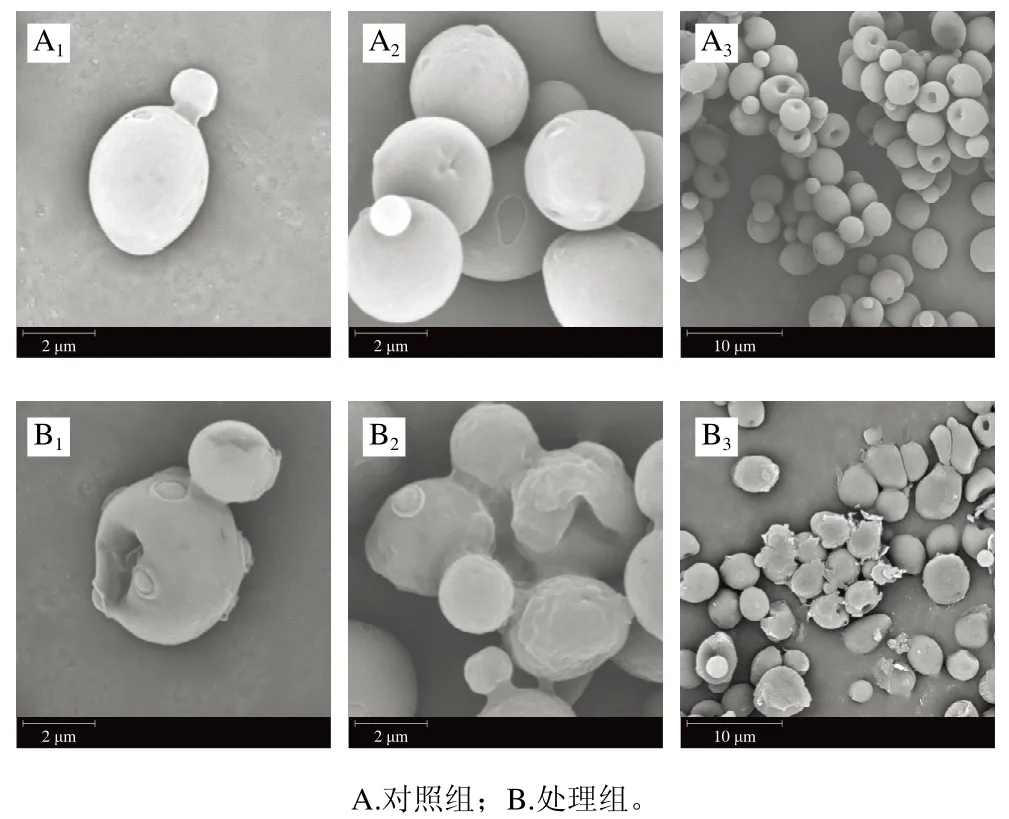
图5 甲酸处理前后SEM图Fig. 5 SEM images of yeast cells before and after formic acid treatment
由图5可以看出,对照组酵母表面光滑饱满,外形呈椭圆或圆形,细胞形态整齐且健壮,有完整的细胞壁以及光滑的细胞膜结构,酵母细胞生命力旺盛(图5A),而经过甲酸处理后细胞遭到了明显破坏,与对照组相比酵母细胞表面变得粗糙,出现空洞,边缘产生皱褶,细胞壁塌陷,细胞与细胞之间彼此粘黏现象(图5B),这可能是细胞壁和细胞膜被破损,细胞内容物泄露使它们粘连在一起,因此,从SEM图像中可以明显看出甲酸对酿酒酵母细胞壁有明显破坏作用,对细胞膜也有一定影响,从而使酵母细胞失去了细胞壁的保护,细胞正常生理代谢与物质能量代谢受阻,导致菌体生理活性受到抑制,进而导致细胞损伤与死亡。
2.6 FTIR分析
研究表明,酵母细胞壁主要由β-葡聚糖、甘露糖蛋白、少量的几丁质和脂类组成,对维持细胞形态和细胞间识别具有重要作用[22]。这些物质能够提供大量的活性基团,且由这些基团产生的伸缩、弯曲和变形振动均可以在FTIR中产生明显的吸收峰[23]。在酵母菌的光谱图中,表征蛋白质最重要的谱带是酰胺带,其中位于1 650 cm-1处的酰胺I带是由C=O的伸缩振动、N—H的弯曲振动形成,它表明了酿酒酵母中蛋白质的二级结构以α-螺旋为主[24]。1 540 cm-1处的酰胺II带则是由N—H的弯曲振动和C—N的伸缩振动引起,1 452 cm-1处的特征峰是由于CH2的剪式振动、CH3的非对称弯曲振动引起[25]。位于1 240 cm-1处的酰胺III带可能是由C—N弯曲振动、—COOH中C—O的伸缩振动和P=O的变形振动导致,代表磷酸二酯键的不对称拉伸,与磷脂双分子层有关[26]。位于1 080 cm-1和915 cm-1左右的吸收峰分别代表酵母的RNA、DNA或细胞壁中存在的碳水化合物和多糖环键[27]。位于810 cm-1左右处的峰位是酿酒酵母表面醛糖酸的特征峰,位于540~580 cm-1处的峰位是的剪式振动产生[24]。位于3 418 cm-1左右的峰位是由于分子间、分子内氢键或者KBr吸收水产生的—OH振动,3 307 cm-1处吸收峰由于几丁质中的—OH和仲胺中的—NH的伸缩振动引起,而位于3 100~2 800 cm-1处的吸收峰由于脂肪酸中—CH基团的反对称振动引起,代表脂质官能团[28]。
图6 为甲酸处理前后的酵母细胞FTIR。蛋白质是构成细胞膜和细胞壁主要组成成分,在甲酸处理后发现酰胺I带的红移(1 651.3/1 650.3 cm-1)和酰胺II带的蓝移(1 542.9/1 545.4 cm-1),表明可能蛋白质肽链上O原子和N原子发生了变化,推测甲酸胁迫可能引起酵母细胞蛋白质变性。另外,酰胺III带(1 243.3/1 242.4 cm-1)、(1 081.5/1 080.7 cm-1)峰位均产生了红移,可能是甲酸处理后破坏细胞膜的磷脂双分子层,细胞膜的通透性发生了改变并释放了部分核酸和蛋白质,这与前面实验结果一致。在3 307、3 002.6 cm-1和2 928.6 cm-1处峰位明显增加,表明甲酸改变了细胞壁中几丁质的结构,且对酵母细胞膜的脂质产生了破坏。在914.2 cm-1处的峰位增强,表明甲酸改变了酿酒酵母表面的多糖羟基骨架,进而改变酵母细胞壁的结构。代表醛糖酸的特征峰在812.4 cm-1也发生了较大的变化,表明酵母细胞表面的物质可能发生了很大的化学变化[29]。因此可以看出甲酸通过改变蛋白质、多糖、脂质和几丁质的结构对酵母细胞壁和细胞膜进行破坏,从而导致了细胞的死亡。
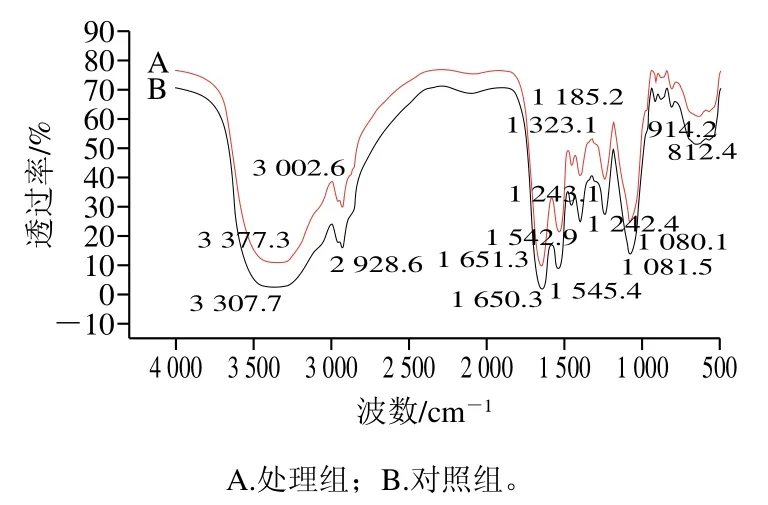
图6 甲酸处理前后FTIR图Fig. 6 Infrared spectra of yeast cells before and after formic acid treatment
2.7 甲酸对酵母细胞HK活力的影响
HK广泛存在于动物、植物、微生物和培养细胞中,是葡萄糖分解过程中的第一个关键酶,催化葡萄糖转化为6-磷酸葡萄糖,在真菌的糖代谢中发挥重要作用。由图7可知,经甲酸处理后,HK活力明显高于对照组(P<0.05),由(0.07±0.003)U/104cell上升到了(0.277±0.005)U/104cell(P<0.05),这表明甲酸处理后增加了酵母细胞内HK活力,加快了对葡萄糖的分解代谢,进而为酵母细胞抵抗甲酸的损伤提供了能量。
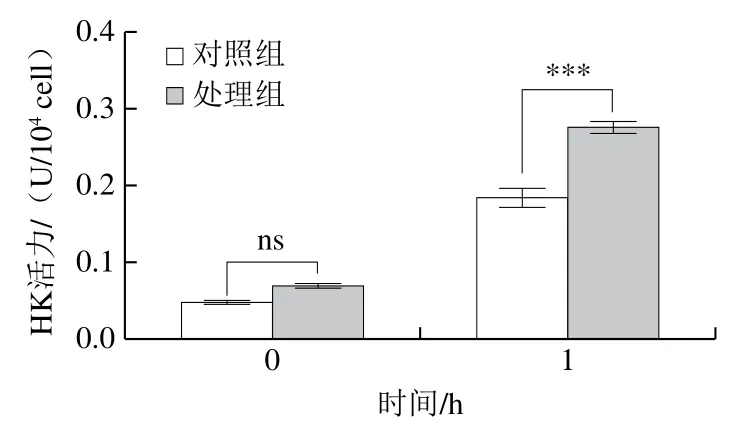
图7 甲酸对酵母细胞HK活力的影响Fig. 7 Effect of formic acid on hexokinase activity of yeast cells
3 讨 论
木质纤维素水解后会产生一些细胞抑制物,这些抑制物会对细胞的生长代谢造成一定毒害作用,从而降低后续乙醇发酵的产率[30-31]。甲酸是木质纤维素原料水解产生的毒害副产物之一,主要由糠醛和5-羟甲基糠醛产生[32],在木质纤维素乙醇发酵过程中对酵母细胞的生长和代谢都具有较强抑制作用[33]。本研究发现,添加1.8 g/L甲酸能够明显抑制酵母细胞的生长和乙醇发酵时间,可以破坏酵母的细胞壁,改变细胞膜的通透性,使得细胞内容物外漏,胞内MDA含量和HK活力显著上升(P<0.05),从而影响了酵母细胞正常生长,甚至导致其死亡。
有些外界因素能够破坏细胞膜的通透性,从而干扰细胞正常的物质运输[34]。本实验发现甲酸处理后的酵母细胞的蛋白质和核酸释放量明显增加(P<0.05),巩林林等[35]研究分析了有机溶剂乙腈对酵母菌细胞膜透性的影响,结果发现面包酵母经过20%经过20%乙腈处理后对细胞膜造成一定损伤,OD260nm值和OD280nm值均随时间的延长而增加;李永红等[36]通过对红酵母细胞通透性的研究,发现添加甲苯能提高红酵母细胞通透性。此外,周倩倩等[37]研究丁香酚对腐败希瓦氏菌和荧光假单胞菌的抑菌机制,结果也发现丁香酚处理后细胞膜遭到破坏,使细胞外OD280nm值和OD260nm值的水平上升。因此,推测甲酸处理后改变了酵母细胞膜通透性,细胞内物质流失,最终使酵母细胞无法正常进行生命活动而死亡。吴丽华等[38]研究发现,经0.4 mmol/L和0.6 mmol/L亚砷酸钠处理后,细胞膜脂质过氧化程度加剧,MDA含量在酿酒酵母细胞内显著提高。Ji Zhihua等[39]研究了不同浓度四氯双酚A诱导酵母细胞毒性,经5 μmol/L四氯双酚A处理后酵母细胞中MDA水平增加,促进了细胞膜的损伤和膜通透性的增强。本研究经甲酸处理后酵母细胞内MDA含量随着时间的延长逐渐增加,说明甲酸破坏了细胞膜,使得膜的通透性增大,脂质过氧化程度加剧,引起酵母细胞氧化损伤,进一步加速了细胞的死亡。侯颖等[40]通过研究发现经致死浓度聚赖氨酸处理后酵母细胞表面粗糙,出现明显凹陷和细微凸起,细胞膜造成严重损伤。薄涛等[41]研究发现当酿酒酵母经过500 μg/mLε-聚-L-赖氨酸处理后,与对照组相比细胞膜表面变的粗糙,出现明显孔洞等现象。在SEM观察下,经甲酸处理4 h后酵母细胞表面变得粗糙、边缘产生皱褶、部分细胞壁塌陷,且细胞与细胞之间彼此粘黏现象;因此,推测甲酸破坏了酵母细胞膜和细胞壁,以致细胞失去了保护而出现死亡。
FTIR是一种基于化合物中官能团和极性键振动的结构分析技术[42],其特点是操作简单、快速及灵敏度高[43],近年来已广泛应用于大分子化合物结构分析以及蛋白质的二级结构解析,是获取分子结构信息的有力工具[44]。本研究发现酿酒酵母经甲酸处理前后FTIR图部分峰发生了变化,结果表明与之相关的官能团包括氨基、羟基,而这些官能团主要存在于酿酒酵母细胞壁上的蛋白质和糖类物质,说明酵母细胞的结构进一步遭到破坏。HK作为糖酵解过程中第一个关键酶,其活性大小直接与胞内能量代谢快慢有关,在真菌的糖代谢中发挥重要作用[45]。本研究中,甲酸处理后酵母细胞内HK活性相比对照组提高到3.95 倍,由此说明甲酸胁迫在一定程度上加快了葡萄糖代谢,促进了ATP的合成,为酵母细胞抵抗甲酸损伤提供了充足的保障。
4 结 论
通过测定不同质量浓度甲酸对酿酒酵母生长代谢的影响,结果发现添加1.8 g/L甲酸能够明显抑制酵母细胞的生长,降低了乙醇产量,并且延长了葡萄糖消耗和酵母细胞乙醇发酵的周期;甲酸处理后改变了酵母细胞膜通透性,MDA含量增加,使得细胞内溶物发生泄露,最终导致酵母细胞的死亡。同时,酿酒酵母通过调节糖酵解中HK活力,为细胞提供充足的ATP抵抗胁迫;从甲酸处理前后的SEM图像可看出原来光滑的酵母菌体表面出现空洞、大量皱褶以及细胞之间彼此粘黏现象,而通过FTIR分析结果进一步发现甲酸可以改变蛋白质、糖类等分子成分的官能团结构,对酵母细胞的细胞壁和细胞膜进行破坏,使细胞失去了保护作用而死亡。本研究为提高酿酒酵母酸类物质耐受性的方法提供了理论依据。

