小鼠卵巢颗粒细胞氧化应激损伤及对沉默信息调节因子2相关酶1信号通路的影响
弓浩杰 丁雪梅 白世平 曾秋凤 张克英 王建萍
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,动物抗病营养与饲料农业农村部重点实验室,动物抗病营养四川省重点实验室,成都611130)
卵巢是雌性动物极其重要且独特的器官,卵巢的质量将决定动物的繁殖能力和生产性能。在卵泡发育成熟并排卵的过程中,绝大多数卵泡都会在发育过程中闭锁消失,而只有极少数卵泡能顺利发育至成熟排卵[1-3]。卵泡及其中的卵母细胞在发育过程中停止生长并逐渐退化、消失的现象称为卵泡闭锁。哺乳动物在出生前或刚出生时,卵巢内的卵原细胞发育成原始卵泡,在卵泡周围包围着一层扁平颗粒细胞[4],颗粒细胞紧密包裹在卵母细胞外,为卵母细胞发育提供营养和促成熟因子,对卵母细胞的发育和成熟至关重要。已有研究表明,颗粒细胞数量减少会导致卵母细胞凋亡,卵巢功能下降[5-6]。随着近年来对细胞凋亡的研究不断深入,发现颗粒细胞凋亡是导致卵泡闭锁的主要原因[7]。
引起卵泡闭锁的原因主要包括生理因素和环境因素,体内外的刺激会对卵泡的生长发育造成损伤,并且导致卵泡内微环境中活性氧(reactive oxygen species,ROS)自由基过量产生,打破氧化系统和抗氧化系统之间的平衡,造成氧化应激[8]。有大量文献报道,氧化应激能够诱导颗粒细胞凋亡导致卵泡闭锁[9-11]。李烈川等[12]研究发现,使用过氧化氢(H2O2)处理体外培养的猪卵巢颗粒细胞后,促凋亡基因的表达显著提高,细胞凋亡率显著提高。此外,申明[13]研究发现,H2O2处理的小鼠卵巢颗粒细胞(mouse ovarian granulosa cells,MOGC)凋亡率和ROS水平显著高于对照组,凋亡相关基因——肿瘤坏死因子相关凋亡诱导配体(TRAIL)、凋亡相关因子配体(FasL)和B细胞淋巴瘤2相互作用的细胞死亡中介物(Bim)mRNA的表达量显著提高。
沉默信息调节因子2相关酶1(SIRT1)是生命体中广泛存在的一类烟酰胺腺嘌呤二核苷酸(NAD+)依赖的进化上高度保守的去乙酰化酶,是感受机体氧化还原状态的关键蛋白之一。已有研究证实,SIRT1参与糖脂代谢、炎症、细胞衰老以及细胞凋亡等生理活动[14],是参与细胞氧化应激的关键信号分子[15]。近年来,有研究发现SIRT1在人卵巢颗粒细胞增殖和保持颗粒细胞稳态等调节卵巢功能方面发挥重要作用[16-17],并且有报道称SIRT1在卵巢组织中高度表达,SIRT1基因表达量提高会导致闭锁卵泡数量降低[18],但目前有关SIRT1在卵巢颗粒细胞氧化损伤中的相关研究较少,还有待进一步研究。
本试验通过使用H2O2处理MOGC,建立MOGC体外氧化应激模型,测定相关的氧化应激指标,并探究氧化应激对MOGC中SIRT1及其下游信号分子的影响,进一步完善卵泡闭锁的分子机理,为保护颗粒细胞免于氧化应激损伤、维持卵泡正常发育、提高母畜的繁殖能力和治疗人类生殖疾病提供新的研究依据和解决对策。
1 材料与方法
1.1 主要试剂和仪器
试验试剂:DMEM高糖培养基(Gibco)、澳洲胎牛血清(Gibco)、青-链霉素(Gibco)、胰蛋白酶(Gibco)、磷酸盐缓冲溶液(PBS,Gibco)、RIPA裂解液(碧云天)、二甲亚砜(DMSO,碧云天)、3% H2O2(Sigma)、膜联蛋白Ⅴ(Annexin Ⅴ,BD Pharmingen)、碘化嘧啶(PI,BD Pharmingen)、ROS荧光探针2′,7′-二氯荧光黄双乙酸盐(DCFH-DA,索莱宝)、Trizol(TaKaRa)、PrimeScript RT Reagent Kit试剂盒(TaKaRa)、SYBR®Premix Ex TaqTM试剂盒(TaKaRa)、二喹啉甲酸(BCA)蛋白浓度检测试剂(碧云天)、丙二醛(MDA)检测试剂盒(碧云天)、超氧化物歧化酶(SOD)检测试剂盒(碧云天)、铜锌超氧化物歧化酶(CuZn-SOD)检测试剂盒(碧云天)、过氧化氢酶(CAT)检测试剂盒(碧云天)、还原型谷胱甘肽(GSH)检测试剂盒(碧云天)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(碧云天)、总抗氧化能力(T-AOC)检测试剂盒(碧云天)以及8肽胆囊收缩素(CCK-8)检测试剂盒(碧云天)。
试验仪器:生物安全柜(Thermo1300Series)、倒置荧光显微镜(Nikon TS100)、二氧化碳培养箱(Thermo3111)、细胞破碎仪(Misonix S-400)、流式细胞仪(BD FACS-VerseTMFlow Cytometer 651154)、酶标仪(Spec-traMax M2)以及分光光度计(Nanadrop2000,Thermo)。
1.2 试验设计
MOGC系购自上海斯信生物科技有限公司,试验设置5个H2O2浓度梯度(0、100、200、400和800 μmol/L)和4个培养时间(4、12、24和48 h),共20个处理;测定细胞活力并观察细胞生长状态,以确定H2O2作用时间。采用单因素试验设计,设置5个H2O2浓度梯度(0、100、200、400和800 μmol/L),共5个处理,H2O2处理24 h(通过测定细胞活力确定)后测定细胞凋亡、细胞内ROS生成量、相关抗氧化酶活性和MDA含量以及凋亡相关基因表达,以确定H2O2最佳作用浓度,建立理想的MOGC氧化应激模型。
1.3 试验方法
1.3.1 细胞培养及传代
MOGC使用含有10%胎牛血清、1%青-链霉素的DMEM高糖培养基,置于37 ℃、5%CO2培养箱中培养。细胞传代时弃去旧的培养基,加入PBS清洗后将废液吸出,加入胰蛋白酶放入37 ℃培养箱消化5 min,在显微镜下观察到细胞形态变圆,并且很亮,加入培养基终止消化,用移液枪反复吹打,将细胞转移至新的培养皿中,补充培养基。
1.3.2 细胞活力的测定
采用倒置显微镜观察细胞形态,采用CCK-8法测定细胞活力。MOGC以1×104个/mL的密度接种于96孔板中。其中,0 μmol/L H2O2处理为对照组,100、200、400和800 μmol/L H2O2处理为试验组,将只填加完全培养基设为空白对照,每个孔作为1个重复,每个处理6个重复,至细胞生长至80%以上,吸出完全培养基,加入处理培养基。分别在4、8、12和24 h后吸去处理液,每孔加入10 μL CCK-8溶液,于37 ℃放置1 h,最后用酶标仪读取450 nm处吸光度值。
细胞活力(%)=100[(A处理-A空白)/
(A对照-A空白)]。
1.3.3 细胞凋亡的测定
MOGC以1×105个/mL的密度接种于12孔板中,每个孔作为1个重复,每个处理5个重复,至细胞生长至80%以上,吸出完全培养基,加入处理培养基。24 h后用胰蛋白酶于37 ℃消化4~5 min将细胞收集,将细胞转移至1.5 mL离心管中,1 000×g离心后得到细胞沉淀,加入PBS洗涤细胞,然后加入100 μL的1×Binding Buffer,加入5 μL异硫氰酸荧光素Annexin Ⅴ和5 μL PI室温避光孵育20 min加入400 μL 1×Binding Buffer,混匀,利用流式细胞仪测定细胞凋亡。
1.3.4 细胞内ROS生成量的测定
MOGC以1×105个/mL的密度接种于12孔板中,每个孔作为1个重复,每个处理4个重复,至细胞生长至80%以上,吸出完全培养基,加入处理培养基。24 h后用胰蛋白酶于37 ℃消化4~5 min将细胞收集,将细胞转移至1.5 mL离心管中,1 000×g离心后得到细胞沉淀,加入PBS洗涤细胞,然后配制好的DCFH-DA荧光探针重悬细胞,37 ℃孵育1 h然后1 000×g离心5 min,并用37 ℃预热的PBS洗涤1~2次,用PBS重悬细胞,利用流式细胞仪测定细胞内ROS的生成量。
1.3.5 抗氧化酶活性以及MDA含量的测定
MOGC以1×105个/mL的密度接种于12孔板中,每2孔作为1个重复,每个处理6个重复,至细胞生长至80%以上,吸出完全培养基,加入处理培养基。24 h后,利用细胞裂解液将细胞收集,收集的细胞通过细胞破碎仪破碎,得到待测样本。采用BCA蛋白浓度测定试剂盒测定每个样本的蛋白浓度。根据试剂盒说明书测得SOD、CuZn-SOD、CAT、GSH-Px活性和T-AOC以及GSH和MDA含量。
1.3.6 凋亡相关基因表达的测定
MOGC以1×105个/mL的密度接种于12孔板中,每2孔作为1个重复,每个处理6个重复,至细胞生长至80%以上,吸出完全培养基,加入处理培养基。24 h后每孔加入1 mL Trizol试剂提取总RNA,每个样品利用分光光度计测定RNA浓度以及A260/A280值,每个样品以600 ng的RNA为底物,利用PrimeScript RT Reagent Kit试剂盒反转录20 μL的cDNA,将cDNA和所测基因的上游引物和下游引物(表1)利用SYBR®Premix Ex TaqTM试剂盒说明书进行PCR反应。基因的相对表达量以β-肌动蛋白(β-actin)为内参,通过2-ΔΔCt方法计算。

表1 基因上游和下游引物序列
1.4 数据统计分析
通过SAS 9.2统计软件,采用ANOVA进行单因素方差分析,采用one-way Duncan氏法进行多重比较,用FlowJo v10软件进行细胞凋亡和ROS生成量的分析,用GraphPad Prism 6 作图,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 不同浓度H2O2作用不同时间后对细胞活力的影响
如图1-A所示,400和800 μmol/L H2O2处理24 h对细胞损伤较大,细胞形态发生改变,并且大部分细胞破碎物飘浮于培养基中;100和200 μmol/L处理24 h后,大部分细胞能维持正常的细胞形态并能贴壁生长,但仍能看到少量细胞破碎物漂浮于培养液中。如图1-B所示,通过H2O2作用不同的时间发现,与对照组相比,试验组细胞活力均显著降低(P<0.05)。100和200 μmol/L H2O2处理MOGC小于12 h时,细胞活力较高;而当H2O2浓度大于200 μmol/L并且作用时间超过12 h时,细胞活力低于50%;此外,当H2O2浓度大于200 μmol/L时会引起细胞活力急剧下降。
2.2 不同浓度H2O2对细胞凋亡的影响
如图2所示,利用Annexin V/PI双染色法,通过流式细胞仪测定不同浓度H2O2对细胞凋亡的影响,本试验发现细胞分为4个群:Q1为机械坏死细胞,Q2为晚期凋亡细胞,Q3为早期凋亡细胞,Q4为正常细胞。本试验结果表明,随着H2O2浓度的升高,正常细胞的数量显著减少(P<0.05),而凋亡细胞的数量显著增多(P<0.05),即细胞凋亡率显著提高(P<0.05)。
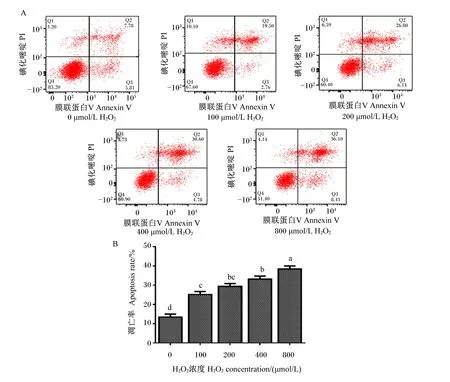
A:流式细胞仪测定不同浓度的H2O2作用24 h后细胞凋亡结果,Q1为机械坏死细胞,Q2为晚期凋亡细胞,Q3为早期凋亡细胞,Q4为正常细胞,凋亡细胞=Q2+Q3。B:不同浓度H2O2处理24 h后MOGC凋亡率。
2.3 不同浓度H2O2对细胞内ROS生成量的影响
如图3所示,利用荧光探针DCFH-DA进行ROS检测,DCFH-A本身没有荧光,但可以自由穿过细胞膜,被细胞内的酯酶水解成二氯二氢荧光素(DCFH),细胞内的ROS可以氧化无荧光的DCFH生成有荧光的二氯荧光素(DCF),然后使用流式细胞仪测定不同浓度H2O2对细胞内ROS生成量的影响。本试验结果表明,与对照组相比,200、400和800 μmol/L H2O2处理MOGC 24 h后,细胞内的ROS生成量显著提高(P<0.05);100 μmol/L H2O2组与对照组相比,虽然细胞内ROS生成量有所提高,但差异不显著(P>0.05)。
2.4 不同浓度H2O2对细胞中抗氧化酶活性以及MDA含量的影响
由表2可知,与对照组相比,400 μmol/L H2O2组细胞中SOD活性显著降低(P<0.05),200 μmol/L H2O2组细胞中SOD活性有降低的趋势(P>0.05),但各组细胞中Cu-ZnSOD活性无显著差异(P>0.05)。与对照组相比,100、200 μmol/L H2O2组细胞中CAT活性有降低的趋势,但差异不显著(P>0.05);400、800 μmol/L H2O2组细胞中CAT活性显著降低(P<0.05)。与对照组相比,200 μmol/L H2O2组细胞中GSH含量有降低的趋势,但差异不显著(P>0.05);400、800 μmol/L H2O2组细胞中GSH含量显著降低(P<0.05);200、400和800 μmol/L H2O2组细胞中GSH-Px活性显著降低(P<0.05)。此外,各组细胞中T-AOC无显著差异(P>0.05),但200、400和800 μmol/L H2O2组细胞中过氧化产物MDA含量与对照组相比显著提高(P<0.05)。
2.5 不同浓度H2O2对细胞中凋亡相关基因表达的影响
如图4所示,与对照组相比,800 μmol/L H2O2组细胞中Bim、Caspase-9 mRNA相对表达量显著提高(P<0.05);200 μmol/L H2O2组细胞中Caspase-3 mRNA相对表达量有提高的趋势(P>0.05),细胞中BcL-xLmRNA相对表达量有降低的趋势(P>0.05);而400、800 μmol/L H2O2组细胞中Caspase-3 mRNA相对表达量显著提高(P<0.05),细胞中BcL-xLmRNA相对表达量显著降低(P<0.05);100 μmol/L H2O2组细胞中与凋亡相关基因的mRNA相对表达量无显著差异(P>0.05)。此外,与对照组相比,200、400和800 μmol/L H2O2组细胞中SIRT1 mRNA相对表达量显著降低(P<0.05),而细胞中FoxO1、p53 mRNA相对表达量显著提高(P<0.05);100 μmol/L H2O2组细胞中SRIT1、FoxO1和p53 mRNA相对表达量与对照组相比无显著差异(P>0.05),这表明SIRT1-FoxO1/p53可能是H2O2诱导MOGC凋亡过程中一个关键的信号通路。
3 讨 论
3.1 MOGC氧化应激模型的建立
氧化应激是指机体在遭受各种有害刺激时,体内的活性分子如ROS自由基产生过多,氧化程度超出抗氧化物清除能力,氧化系统和抗氧化系统动态失衡的状态,其会导致氧化损伤,表现为多种组织渐进性损伤。研究发现,氧化应激导致雌性生殖系统中的卵巢颗粒细胞损伤甚至凋亡[19],导致卵巢功能异常,但具体机制尚不清楚。本试验使用H2O2处理MOGC,从而建立卵巢颗粒细胞氧化应激模型,并探究其可能的作用机制。
H2O2是ROS的一种重要形式,易于穿过质膜进入到细胞中,产生高反应活性的羟自由基,氧化细胞中的脂质、蛋白质和核酸[20-21],造成过氧化反应,诱导细胞氧化损伤。H2O2作为一种氧化剂,已被用于建立各种体外和体内细胞氧化应激模型[22-23]。因此,本试验也通过H2O2诱导MOGC氧化损伤,建立氧化应激模型。本试验结果表明,与对照组相比,不同浓度H2O2处理MOGC后,细胞活力显著降低,并且细胞形态发生明显改变;同时发现,H2O2处理MOGC时间超过24 h后,会对细胞产生严重损伤,处理时间在12 h以内,MOGC活力较高。建立MOGC氧化应激模型的前提是使细胞具有一定的活力,细胞活力过低表明受到氧化损伤严重无法治疗,细胞活力过高则表明没有造成氧化损伤,不利于试验的进行[24]。本试验发现,当H2O2浓度为400和800 μmol/L时,会引起MOGC活力急剧下降;并且发现400、800 μmol/L H2O2处理24 h后,细胞核明显缩小,染色质凝集呈颗粒团块状分布,大部分细胞破碎物漂浮于培养基中,说明对细胞造成了不可逆的氧化损伤。此外,100、200 μmol/L H2O2对MOGC也有一定的影响,处理24 h后发现大部分细胞能维持正常的细胞形态并能贴壁生长,细胞活力保持在50%左右,并且有部分细胞破碎物漂浮于培养液中。和斌等[25]研究表明,使用250 μmol/L H2O2处理12 h,人卵巢颗粒细胞的细胞活力下降至对照组的60%左右。Zhang等[26]在氧化应激诱导猪卵巢颗粒细胞的研究中选用200 μmol/L H2O2处理12 h建立氧化应激模型。本试验选择H2O2处理MOGC 24 h进行后续试验,确定H2O2对MOGC的作用浓度,建立MOGC理想的氧化应激模型。
3.2 不同浓度H2O2对细胞内ROS生成量的影响
近年来越来越多的研究证明,在动物繁殖过程中ROS起到了极其重要的作用[27-28]。本试验研究发现,随着H2O2浓度的提高,MOGC中ROS的生成量逐渐提高,100 μmol/L H2O2组细胞内ROS生成量与对照组相比差异不显著,而200、400和800 μmol/L H2O2组细胞内ROS生成量显著高于对照组。Shen等[9]的研究也发现了相同的结果,表明细胞中ROS生成量的提高呈现出H2O2剂量依赖效应。前人研究证明,ROS的积累导致卵巢功能损伤主要是由电子传递链中的复合物突变引起的[8],H2O2作为一种强氧化剂会改变电子传递链中的烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶活性,导致电子在传递过程中丢失,造成ROS生成过量[29]。当卵巢内ROS产生过量,机体自身因为无法清除掉多余的ROS,导致细胞内蛋白及DNA发生改变,细胞膜结构发生变化,引发细胞程序性死亡。
3.3 不同浓度H2O2对细胞中抗氧化酶活性以及MDA含量的影响
机体的抗氧化系统是自我防御系统之一,抗氧化酶活性可以表明机体的氧化应激状态。SOD是特异性清除超氧自由基的抗氧化酶类,CAT能清除细胞内的过氧化氢,GSH-Px是一种重要的过氧化物分解酶,能够有效阻止自由基的生成和脂质过氧化,由SOD、CAT和GSH-Px组成的酶促氧化系统可以及时修复受损细胞,保护其免受氧化应激损害,但严重的氧化应激会使抗氧化酶活性下降[30-31]。此外,产生过量的ROS会引发细胞生物膜发生脂质过氧化,而MDA是脂质过氧化反应的重要产物,能够产生毒性作用;GSH则作为GSH-Px的底物,也是衡量机体抗氧化能力的重要指标[32]。本试验结果表明,与对照组相比,400 μmol/L H2O2组细胞中SOD活性显著降低;200、400和800 μmol/L H2O2组细胞中GSH-Px活性显著降低,并且细胞中MDA含量显著提高;100 μmol/L H2O2组细胞中SOD、GSH-Px活性和MDA含量与对照组相比差异不显著;此外,400和800 μmol/L H2O2组细胞中CAT活性和GSH含量显著降低,100和200 μmol/L H2O2组细胞中CAT活性和GSH含量与对照组相比差异不显著。Deng等[33]研究发现,使用300 μmol/L H2O2处理雌性大鼠卵巢颗粒细胞后,H2O2组细胞中SOD、GSH-Px和CAT活性显著降低,并且细胞中MDA含量显著提高。本试验与前人研究结果相类似,表明H2O2能够有效诱导MOGC产生氧化应激损伤,导致抗氧化酶活性降低,过氧化产物MDA含量提高。
3.4 不同浓度H2O2对细胞凋亡及相关基因表达的影响
细胞凋亡是机体维持细胞数量稳态的重要机制。本试验研究发现,与对照组相比,不同浓度H2O2处理MOGC后细胞凋亡率显著提高;100、200和400 μmol/L H2O2处理24 h后,细胞凋亡率显著高于对照组,而800 μmol/L H2O2组细胞凋亡率较高,显著高于其他组,表明对细胞造成了严重的损伤。前人研究表明,H2O2处理细胞可发生凋亡现象,并且其凋亡程度随着H2O2浓度升高而加强[34],这与本研究结果相一致。细胞凋亡主要有2条途径:一是内在途径直接通过线粒体释放凋亡相关酶激活因子引起细胞内半胱氨酸天冬氨酸蛋白酶(Caspase)级联反应造成细胞凋亡;二是外在途径由胞外信号分子通过结合细胞膜表面的死亡受体激活细胞内Caspase级联反应引发细胞凋亡[35]。H2O2引起的MOGC的细胞凋亡可能与某种途径依赖的线粒体凋亡途径相关。
雌性动物卵巢中卵泡发生闭锁时,有大量的细胞内调控因子参与了卵巢颗粒细胞的凋亡,例如雌激素受体α和β、FasL、Caspase家族蛋白以及B细胞淋巴瘤-2(Bcl-2)家族蛋白等[36]。已有研究证实,人和鼠的卵巢颗粒细胞凋亡的主要形式是线粒体途径的细胞凋亡,线粒体途径的细胞凋亡是Bcl-2家族蛋白与Caspase家族蛋白共同作用的复杂过程[1,37-38]。本试验结果发现,400和800 μmol/L H2O2组MOGC中Caspase-3的mRNA相对表达量显著提高,Bcl-xL的mRNA相对表达量显著降低,并且800 μmol/L H2O2组MOGC中Bim、Caspase-9的mRNA相对表达量显著提高;200 μmol/L H2O2组MOGC中Bim、Caspase-3和Caspase-9的mRNA相对表达量与对照组相比有所上升,Bcl-xL的mRNA相对表达量与对照组相比有所下降,但差异不显著;此外,100 μmol/L H2O2组MOGC中Bim、Bcl-xL、Caspase-3和Caspase-9的mRNA相对表达量与对照组相比均无差异差异。Caspase家族蛋白引发的级联反应是细胞凋亡过程的中心环节,根据相关报道,在健康的卵泡中几乎检测不到Caspase家族相关基因的表达,而闭锁卵泡中凋亡的颗粒细胞内Caspase家族相关基因表达增加,并且表明Caspase-3和Caspase-9的表达增加是反映卵巢颗粒细胞凋亡和卵泡闭锁的标志物[39-41]。Bcl-2家族包括2大类型,即Bim所在的促凋亡亚家族和Bcl-xL所在的抗凋亡亚家族。已有研究发现,过表达Bcl-xL能够抑制H2O2诱导的人卵巢颗粒细胞凋亡[42];此外,在猪卵巢中发现闭锁卵泡中的Bim的表达水平显著高于健康卵泡[43]。表明Bcl-xL和Bim均在细胞凋亡中起到了关键作用。SIRT1可以通过对其底物分子的去乙酰化作用,参与多种细胞生理过程,有大量研究表明SIRT1参与调控细胞的氧化应激从而影响细胞的存活[44-45]。近年来的报道显示,FoxO1和p53信号通路是调控哺乳动物卵巢颗粒细胞凋亡的主要通路之一,并且二者均是SIRT1在细胞内的作用底物[9,46-47]。本试验结果表明,与对照组相比,200、400和800 μmol/L H2O2组MOGC中SIRT1 mRNA相对表达量显著降低,FoxO1、p53 mRNA相对表达量显著提高;而100 μmol/L H2O2组MOGC中SRIT1、FoxO1和p53 mRNA相对表达量与对照组相比无显著差异。FoxO1和p53表达增加,可以通过Caspase蛋白级联反应引发线粒体途径的卵巢颗粒细胞凋亡[38,48],而SIRT1可以通过去乙酰化作用调节FoxO1和p53信号通路,抑制FoxO1和p53的表达,降低细胞凋亡率[49]。有研究表明,SIRT1激活剂可通过SIRT1-FoxO1通路缓解氧化应激造成的肝脏损伤[50],也能抑制破骨细胞的形成、增加破骨细胞的凋亡[51]。由此说明,SIRT1及其下游信号通路参与了氧化应激诱导的细胞凋亡,但对颗粒细胞中SIRT1及其下游FoxO1和p53通路介导细胞凋亡的报道较少。通过本试验研究结果得知,氧化应激可能通过SIRT1-FoxO1/p53信号通路诱导MOGC凋亡。
4 结 论
① 与0 μmol/L H2O2处理相比,200 μmol/L H2O2处理MOGC 24 h后细胞活力显著降低,细胞凋亡率以及细胞内ROS生成量显著提高,相关抗氧化酶活性降低,氧化产物MDA含量显著增加,凋亡相关基因表达增加,因此确定了200 μmol/L H2O2处理24 h为MOGC氧化应激模型成功建立的方法。
② 与对照组相比,200、400和800 μmol/L H2O2组细胞中SIRT1 mRNA相对表达量显著降低,细胞中FoxO1、p53 mRNA相对表达量显著提高,说明SIRT1-FoxO1/p53是参与H2O2诱导MOGC氧化应激的关键信号通路,为进一步探究SIRT1调控MOGC氧化应激损伤的具体机制提供了思路。

