高脂饲粮对小鼠摄食节律与肝脏核心时钟蛋白表达的影响
罗 佳 闫 征 李胜涛 卢卓恒 章浩月 徐丽萍 王 欣
(宁波大学医学院,宁波315211)
代谢综合征(metabolic syndrome,MS),世界卫生组织将其定义为以腹型肥胖、胰岛素抵抗、高血压和高脂血症为特征的一种病理状态,患病率逐年增加,成为世界范围内不断升级的公共卫生问题[1]。肥胖是MS的主要组成成分和初始化因素,多种理论及研究对全球肥胖流行进行了解释和探索,最终将其原因归结于高脂肪和高能量密集饮食的供应和消耗[2]。昼夜节律是基因表达、代谢和行为的循环,由内部时钟因子产生,控制着能量消耗与多种代谢功能[3-4]。昼夜节律改变与MS形成密不可分。
昼夜节律振荡通常是由转录调控反馈环产生,该环包括Clock、Bmal1、Per、Cry等时钟基因[5]。饮食、自然光线和其他环境因素的日常节律变化决定了大多哺乳动物生物钟的节奏。Li等[6]研究发现,8周高脂饲粮(high-fat diet,HFD)饲养后,小鼠肝脏Clock、Bmal1、Per2、Cry2等核心时钟基因表达明显减弱,昼夜差削弱。Kohsaka等[7]报道,小鼠食用HFD 6周后,中枢下丘脑Clock、Bmal1、Per表达与节律振荡无明显变化,脂肪组织Clock表达明显下调,而其在肝脏组织只有较小变化。Yanagihara等[8]发现,小鼠饲养8周HFD诱导MS发生,但对脂肪与肝脏组织中时钟基因的节律表达仅仅只有微小的影响。
HFD对核心时钟蛋白表达的影响仍有争议,且现有研究多聚焦于核心时钟基因表达的差异。HFD常用于诱导MS、肥胖、脂肪肝等代谢性疾病,然而不同研究使用的饲粮脂肪含量有一定差异,诱导MS最佳脂肪含量不明。因此,本研究以饲喂不同脂肪含量饲粮的小鼠为试验对象,探究诱导MS的最佳饲粮脂肪含量,明确摄食节律和肝脏生物钟是否在HFD诱导MS等代谢性疾病过程中发挥重要作用,通过分析蛋白与基因表达去探究其中的分子机制,以期为探讨MS的发病机制提供有价值的探索方向。
1 材料与方法
1.1 试验方法
试验动物为来源于美国国立癌症研究院129/Sv遗传背景小鼠,饲养于宁波大学无特定病原体(SPF)动物实验中心,饲养环境温度24 ℃,相对湿度50%~70%,12 h明12 h暗昼夜循环,自由摄食与饮水,在正式试验前小鼠接受1周适应性饲养。所有处理均通过伦理学审批(动物伦理审批编号“202010257”),并按照宁波大学动物保护和使用委员会批准的方案进行。
为避免激素对研究结果的干扰,本研究采用健康雄性小鼠,并将其随机分为4组,即Con组、10%HFD组、45%HFD组和60%HFD组,每组5只。Con组小鼠饲喂脂肪含量为4%的普通饲粮,10%HFD组、45%HFD组和60%HFD组小鼠分别饲喂脂肪含量为10%、45%、60%的HFD,饲养3个月。每周测量并记录所有小鼠体重,试验结束前进行口服糖耐量试验(oral glucose tolerance test,OGTT),所有小鼠禁食12 h后测量空腹血糖浓度,然后按3 g/kg BW剂量给予单次口服葡萄糖,分别在30、60、120 min的时间点取尾静脉血15 μL,糖耐量试验结束3 d后,待小鼠恢复至正常的体征后脱颈处死。
为了进一步探索HFD与摄食节律之间的联系,将8周龄小鼠分为Con组与45%HFD组,每组5只。Con组小鼠饲喂普通饲粮,HFD组小鼠第1周饲喂普通饲粮,第2周和第3饲喂脂肪含量为45%的HFD,每周记录3 d夜昼摄食量,3周后脱颈处死。
1.2 试验材料
脂肪含量为4%的普通饲粮与脂肪含量为10%、45%、60%的HFD均由南通特洛菲饲料科技有限公司提供,其营养水平见表1。总胆固醇(TC)试剂盒(210111211)、甘油三酯(TG)试剂盒(201211202),宁波美康生物科技股份有限公司;苏木素(G1140)、伊红染液(G1100)、RIPA(R0010),上海索宝生物科技有限公司;BCA蛋白测定试剂盒(P0011)、5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液(P0015L),上海碧云天生物技术有限公司;CLOCK抗体(49586),美国SAB公司;BMAL1抗体(ab93806)、磷酸甘油醛脱氢酶(GAPDH)抗体(ab181602),美国Abcam公司;RNA-Solv Reagent(R6830-02),美国Omega Bio-Tek公司;反转录(RT)试剂盒(CW2569M)、定量PCR(qPCR)试剂盒(CW0957H),北京康为世纪生物科技有限公司。
试验仪器:血糖测试仪(Johnson,美国)、MagNA Lyser组织匀浆机与lightcycle 480 Ⅱ定量PCR仪(Roche,瑞士)、Muitiskan Go酶标仪(赛默飞,上海)、化学发光仪(勤翔,上海)、光学显微镜(Olympus,日本)、纯水机(利康,上海)。

表1 普通饲粮与高脂饲粮营养水平(饲喂基础)
1.3 标本采集及保存
将采集的小鼠血液置于1.5 mL含肝素离心管中,3 600 r/min离心20 min,取上清保存于-20 ℃备用。取小鼠肝脏,用生理盐水冲洗,吸干水分后称重。切取新鲜分离的1/2肝大叶,立即固定在10%福尔马林缓冲液(体积为肝组织的4~5倍)中,其余肝组织切成小块后在干冰中快速冷冻,然后保存在-80 ℃冰箱,以待分析。
1.4 生化分析和肝脏组织病理学分析
根据生化试剂盒的说明,采用终点法测定血清与肝脏中脂质代谢指标TC和TG的含量。切取2~3 mm固定在10%福尔马林缓冲液中肝组织,在70%、80%、90%和100%的酒精浓度中进行梯度脱水1 h,再使用二甲苯透明2次,每次15 min,浸蜡3次,每次1 h,石蜡包埋,制成4 μm切片,43 ℃摊片,37 ℃烤片过夜,待玻片恢复至室温后常规苏木素-伊红(HE)染色。染色后,用中性树脂封片,光学显微镜观察肝脏中病理形态学改变。
1.5 蛋白质免疫印记分析
称取20 mg肝脏组织,加入含有1%PMSF的高效RIPA进行裂解,组织匀浆机充分匀浆,样品在4 ℃以13 000 r/min的速度离心20 min,收集上清液,采用BCA蛋白测定试剂盒测定样品蛋白浓度,然后进行蛋白定量和归一,加入等量5×SDS-PAGE上样缓冲液后,金属浴8 min。制备10%十二烷基硫酸钠-聚丙烯酰胺凝胶,加蛋白样品,电泳2h至蛋白分离后转移到聚偏氟乙烯(PVDF)膜上1 h,然后用5%奶粉封闭PVDF膜3.5 h,使用TBST洗涤5 min,洗涤3次,对TBST洗涤好的PVDF膜在4 ℃一抗孵育过夜,隔日取出后,使用TBST洗涤10 min,洗涤3次,对TBST洗涤好的PVDF膜在室温二抗孵育2 h,再次TBST洗涤10 min,连续3次,将经过ECL化学发光液处理的膜在化学发光仪进行曝光,用Image J 1.8.0进行蛋白条带灰度分析。
1.6 qPCR检测时钟基因mRNA表达量
称取20 mg肝脏组织,加入200 μL RNA-Solv Reagent后进行匀浆,加入适量氯仿充分混匀后,样品在4 ℃以12 000 r/min的速度离心20 min,提取上清后加入等量异丙醇沉淀RNA,再加入焦碳酸二乙酯(DEPC)水配制的75%乙醇洗涤2次,最后加入DEPC水溶解RNA。采用Muitiskan Go酶标仪测定RNA浓度,用260与280 nm处吸光度的比值判断其纯度。取1 μg RNA,2 μL dNTP Mix,2 μL 5XRT Buffer,1 μL Primer Mix,1 μL DTT,无酶水补足至10 μL,50 ℃孵育45 min,85 ℃孵育5 min,将RNA逆转录为cDNA。取1 μL cDNA,2.2 μL 2×UltraSYBR Mixture,0.1 μL上游引物,0.1 μL下游引物,1.6 μL DEPC水,混合成5 μL的体系,上机反应程序按照罗氏试剂盒说明书进行变性、退火和延伸设置,引物序列见表2。以18S rRNA作为内参,采用2-△△Ct法定量目的基因mRNA的表达量,以对照组标化数据为1,去得到各HFD组目的基因的表达差异。

表2 本研究所采用的引物序列
1.7 统计分析
试验数据均以平均值±标准差表示,使用SPSS 17.0进行统计学分析。2组间比较使用t检验,多组比较采用单因素方差分析,组间多重比较采用Dunnett法。P<0.05认为差异显著具有统计学意义。
2 结果与分析
2.1 HFD脂肪含量与小鼠MS的关系
由图1可知,小鼠饲喂普通饲粮和含10%、45%、60%脂肪的HFD 3个月后,10%HFD组、45%HFD组和60%HFD组体重均大于Con组,且45%HFD组体重增长超过其他3组,10%HFD组、45%HFD组和60%HFD组小鼠的体重分别为(32.00±1.74) g、(39.82±3.75) g、(35.96±4.04) g,与试验前体重相比,45%HFD组、60%HFD组体重分别显著增长了92.09%(P<0.05)、74.31%(P<0.05),但对10%HFD组体重增长不显著(P>0.05),说明HFD会诱导小鼠出现体重增加甚至肥胖。

图A中数据点标注“*”表示与试验前相比差异显著(P<0.05)。图B中数据点标注“*”表示与Con组差异显著(P<0.05)。
OGTT结果显示,Con组和10%HFD组在4个不同的时间点(0、30、60、120 min)血糖浓度变化趋势是一致的,说明10%HFD组小鼠糖耐量结果呈阴性;45%HFD组和60%HFD组小鼠在30、60 min时血糖浓度均显著高于Con组(P<0.05),在30 min时2组升高幅度分别是Con组的1.25、1.31倍(P<0.05),在60 min时2组升高幅度分别是Con组的1.43、1.41倍;120 min时,各组血糖浓度均下降,45%HFD组小鼠下降到Con组水平,而60%HFD组小鼠仍高于Con组,说明HFD会诱导小鼠出现糖耐量异常。
由图2可知,给予不同脂肪含量饲粮后,血清TG含量各组间均无显著差异(P>0.05)。与Con组相比,45%HFD组和60%HFD组血清TC含量分别显著升高了93.32%(P<0.05)、72.69%(P<0.05)。与血清TC含量相似,45%HFD组和60%HFD组肝脏TC与TG含量均较Con组显著升高(P<0.05)。
以上试验结果说明HFD会诱导MS发生,但不会随着饲粮中脂肪含量增加而呈正相关增加,45%HFD组小鼠MS紊乱严重于60%HFD组,可能与60%HFD组饲粮过于油腻,导致小鼠实际消耗量减少有关,也可能与多因素影响下的肝脏脂质代谢稳态破坏有关。

数据柱标注“*”表示与Con组差异显著(P<0.05)。下图同。
2.2 小鼠肝脏组织形态
由图3可知,在光学显微镜下,Con组的肝组织结构完整,肝小叶结构正常,肝细胞排列成肝索,在中央静脉周围呈放射状分布,细胞质均匀,无脂肪变性。10%HFD组的肝组织结构无明显异常,与Con组无明显差异。45%HFD组的肝组织结构完好,可见肝小叶,但是细胞核被挤压到一侧,出现明显空泡,发生脂肪变性。60%HFD组仍可见部分空泡,数量上较45%HFD组明显减少。病理切片图显示45%和60%HFD诱导小鼠出现肝脏脂肪变性,而前者作用更强。

图3 肝脏切片HE染色图像
2.3 HFD改变了小鼠摄食节律
CLOCK与BMAL1是调控节律的2个核心时钟蛋白,如图4所示,蛋白质免疫印迹试验结果显示,与Con组相比,10%HFD组、45%HFD组和60%HFD组小鼠肝脏中CLOCK蛋白表达量明显减弱,而BMAL1蛋白表达量无明显差异。qPCR结果显示各组小鼠肝脏中Clock、Bmal1 mRNA表达量无显著差异(P>0.05)。上述结果说明HFD引起小鼠肝脏节律改变是通过蛋白水平,而非基因水平。

图4 各组小鼠肝脏中核心时钟蛋白和基因表达变化
由于45%HFD组MS与脂肪肝最严重,故再次设计试验比较Con组与45%HFD组昼夜节律变化。如图5所示,波峰、波谷分别是小鼠夜晚、白天的摄食节律,波峰、波谷的差异体现了小鼠昼夜节律的差异。当2组小鼠给予普通饲粮时,基线水平的节律振幅没有明显的差异。45%HFD组给予45%HFD 1周后,白天与夜晚节律振幅波动减弱,夜间节律振幅减弱较明显;给予45%HFD 2周后,这种昼夜节律振幅减弱更加明显。给予45%HFD 1和2周后,夜/昼摄食量均显著降低(P<0.05)。从摄食行为上可见,在45%HFD的干预下,小鼠日间摄食量显著增加,而夜间摄食量显著减少,HFD抑制了小鼠昼夜摄食节律。

图5 HFD对小鼠摄食节律的影响
如图6所示,给予45%HFD后,肝脏中CLOCK的蛋白表达量明显减弱,而BMAL1的蛋白表达量没有明显变化。灰度分析显示45%HFD组肝脏中CLOCK的蛋白表达量较对照组显著降低(P<0.05),BMAL1的蛋白表达量在2组之间无显著差异(P>0.05)。qPCR结果显示HFD对肝脏中Clock、Bmal1 mRNA表达量无显著影响(P>0.05)。
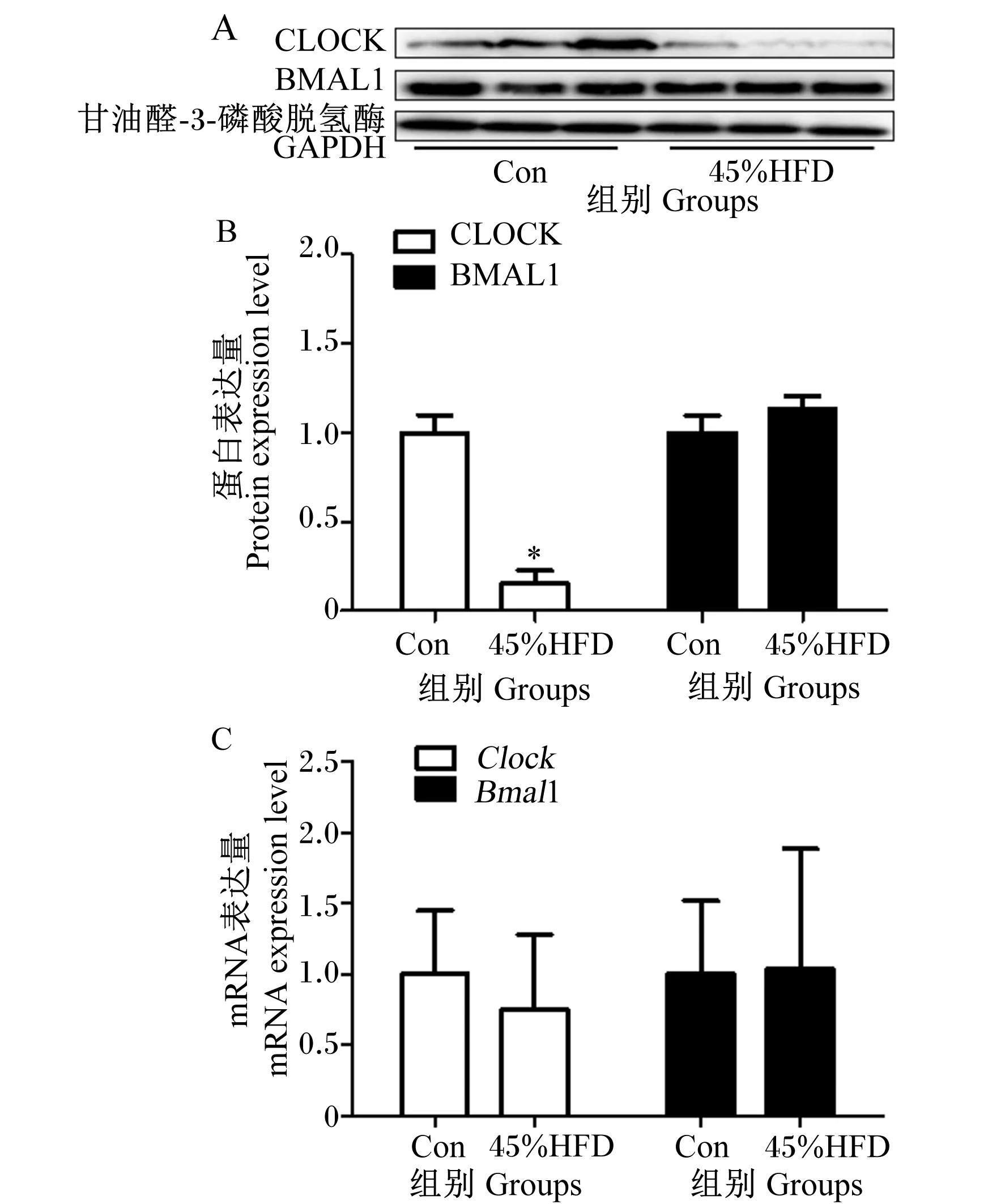
图6 HFD对小鼠肝脏核心时钟蛋白与基因表达的影响
3 讨 论
3.1 45%HFD诱导MS的作用最强
肥胖是以体脂肪沉积为特征,主要由能量摄入与消耗不平衡造成,尤其当摄入HFD时易发生肥胖[9]。建立MS、脂肪肝等模型通常使用HFD诱导,而不同的试验研究使用的饲粮脂肪含量有一定差异,文献报道啮齿类动物给予含22.5%脂肪的饲粮饲养20周、含45%脂肪的饲粮饲养10周、含60%脂肪的饲粮饲养12周均可诱导MS的发生[10-12]。但未有试验探讨不同脂肪含量饮食诱导的MS之间的差异,本试验发现45%和60%HFD皆诱导小鼠出现MS,然而其并不与饲粮中脂肪含量的增加持续正相关,其中45%HFD组小鼠体重增加最快,且出现糖耐量异常,血脂、肝脂含量均升高,特别是病理切片可见明显肝脏脂肪变性。而60%HFD组小鼠也出现上述症状与体征,但病理切片中气球样变和脂肪变性较少,可能是由于脂肪含量增加使得饲粮口味过于油腻,小鼠摄食量减少造成的。
3.2 HFD改变摄食节律
进食/禁食周期循环是外周组织中时钟的主要时间线,HFD通过削弱进食/禁食周期,对啮齿类动物的昼夜节律系统组织产生有害的影响,而外周组织时钟,如肝脏时钟,对食物的成分非常敏感[13]。高热量高脂饮食会引起行为和分子昼夜节律的改变,由此改变肝脏的能量利用和代谢[14-15]。正常居民从低脂饮食转换到高脂饮食1周后Bmal1节律振荡减缓并延迟,Cry1与Cry2节律振荡提前,转换高脂饮食5周后,节律改变更加显著[16]。本试验发现采用HFD饲喂的小鼠仍表现出了整体的昼夜节律,但这种节律却在减弱,HFD抑制摄食节律行为,使白天摄食增加而夜间摄食减少,这与前人研究结果[7]一致。
3.3 HFD下调肝脏核心时钟蛋白表达
核心时钟基因产物Clock/Bmal1异二聚体作为转录因子参与肝脏代谢的调控[17]。全身敲除Clock,小鼠更容易发生肝脏脂肪变性、高脂血症等代谢性疾病[18]。Bmal1敲除后,即使在正常饮食下,小鼠也发生脂肪肝、糖耐量损害等[19]。本试验发现,HFD对肝脏核心时钟基因Clock、Bmal1的表达无显著影响,与前人研究结果[8]一致;HFD对BMAL1蛋白的表达几乎没有作用,可能是因为BMAL1不是所有分子振荡都必须的,特别是在整个基因组或蛋白质组水平上[20];HFD使CLOCK蛋白的表达量显著下降,推测HFD通过改变摄食行为与时钟因子节律而诱导MS发生,时钟因子节律的改变可能是通过下调肝脏CLOCK蛋白的表达,而非基因转录调控,具体的调控机制还需要进一步探究与验证。
4 结 论
综上可知,脂肪含量为45%的HFD诱导小鼠MS和肝脏脂肪变性的作用最强,并与肝脏CLOCK蛋白表达量下降密切相关。HFD抑制小鼠摄食节律,其机制可能与肝脏核心时钟蛋白CLOCK表达的下调有关,而与基因转录调控关系不大。

