靶向cofilin2基因RNAi对鸭病毒性肠炎病毒增殖的影响
王 微,华 敏,张 芸,李 涛,张黔东,袁 阳,程振涛,4,文 明,4*
(1.贵州大学动物科学学院,贵阳 550025;2.贵州省畜禽遗传资源管理站,贵阳550025;3.贵州省动物预防控制中心,贵阳550025;4.贵州省动物生物制品工程技术研究中心,贵阳 550025)
鸭瘟病毒(duck plague virus,DPV)又称为鸭病毒性肠炎病毒(duck enteritis virus,DEV),属疱疹病毒科成员。DEV传播速度快且病死率较高,常引起鸭、鹅等禽类发生急性、败血性、高度接触性传染病,造成了养殖户严重的经济损失。病禽往往表现为精神不振,绿色稀粪,头部肿胀,两脚麻痹不能站立;其病变特征为组织、消化道出血坏死,血管损伤,淋巴器官特异性病变和实质性脏器退行性病变。
丝切蛋白(cofilin)是肌动蛋白解聚因子(actin depolymerizing factor,ADF)/cofilin家族的一员,在哺乳动物神经元中主要通过切断或稳定肌动蛋白丝以影响肌动蛋白组装的动力学[1]。病原微生物进入宿主细胞并在细胞内转运需要肌动蛋白细胞骨架,cofilin与细胞骨架的正常结构、动力学和功能有关,因此对病原微生物进入宿主细胞有着重要的影响[2-3]。cofilin蛋白有2种:cofilin1和cofilin2[4]。cofilin1在细胞迁移、增殖和噬菌体形成中起作用;cofilin1以及cofilin2在病毒复制过程中表达方式不同[5-7]。cofilin2主要是在真核细胞中表达,它结合并解聚肌动蛋白丝来对细胞的生理功能进行调节,其在细胞中的活性受磷酸化、去磷酸化和pH的调节[8]。cofilin2在肌肉发育和功能作用尚不清楚,但可能参与了肌纤维发生过程中肌动蛋白组装的调节和成熟肌肉中的肌动蛋白动力学[9]。RNA干扰(RNA interference,RNAi)是由正义RNA和反义RNA组成高度保守的小型双链RNA(double-stranded RNA,dsRNA)导入细胞中诱发的基因沉默现象,dsRNA分为miRNA(micro RNA),siRNA(small interfering RNA,siRNA)和shRNA(short hairpin RNA,shRNA)[10-11]。shRNA是一种具有发夹环的人工RNA分子,可克隆成表达载体,在宿主细胞中RNA聚合酶作用下导致较长时间的基因沉默[12-14]。此外,由于它们发夹结构有稳定基因表达的潜力,它们有利于体内研究,是一种实用工具[15-16]。尽管近年来对DEV的研究进展为病毒发病的基本机制提供了新的认识,但有关RNAi 干扰cofilin2基因对DEV增殖的影响研究鲜有报道。研究cofilin2基因对DEV在宿主细胞内增殖过程的影响,对DEV的研究致病机理以及疾病防控具有重要意义。
1 材料与方法
1.1 材料
1.1.1 毒株、载体及细胞 DEV-GZ株及DEF由本实验室提供;pGPH1/GFP/Neo表达载体及shRNA质粒购自吉玛生物有限公司;感受态细胞大肠杆菌DH5α菌株购自天根生化科技有限公司。
1.1.2 主要试剂 Lipofectamine® 3000购自Invitrogen公司;胰蛋白酶及DMEM购自Nalgen公司;FBS购自赛默飞世尔科技公司;Prime ScriptTMRT Master Mix、SYBR® Premix Ex TaqTMⅡ购自TaKaRa公司;UNIQ-10无内毒素质粒DNA小量提取试剂盒购自OMEGA公司,其他试验所需试剂均为国产分析纯。
1.2 方法
1.2.1 shRNA干扰载体序列设计 通过Ambion在线软件设计筛选鸭源cofilin2全基因序列(MF434775)中4条特异性shRNA序列,并加入5′-TTCAAGAGA-3′序列形成发夹结构。4条shRNA序列中靶序列起始位置分别为460~480、313~333、256~276、95~115,根据靶序列起始位置不同将shRNA干扰载体分别命名为cofilin2-451、cofilin2-304、cofilin2-247、cofilin2-86;设计1条阴性对照并命名为shRNA-NC,靶序列及shRNA序列详见表1。

表1 cofilin2基因shRNA序列
1.2.2 shRNA干扰载体构建 oligo混合物制备(正义链、反义链各5 μL,10×oligo annealing buffer 2 μL,ddH2O补足20 μL);将制备好的oligo混合物95 ℃加热5 min,冷却放置一段时间使其形成DNA双链并稀释至10 nmol·L-1待用。分别按照5×ligation buffer 4 μL、ds oligo 4 μL、pGPH1/GFP/Neo 2 μL、T4 DNA ligase(1 U·μL-1)1 U的顺序逐步加入,ddH2O补足20 μL;室温条件下放置30 min(使质粒能够充分转化到DH5α感受态细胞中)。将制备好的shRNA载体涂布于含有奇霉素的LB固体培养基中,37 ℃恒温培养24 h以筛选出转化成功的DH5α感受态细胞,挑取平板上的单个菌落于LB肉汤中,180 r·min-137 ℃恒温摇床中增菌12 h后,离心收集菌体。提取质粒中的DNA送生工生物工程(上海)公司测序,分析shRNA干扰载体是否构建成功。
1.2.3 细胞培养与转染 DEF制备:受精鸭蛋孵化至10日龄,取胚体的躯干剪碎加入胰蛋白酶吹打离心,弃掉上清,转入3 mL DMEM培养基中吹打,用过滤器过滤并收集细胞液,转入含双抗+10% FBS的生长培养基中,放入5%CO2培养箱中37 ℃培养至细胞长满瓶底。shRNA及Lipofectamin® 3000(1∶1)各125 μL混匀,室温放置5 min后,缓慢将Lipofectamine® 3000-shRNA复合物加入到已经转入生长良好的DEF六孔板中,将六孔板放置于5%CO2培养箱37 ℃孵育。
1.2.4 shRNA干扰载体的筛选 将cofilin2-451、cofilin2-304、cofilin2-247、cofilin2-86及shRNA-NC 5个干扰载体,按“1.2.3”方法转染到DEF中。经转染24 h后放置于荧光显微镜上观察重组质粒中GFP基因是否出现绿色荧光蛋白表达。确定细胞生长良好及GFP正常表达后,经荧光定量PCR检测4对shRNA干扰效果并进行shRNA的筛选,FQ-PCR反应体系: SYBR premix Ex Taq Ⅱ(Til RNaseH Plus)(2×)5.0 μL,PCR 上、下游引物各0.5 μL, DNA模板1.0 μL, 加ddH2O至10 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s、55 ℃退火30 s,共循环40次;在退火时采集5 s荧光,采集熔解曲线,温度范围为60~95 ℃,温度台阶为0.5 ℃。
2 结 果
2.1 重组质粒shRNA的构建
靶向设计shRNA序列插入到载体中,通过Sanger测序比对结果显示,由于shRNA序列中靶序列起始位置不同,分别将shRNA干扰载体命名为cofilin2-451、cofilin2-304、cofilin2-247、cofilin2-86,测序结果见表2,shRNA干扰质粒构建成功。

表2 shRNA质粒测序
2.2 shRNA序列筛选
应用EXCEL软件对shRNA序列筛选。
2.2.1 shRNA干扰质粒筛选荧光表达结果 转染24 h于普通显微镜观察shRNA干扰质粒,其在DEF中生长良好;经24 h培养后重组质粒载体中GFP基因显示绿色荧光蛋白荧光(图1),DMEM中未见绿色荧光蛋白荧光,说明DMEM不表达,重组质粒中GFP基因表达转染重组质粒成功。

A.转染shRNA质粒DEF生长情况图;B.转染24 h后shRNA质粒荧光图
2.2.2 shRNA筛选FQ-PCRcofilin2核酸含量检测结果 通过FQ-PCR检测筛选mRNA水平shRNA的干扰效果,转染重组质粒cofilin2-451、cofilin2-304、cofilin2-247、cofilin2-86后DEF中cofilin2转录量,均显著低于对照组(P<0.05),沉默效率分别为4.96%±0.78%、41.12%±2.94%、17.55%±2.07%、54.02%±1.73%;而阴性对照为4.52%±0.99%,试验结果发现cofilin2-86干扰组中干扰效果最好,选择其作为后续试验使用,shRNA筛选FQ-PCR检测结果见图2。
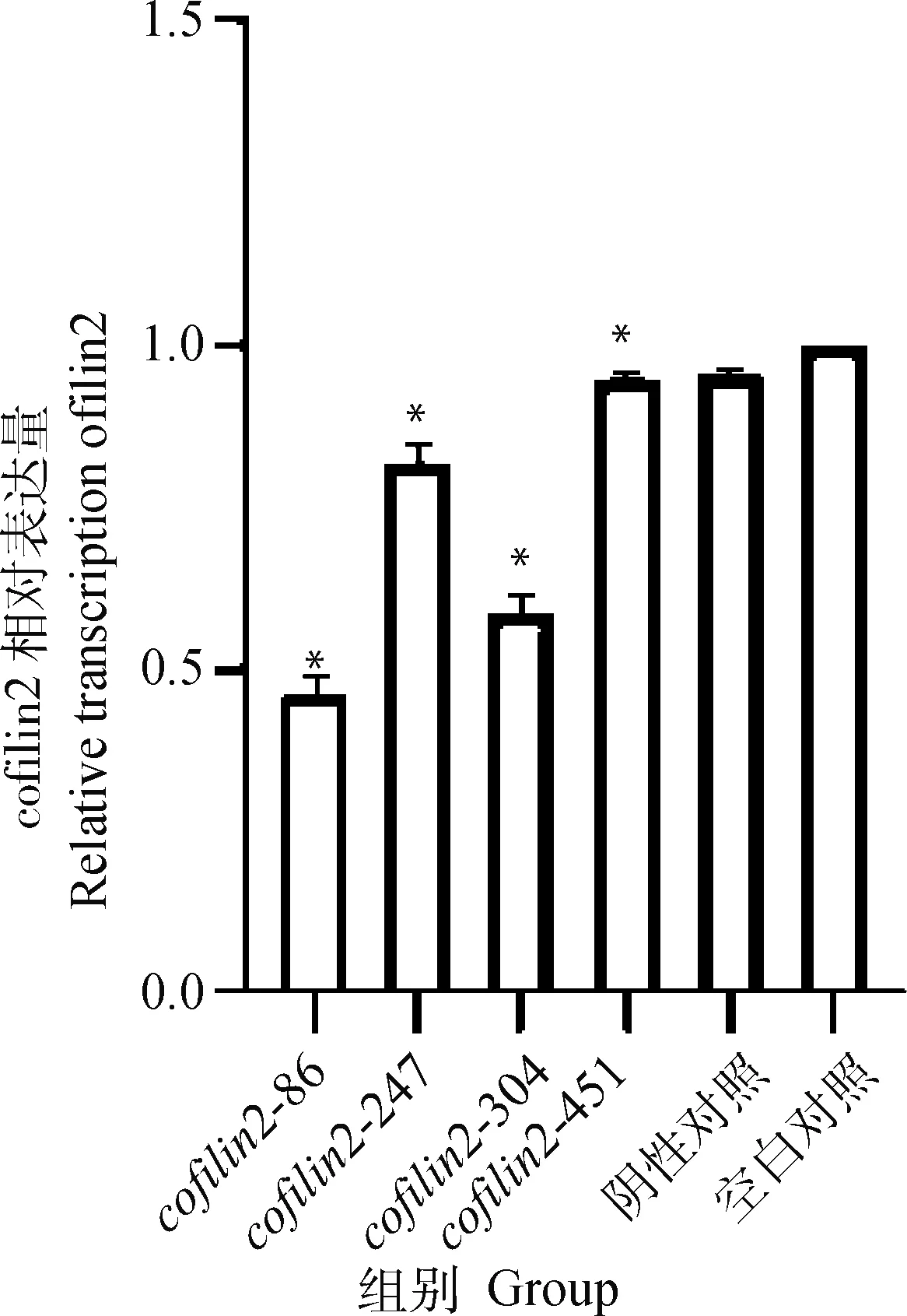
*.P<0.05
2.3 cofilin2-86干扰下DEV增殖动态
六孔板中转染cofilin2-86的DEF生长至适宜密度时,于48、72、96、120 h 4个时间段收集细胞,cofilin2-86在转染后4个时间段的干扰效率分别为50.42%±2.02%、56.24%±1.94%、55.34%±0.98%、42.59%±4.32%(图3)。通过FQ-PCR检测DEV-GZ株处理DEF后不同时间段收集的细胞液中DEV核酸表达量,cofilin2 shRNA+DEV试验组显著低于DMEM+DEV组(P<0.05)(图4)。DMEM+DEV组中DEV核酸量随着时间增加而增加,DMEM中的DEV未见表达,cofilin2 shRNA+DEV组中DEV随时间增加而增加,但明显低于与DMEM+DEV中的DEV核酸量,说明沉默cofilin2导致DEV核酸复制被抑制,cofilin2可能促进DEV的复制,这与Li等[17]研究的cofilin2具有免疫性和促进细胞增殖作用相一致。

图3 cofilin2-86转染不同时间的表达情况
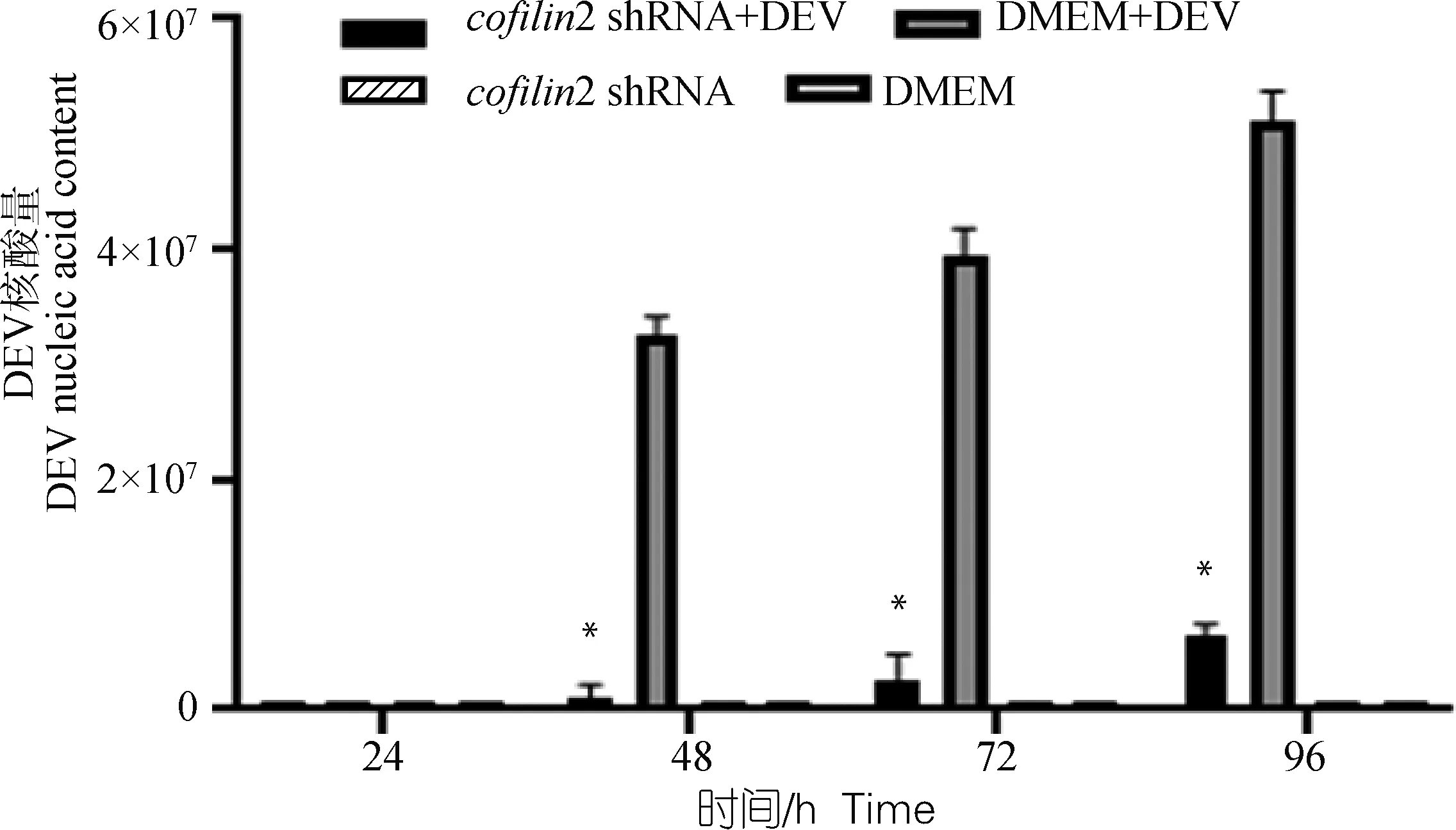
与DMEM+DEV组相比,*.P<0.05
3 讨 论
在任何生物调节过程中,转录调控都是至关重要的部分,RNAi技术能够广泛应用于传染性、肿瘤性疾病治疗,是因为能克隆到shRNA表达载体中以稳定靶基因和干扰目的基因表达。RNAi的作用机制是通过在细胞内导入dsRNA,dsRNA能够特异性地与细胞内互补的mRNA结合使其降解,以阻止mRNA编码蛋白质,从而使细胞中目的基因的表达量减少[18-20]。大多数无法转染的细胞、腺病毒和逆转录病毒,可利用RNAi中短发卡结构的shRNA克隆到载体再进行转染[21]。复制腺病毒作为shRNA的传递载体可增强抗肿瘤效果[22]。RNAi技术面临的主要问题就是脱靶效应,通过设计无法进行化学修饰表达的shRNA可有效降低脱靶效应发生[23-24]。shRNA主要存在的问题是转染效率,由于不完全的转染产生不完整的mRNA,可能影响了蛋白的功能[25]。研究运用RNAi技术针对cofilin2设计的4段shRNA片段进行细胞转染,以期筛选稳定沉默cofilin2基因的靶序列。结合转染干扰质粒结果,在今后的DEV研究中,采用干扰效率高且稳定性好的cofilin2-86质粒作为载体更合理。
cofilin2的缺乏可能导致肌动蛋白表达降低,也可以改变细胞功能,在细胞内积累导致肿瘤发生[26]。已被证明与肌动蛋白和肌球蛋白相互作用,这可能与cofilin2在调节细胞周期调节和凋亡中有丝分裂纺锤体形成过程有关[27]。Yu等[28]研究利用cofilin2-shRAN干扰载体转染到移植肿瘤的裸鼠模型中可有效表达,cofilin2基因沉默抑制了肿瘤生长,表明cofilin2可作为鼻咽癌的潜在治疗靶点。Gao等[29]研究在肿瘤腺病毒中shRNA与黏附斑激酶(focal adhesion kinase,FAK)结合形成FAK-shRNA复合物,转染细胞后显著抑制了FAK的表达,并有效抑制了肝癌细胞的生长且对正常细胞无影响。证明RNAi在疾病治疗中对癌症和病毒感染效果显著,研究cofilin2对探究病毒复制具有重要的意义。本研究将cofilin2-86作为载体转染到DEF中,DEV病毒核酸量随着时间的推移持续增长,cofilin2基因对DEV的增殖有促进作用,同时,也存在其他基因影响DEV增殖还有待研究。Zhao等[30]研究利用鸭乙型肝炎病毒感染原发性鸭肝细胞蛋白组分析中,在感染细胞过程中存在75个不同蛋白表达靶点,其中,β-actin和膜联蛋白A2的差异表达,这些蛋白表达差异在病毒感染中存在潜在作用,同样在DEV复制增殖过程中存在的其他蛋白表达靶点具有重要的研究意义。
4 结 论
通过将沉默cofilin2转染到DEF中,cofilin2-86在转染后4个时间段中最佳干扰效率为56.24%±1.94%,利用干扰效率最佳的cofilin2-86转染到DEF中,在不同时间DEV处理DEF下,DEV核酸量较转染对照组中的DEV核酸量总体下降,推测cofilin2基因对DEV的增殖存在促进作用,该结果为今后cofilin2对DEV动态转录研究奠定了基础。

