斯氏艾美耳球虫重组表面抗原SAG13和SAG14对兔的免疫保护效果初步观察
罗跃军,任永军,白 鑫,陈 浩,蒲家艳,郑若愚,肖 洁,杨光友*
(1.四川农业大学动物医学院,成都 611130;2.四川省畜牧科学研究院,成都 610066;3.动物遗传育种四川省重点实验室,成都 610066)
斯氏艾美耳球虫(Eimeriastiedae)是危害家兔的优势虫种之一,主要危害断奶后至3月龄的幼兔,常引起严重的肝病变和功能障碍,甚至造成死亡,给养兔业造成重大的经济损失[1-4]。目前,兔球虫病的防治主要依赖抗球虫药物,但球虫耐药性、药物在兔产品中的残留以及药物的环境污染等问题日趋严重,因此迫切需要开展防控技术研究。
兔球虫疫苗研究主要集中在活虫苗,尤其是早熟弱毒苗上,已成功选育多种兔球虫的早熟株,在此基础上开展了多种早熟株混合免疫的研究[5-8],但目前尚无商业化生产的兔球虫疫苗。相比于活虫苗,基因重组亚单位疫苗具有安全稳定、易于大规模生产及成本相对较低等优势。球虫生活史复杂,不同发育阶段抗原构成和分布不一致,其内生发育早期比后期有性繁殖阶段具有更强的免疫原性[9-12]。艾美耳球虫表面抗原家族(surface antigens,SAGs)位于侵袭期虫体表面,结构特点明显且家族庞大。在鸡球虫基因重组亚单位疫苗的研究中,原核表达的艾美耳球虫SAGs能够有效减轻肠道病变,降低体重损失,显示出一定的免疫保护效果[13-15]。
本研究通过结合斯氏艾美耳球虫表面抗原SAGs不同发育阶段转录水平和生物信息学分析,筛选出裂殖生殖阶段特异性表达的SAGs,然后进行原核表达,并研究重组蛋白的免疫保护效果,为兔斯氏艾美耳球虫基因重组亚单位疫苗的研制提供参考。
1 材料与方法
1.1 试验动物与虫株
4只2月龄及40只45日龄无球虫新西兰幼兔由四川农业大学动物寄生虫病研究中心繁殖提供。兔笼、食具等经烘烤,饲料经高温干燥,饮水中加入抗球虫药。未添加抗球虫药的饲料委托某兔料厂专门生产提供,人工感染前3 d开始使用。
试验所用虫株为斯氏艾美耳球虫四川分离株,由四川农业大学动物寄生虫病研究中心保存。
1.2 主要试剂与仪器
RNA抽提试剂盒、反转录试剂盒、荧光定量PCR预混液、限制性内切酶(BamHⅠ 和EcoRⅠ)、T4 DNA连接酶购自宝生物工程(大连)有限公司;2×Taq PCR Master Mix、普通琼脂糖凝胶DNA回收试剂盒、pMD19-T Vector、质粒小提试剂盒、增强型HRP-DAB底物显色试剂盒、DH5α感受态细胞、BL21(DE3)感受态细胞均购自天根生化科技(北京)有限公司;HRP标记羊抗兔IgG抗体购自武汉博士德生物工程有限公司;原核表达载体pET32a(+)购自Invitrogen公司;Quil A(皂素)购自 Sigma 公司;引物合成和菌液测序由上海生工生物工程有限公司进行。
PCR仪:Mastercycler Gradient,eppendorf,美国;荧光定量PCR仪:LightCycler® 96,Roche,瑞士;中高压层析系统:NGCTM10,Bio-Rad,美国;McMaster计数板,某日本株式会社。
1.3 主要生物信息学数据库
NCBI(GenBank)数据库:http://www.ncbi.nlm.nih.gov/;信号肽及跨膜区预测:http://www.cbs.dtu.dk/Services;GPI锚定位点预测:http://gpcr.biocomp.unibo.it/predgpi/;B细胞线性表位预测:http://tools.immuneepitope.org/bcell/。
1.4 斯氏艾美耳球虫SAGs生物信息学分析及不同发育阶段转录水平分析
1.4.1 斯氏艾美耳球虫SAGs生物信息学分析 利用BLAST检测和转录组数据鉴定出斯氏艾美耳球虫的SAG基因序列共计8条。利用生物信息学软件对Es-SAGs氨基酸序列进行分析,用TMHMM-2.0预测是否含有跨膜区,SignalP预测是否含有信号肽,PredGPI预测是否含GPI锚定位点,IEDB预测B细胞抗原表位。
1.4.2 斯氏艾美耳球虫四阶段虫体收集、总RNA的提取和反转录 参考李祥瑞和汪志楷[16]的报道,以8×104个卵囊·只-1的剂量经口感染2月龄无球虫幼兔4只,分别于感染后10 d收集裂殖生殖阶段虫体,感染后13 d收集配子生殖阶段虫体,感染后28 d收集未孢子化卵囊,于液氮中保存。同时将收集的部分未孢子化卵囊孢子化培养,置于4 ℃保存。取适量各阶段虫体用RNA抽提试剂盒进行RNA抽提,产物保存于-80 ℃超低温冰箱;取适量各阶段虫体总RNA,用反转录试剂盒在PCR仪上进行反转录,产物cDNA于-80 ℃超低温冰箱保存。
1.4.3 qRT-PCR引物设计和反应 根据Es-SAGs基因序列设计特异性qRT-PCR引物并参考GenBank中公布的Es-18S rRNA(HQ173837.1)基因序列结合转录组数据库中的Es-β-Actin、Es-GAPDH的基因序列设计内参基因的特异性qRT-PCR引物如表1所示。目的基因相对表达量采用 2-△△Ct方法计算[17]。

表1 qRT-PCR引物
1.5 Es-SAG13、Es-SAG14原核表达、纯化和免疫印迹分析
1.5.1 rEs-SAG13和rEs-SAG14的表达与纯化 结合荧光定量PCR的结果筛选出Es-SAG13、Es-SAG14,用Primer Premier 5.0软件设计含限制性酶切位点的引物(SAG13上游5′-CGGGATCCATGAACGCGGCTCGAGCC-3′,BamHⅠ;下游5′-CGGGATCCATGAACGCGGCTCGAGCC-3′,EcoRⅠ;SAG14上游5′-CGGGATCCATGGGAGAGGAATCCGG-3′,BamHⅠ;下游5′-CGGAATTCCTAAAATCCGCCCTGGT-3′,EcoRⅠ)进行PCR扩增。将目的条带与pMD19-T载体连接,以测序结果正确的重组质粒为模板再次进行PCR扩增,产物和pET32a(+)质粒共同双酶切、T4连接后转入表达感受态BL21(DE3)中,培养阳性菌至菌液OD590 nm至0.6后,加入1.0 mmol·L-1IPTG,37 ℃诱导表达8 h(110 r·min-1);菌液7 000 r·min-1离心10 min后,于菌体沉淀中加入裂解液(50 mmol·L-1Tris-HCl,pH=8.0)重悬菌体,反复冻融3次后超声破碎。取上清和尿素溶解的沉淀进行SDS-PAGE判断原核表达重组蛋白的可溶性。用镍离子亲和层析的方法纯化重组蛋白,并将纯化后的重组蛋白用PBS进行透析,SDS-PAGE分析效果。
1.5.2 rEs-SAG13和rEs-SAG14的反应原性分析 以1∶200稀释的斯氏艾美耳球虫阳性兔血清为一抗,1∶1 000稀释的HRP标记的羊抗兔IgG为二抗,按常规方法进行免疫印迹分析。
1.6 斯氏艾美耳球虫rEs-SAG13、rEs-SAG14免疫保护效果观察
1.6.1 分组及免疫 40只45日龄的无肝球虫幼兔分组和免疫程序见表2。

表2 试验动物分组和免疫程序
1.6.2 评价指标 具体如下。
安全性观察:初次免疫、二次免疫和攻虫时称量体重,免疫后观察所有试验兔的健康状况。
感染后观察各组精神状态、饮食欲、腹围、肝区敏感度、眼结膜色泽等;若出现死亡,记录死亡时间并剖检;每隔7 d记录一次体重,于感染后第21天剖杀所有试验兔,观察肝病变并记分,测定肝指数、相对增重率、料肉比等。参考最新公布的动物球虫病诊断技术国家标准(GB/T 18647—2020),剖检时收集适量直肠粪样进行卵囊排出量的定量检查,统计各组平均每克粪便卵囊数(oocyst per gram,OPG),并计算卵囊减少率。
肝指数=肝质量/体质量×100%;相对增重率=试验组平均增重/对照组平均增重×100%;料肉比=(饲喂前饲料总量-剖杀后剩余饲料总量)/感染后增重总量;卵囊减少率=(攻虫对照组OPG-免疫组OPG)/攻虫对照组OPG×100%。
病变记分参考Peeters和Geeroms[18]提出的5分制:0分为无病变;1分表示表面有1~10个粟粒状结节;2分表示表面有11~50个豆状结节或部分融合为泡状的大结节;3分表示表面有50~100个泡状大结节;4分表示肝高度肿胀,表面有许多融合的泡状大结节;5分表示表面泡状结节融合为团块状。
1.6.3 数据处理 利用SPSS 22.0进行方差分析,对肝指数、平均增重、料肉比、肝病变记分进行组间差异的显著性检验。
2 结 果
2.1 Es-SAGs的基因扩增、克隆测序和生物信息学分析及其在虫体不同发育阶段的转录水平分析
克隆测序得到的8条Es-SAGs序列,经生物信息学分析发现:Es-SAGs均含有C端GPI锚定位点,均无跨膜区,且除SAG9和SAG12外均无信号肽;另抗原表位预测发现Es-SAGs均有较多B细胞线性表位(表3)。

表3 Es-SAGs生物信息学分析和表位预测
以E.stiedae未孢子化卵囊、孢子化卵囊、裂殖生殖阶段虫体和配子生殖阶段虫体的cDNA为模板,对8个Es-SAG基因进行qRT-PCR扩增,用Es-18S rRNA、Es-β-Actin、Es-GAPDH作为内参基因进行综合分析发现Es-SAG基因的转录水平在各个阶段存在差异,其中Es-SAG13、Es-SAG14在裂殖生殖阶段表达高于其他阶段,且差异极其显著(P<0.001)(图1)。

W.未孢子化卵囊;B.孢子化卵囊;M.裂殖生殖阶段虫体;G.配子生殖阶段虫体;****.P<0.001
2.2 Es-SAG13、Es-SAG14的原核表达、纯化和免疫印迹分析
用含限制性酶切位点的引物扩增出Es-SAG13、Es-SAG14(图2)。
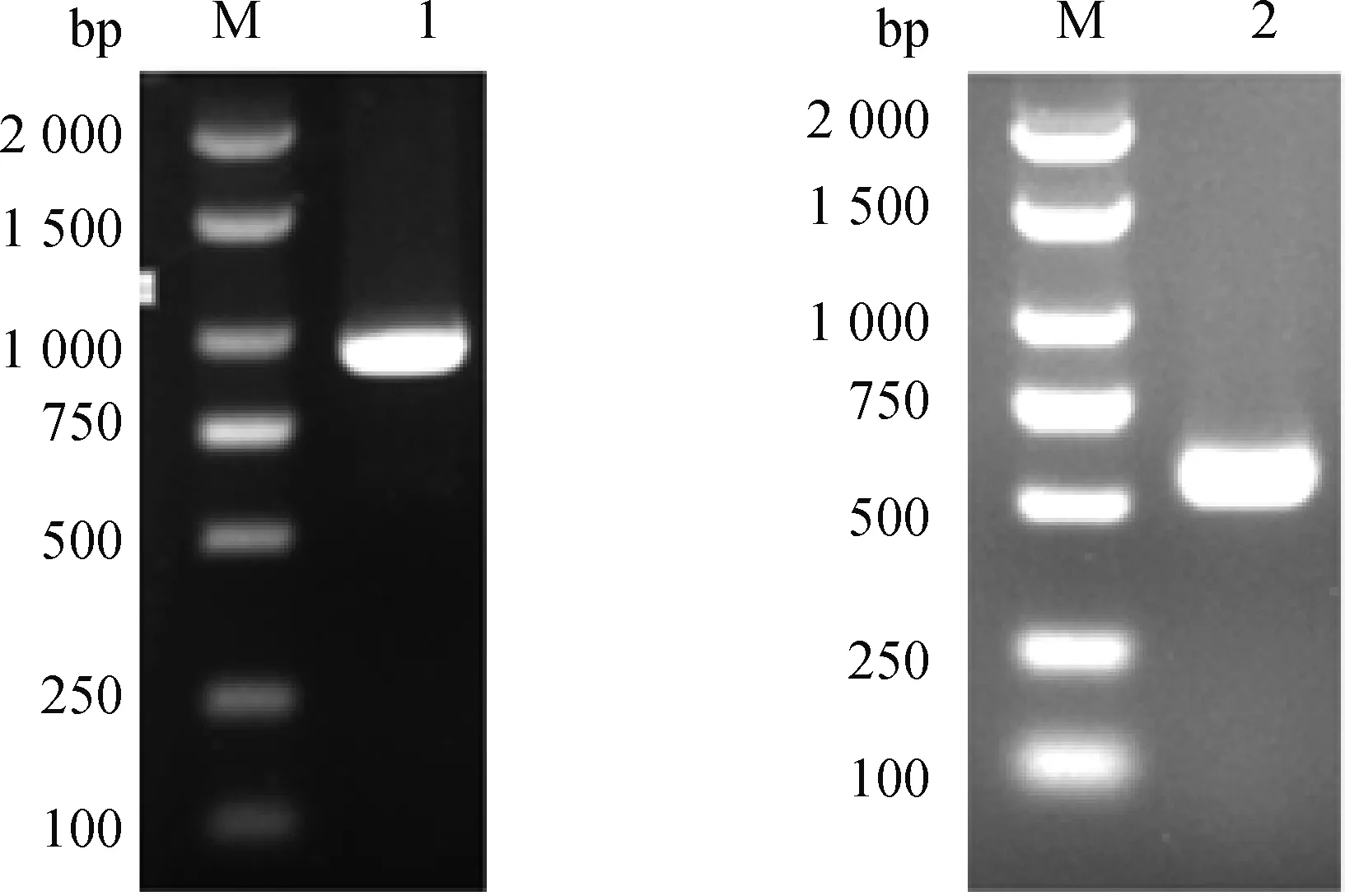
M.DL2000 DNA相对分子质量标准;1.Es-SAG13;2.Es-SAG14
两个重组蛋白在诱导剂IPTG终浓度为1.0 mmol·L-1,37 ℃诱导表达8 h(110 r·min-1)的条件下成功表达(rEs-SAG13、rEs-SAG14大小分别在51和37 ku左右),且大部分表达在上清,呈可溶性表达(图3)。两重组蛋白经镍离子亲和层析后的纯化效果良好,无明显杂条带(图4A、B)。同时rEs-SAG13和rEs-SAG14均能识别斯氏艾美耳球虫阳性兔血清(图4C),具有良好的免疫反应性。
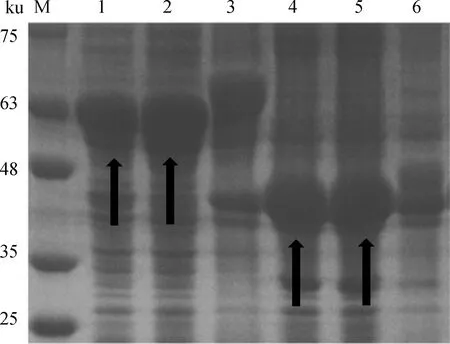
M.蛋白质分子质量标准;1、2.rEs-SAG13上清;3.rEs-SAG13包涵体;4、5.rEs-SAG14上清;6.rEs-SAG14包涵体
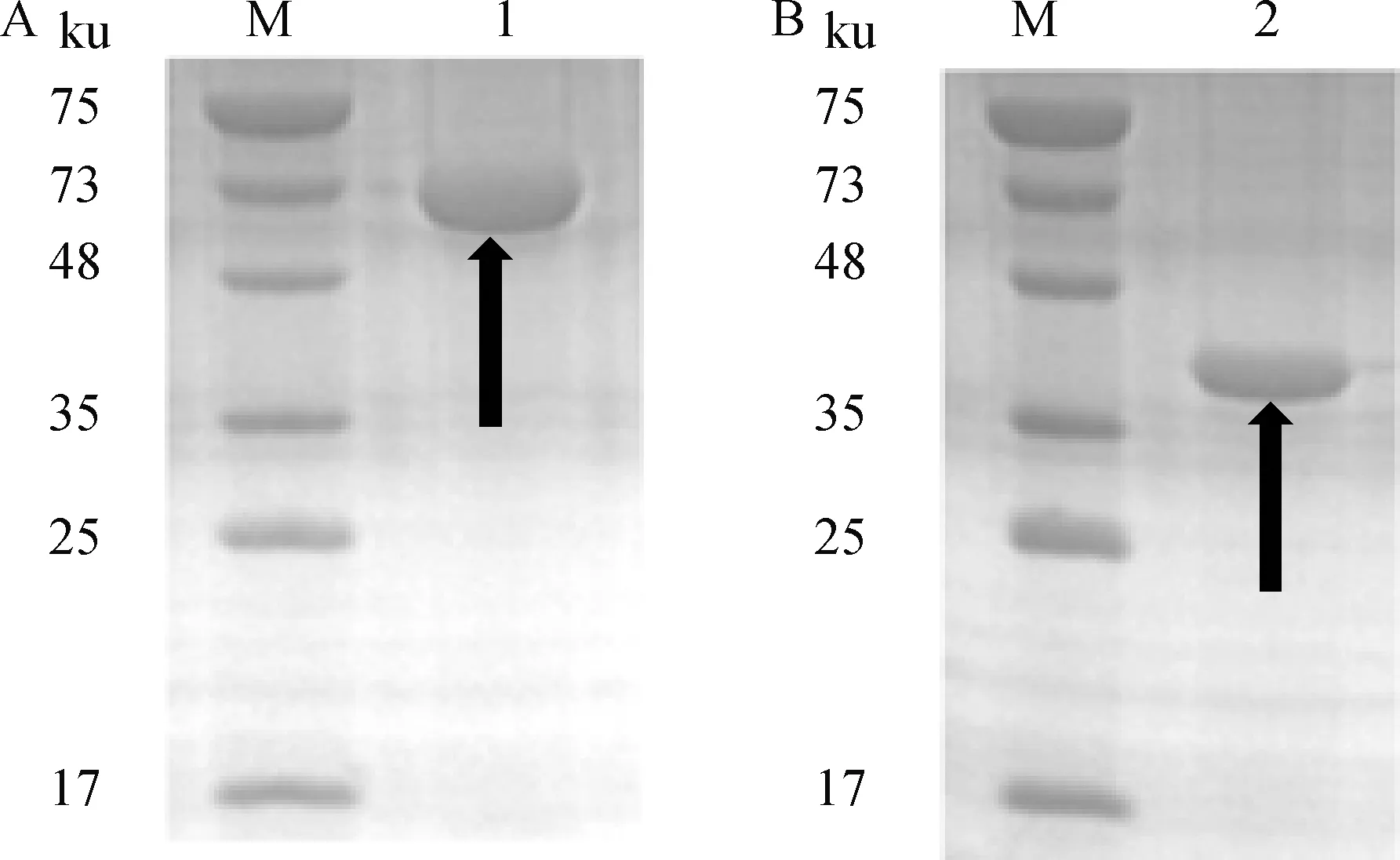
A、B.rEs-SAG13、rEs-SAG14的纯化效果;C.免疫印迹分析;M.蛋白质分子质量标准;1.rEs-SAG13;2.rEs-SAG14
2.3 rEs-SAG13、rEs-SAG14的免疫保护效果
2.3.1 临床症状 初次免疫、二次加强免疫后各组并未出现明显不良反应,说明重组蛋白具有良好的安全性。在经口感染1×104个·只-1孢子化卵囊后攻虫对照组出现兔肝球虫病典型症状:感染后前两周症状不明显,感染后第3周表现为食欲减退,精神沉郁,喜卧;消瘦,腹泻偶有便秘;可视黏膜黄染,腹围增大,肝区触诊敏感;而rEs-SAG13免疫组和rEs-SAG14免疫组兔肝球虫病临床症状不明显,感染后第3周偶有食欲稍减退,可视黏膜轻度黄染,腹围略有增大。经口感染后各组均未出现死亡。
2.3.2 卵囊排出量 感染后21 d进行卵囊排出量的检查,空白对照组的粪便样本中未检查到斯氏艾美耳球虫卵囊;攻虫对照组平均OPG达1.83×106,而rEs-SAG13免疫组和rEs-SAG14免疫组的平均OPG与攻虫对照组相比均显著减少,分别为3.15×105(P<0.01)和8.84×105(P<0.05)(表4)。rEs-SAG13免疫组和rEs-SAG14免疫组的卵囊减少率分别达82.8%和51.9%。
2.3.3 相对增重、料肉比和肝指数 初次免疫、二次免疫和攻虫时各组体重无明显差异。感染21 d后攻虫对照组平均体重为2 461.2 g±450.0 g,与空白对照组平均体重2 642.5 g±182.0 g、rEs-SAG13免疫组平均体重2 488.5 g±168.0 g、rEs-SAG14免疫组平均体重2 401.2 g±411.0 g均无明显差异(P>0.05);但攻虫对照组的平均增重显著低于免疫组和空白对照组(P<0.05),相对增重率仅为空白对照的39.08%,感染后14~21 d个别试验兔体重出现负增长;rEs-SAG13免疫组平均增重与空白对照无显著差异(P>0.05),相对增重率达88.77%;rEs-SAG14免疫组平均增重与空白对照差异明显(P<0.05),相对增重率为67.48%(表4)。
攻虫对照组自感染起到感染后21 d的料肉比达9.67∶1,而空白对照组料肉比为3.78∶1,rEs-SAG13免疫组料肉比为4.26∶1,rEs-SAG14免疫组料肉比为5.60∶1。各组肝指数均有明显差异,攻虫对照组的平均肝指数达6.66,而空白对照组平均肝指数为3.44,rEs-SAG13免疫组平均肝指数为4.52较攻虫对照组差异显著(P<0.05),rEs-SAG14免疫组平均肝指数为5.27(表4)。

表4 免疫保护评价指标统计结果
2.3.4 解剖病变与病变记分 剖检发现空白对照组肝无病变,而攻虫对照组出现兔肝球虫病典型病理变化:肝高度肿胀,充满整个前腹部,表面布满黄白色融合豆状甚至融合的泡状结节;胆囊扩张,胆汁瘀滞,大部分胆囊都充满黄色渗出物,腹水明显,膀胱积尿;rEs-SAG13免疫组病变较轻微,肝肿胀不明显,有一定数量的粟粒状或豆状结节,有的有少许泡状结节;rEs-SAG14免疫组肝明显肿胀,肝表面有一定量的泡状大结节,且组内存在明显差异(图5)。

A.空白对照组;B.攻虫对照组;C.rEs-SAG13免疫组;D.rEs-SAG14免疫组;1~10.试验兔编号
对各组进行肝病变记分,攻虫对照组平均病变记分为4.2,rEs-SAG13免疫组平均病变记分为2.7,较攻虫对照组差异极显著(P<0.05),rEs-SAG14免疫组平均病变记分为3.7,与攻虫对照组差异不显著(P>0.05)(表4)。
3 讨 论
兔球虫病疫苗研究起步较晚,相对滞后。强毒苗是开发兔球虫疫苗最初的尝试,研究者用黄艾美耳球虫活虫苗加倍递增剂量免疫无球虫兔,取得了良好的免疫保护效果[18]。强毒苗由于其较高的致病风险和较复杂的免疫程序并未得到应用,相比之下,早熟弱毒苗因其低致病性、强免疫原性而备受期待。大型艾美耳球虫[19-20]、中型艾美耳球虫[6,21]、梨形艾美耳球虫[22]、黄艾美耳球虫[23]、肠艾美耳球虫[7,24]等兔球虫早熟株已成功选育,方素芳等[8]用不同剂量的大型艾美耳球虫早熟株、肠艾美耳球虫早熟株和中型艾美耳球虫早熟株混合卵囊免疫家兔,用其相应亲本株的混合卵囊进行攻虫,发现免疫组接种后均未出现临床症状,日增重与未免疫未攻虫对照组相似,卵囊产量与未免疫攻虫对照组相比有显著差异,表明早熟弱毒苗具有很好的免疫保护效果。相比于活虫苗,基因重组亚单位疫苗安全性更好,更有利于工业化生产。孟庆玲等[25-26]构建了斯氏艾美耳球虫微线蛋白5(MIC-5)和兔IL-15重组质粒并在真核细胞中成功共表达,进而制备携带MIC-5的减毒鼠伤寒沙门菌活疫苗,接种该疫苗后幼兔无不良反应,相对增重率达84.4%,显示出良好的安全性和一定的保护作用。
用斯氏艾美耳球虫感染兔的胆汁抗原和粪便抗原免疫兔后均能引起兔卵囊排出减少,显示出一定的保护作用;且这两种可溶性抗原中的主要抗原分子均由裂殖生殖阶段分泌[27-30]。顶复门原虫的入侵是虫体和宿主细胞相互作用的结果,通过糖基化磷脂酰肌醇锚定在侵袭期虫体表面的SAGs能够非特异性地黏附宿主细胞,启动入侵,同样SAGs也能直接接触宿主的免疫系统,刺激宿主作出免疫应答[31-32],因此,SAGs被认为是重要的保护性抗原候选。顶复门原虫SAGs存在表达上的时序性,弓形虫SAG1和SAG2是速殖子阶段特异性抗原,SAG4是缓殖子阶段特异性抗原,而SAG3在速殖子和缓殖子阶段均存在[33-34];在柔嫩艾美耳球虫中,SAG1属于子孢子特异性抗原,SAG16、SAG22和SAG23在子孢子和裂殖生殖阶段均存在,其余的SAGs属于裂殖生殖阶段特异性抗原[35]。
鸡柔嫩艾美耳球虫SAG1[36]及巨型艾美耳球虫EmSAG[14]的原核表达产物免疫鸡后卵囊减少率分别达83.42%、75.93%,相对增重率分别达90.3%、86.3%。本试验中作者发现Es-SAG13和Es-SAG14属于斯氏艾美耳球虫裂殖生殖阶段特异性抗原,在免疫保护试验中能大幅度减少卵囊排出量,rEs-SAG13免疫组和rEs-SAG14免疫组的卵囊减少率分别达82.8%和51.9%;另外免疫组均能不同程度减少增重损失,相对增重率分别为88.77%、67.48%。同时,攻虫对照组的肝病理变化也十分典型,肝高度肿胀,表面充满沿胆小管分布的黄白色结节;其中rEs-SAG13免疫能明显减轻这种肝病理变化,其肝病变记分显著低于攻虫对照组(P<0.05),与鸡的巨型艾美耳球虫EmSAG的原核表达产物免疫鸡后显著降低平均病变评分的结果相类似[14]。因此,免疫保护试验结果初步表明rEs-SAG13可作为斯氏艾美耳球虫基因重组亚单位疫苗的候选抗原。
4 结 论
对斯氏艾美耳球虫的8个SAGs基因进行了克隆、鉴定以及转录水平分析,发现Es-SAG13和Es-SAG14基因在裂殖生殖阶段表达高于其他阶段,且差异极显著(P<0.001)。免疫保护试验结果显示,rEs-SAG13及rEs-SAG14免疫兔后均能不同程度地减少增重损失和卵囊排出,减轻肝病变,其中,rEs-SAG13免疫保护效果更佳。表明rEs-SAG13可作为斯氏艾美耳球虫基因重组亚单位疫苗的候选抗原。

