不同的降压治疗方案对高血压脑出血病人神经功能、炎症反应及预后的影响
贺智杰,蔡青云
作者单位:1信阳市中心医院重症医学科,河南 信阳464000;
2驻马店市中心医院急诊科,河南 驻马店463000
高血压脑出血(HICH)引起的致残率和病死率较高,是影响高血压病人预后的严重并发症。血肿块可压迫局部脑组织,造成继发性脑组织水肿。早期血肿扩大是引起病情加重、预后不良的重要原因之一[1]。目前临床对于HICH 早期血压控制治疗尚存在着一定的争议。传统观点反对积极降压,认为HICH 发生后早期血压升高是机体的保护性自我调节机制,降低血压可降低脑灌注压,加重血肿周围脑组织缺血性损伤。而脑组织缺血状态下可释放细胞毒性物质,加重脑组织水肿而致颅内压升高[2]。有研究认为,HICH 发生后早期血肿扩大与血压密切相关,尤其是发病6 h 内血压值较高,并存在着大幅度波动[3]。而血肿扩大可加剧脑组织水肿,血肿本身还可释放大量的毒性代谢产物,进一步加重脑组织损伤。对HICH 病人进行早期强化降压治疗可有效阻止血肿扩大,减轻神经功能损伤[4],但其作用机制尚不十分明确。而目前的研究普遍认为,HICH病人血肿扩大及神经功能损害可能与机体炎症应激反应显著相关。vWF 是由内皮细胞、巨噬细胞合成的炎性因子,可损伤血管内皮细胞,介导血小板异常黏附、聚集,促进血栓前状态形成[5]。NF-κB 是机体炎症反应的转录调节因子,在炎症反应中起到关键作用[6]。HMGB-1 是一种DNA 结合蛋白,在炎性因子的作用下大量分泌,通过多种途径激活炎症反应,加重脑组织损伤[7]。CRP 是急性时相反应蛋白,可灵敏反映机体炎症状态[8]。本研究旨在探讨强化降压与常规降压治疗对HICH 病人神经功能、炎症反应及预后的影响,为HICH 临床治疗及疗效和预后的评价提供参考依据,现报告如下。
1 资料与方法
1.1 一般资料选取2016 年3 月至2019 年3 月信阳市中心医院收治的HICH 病人108 例,纳入标准:(1)HICH 病人的诊断标准参考1996 年中华医学会神经科学会制定的诊断标准[9];(2)HICH 病人在起病后6 h 内入院,经头颅CT、磁共振成像(MRI)检查,确诊为幕上出血,且出血量15~30 mL;(3)病人入院时收缩压150~220 mmHg;(4)且病人或其近亲属均知情同意。排除标准:(1)格拉斯哥昏迷量表(GCS)评分<5 分;(2)恶性肿瘤病人;(3)颅内动脉瘤破裂、脑梗死、颅脑外伤;(4)凝血功能障碍;(5)伴有活动性上消化道出血疾病。采用随机数字表法分为强化组和常规组各54 例。强化组,年龄(65.0±8.3)岁,范围为52~83岁;男30例、女24例;病人幕上出血量(23.0±4.1)mL,范围为15~30 mL;入院病人收缩压(186.9±8.2)mL。常规组,年龄(63.8±9.6)岁,范围为50~82 岁;男28 例、女26 例;病人幕上出血量(22.4±4.8)mL,范围为15~30 mL;入院病人收缩压(188.2±7.0)mL。两组病人的年龄、性别、出血量、入院时收缩压差异无统计学意义(P>0.05)。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 治疗方法强化组采用早期强化降血压治疗,首选静脉泵注乌拉地尔,对血压难以控制者依次改用尼卡地平、硝普钠,在3 h 内将收缩压降至140 mmHg 以下,急性期过后可改用长效口服降压药或维持120~140 mmHg至发病后1周,避免血压剧烈波动。常规组对收缩压<180 mmHg,平均动脉压<130 mmHg 者不予积极降压,首先严密监测,给予止血、吸氧、保持安静等治疗。对收缩压≥180 mmHg 或平均动脉压≥130 mmHg 者,静脉泵注乌拉地尔,对血压难以控制者依次改用尼卡地平、硝普钠,进行缓慢降压,在第1个24 h内血压降幅不超过20%,目标降压为收缩压160~180 mmHg,平均动脉压100~130 mmHg。所有病人在发病后6 h 内无脑疝迹象及明显占位效应者不予甘露醇。
1.3 观察指标及检查方法检测对比两组病人的美国国立卫生研究院卒中量表(NIHSS)评分、格拉斯哥预后量表(GOS)评分。恢复良好:恢复正常生活,尽管有轻度缺陷(5 分);轻度残疾但可独立生活;能在保护下工作(4 分)。重度残疾:清醒、残疾,日常生活需要照料(3 分)。植物生存:仅有最小反应(如随着睡眠/清醒周期,眼睛能睁开)(2 分)。死亡(1 分)。5 分和4 分的病人为恢复良好。治疗前后的血浆血管性假血友病因子(vWF)、核因子-κB(NF-κB)、高迁移率族蛋白-1(HMGB-1)、C反应蛋白(CRP)、脑水肿体积变化。分别于治疗前、治疗7 d后抽取病人外周静脉血,血标本以转速3 500 r/min、离心半径12 cm、离心时间10 min 分离血清,冻存于−70 ℃超低温冰箱,统一检测vWF、NF-κB、HMGB-1、CRP 水平,检测方法:双抗体夹心酶联免疫吸附法,检测仪器:芬兰雷勃MK3 型全自动酶标仪,试剂盒生产厂家:上海酶联生物技术有限公司。分别于治疗3 d、治疗7 d、治疗14 d 时进行颅脑CT 扫描,观察脑水肿体积的变化,检测仪器:德国西门子SO‑MATOM Force螺旋CT。
1.4 统计学方法采用SPSS 21.0 软件进行统计学处理,采用±s表示符合正态分布的计量资料,应用成组t检验分析两组间差异,重复测量资料采用重复测量方差分析;应用χ2检验分析计数资料的组间差异。P<0.05说明差异有统计学意义。
2 结果
2.1 两组病人的NIHSS 评分变化随着治疗时间的延长,两组病人的NIHSS 评分均呈逐渐降低的趋势,而重复测量方差分析结果显示,F组间=5.584、F时间=19.664、F交互=8.520,均P<0.001,表明治疗时间与降压方案存在交互作用,而时间因素对病人NIHSS 评分变化的作用随降压方案的不同而差异有统计学意义。在治疗7 d、14 d 时刻,强化组病人的NIHSS评分均低于对应时间点的常规组(P<0.05),见表1。
表1 两组高血压脑出血病人的美国国立卫生研究院卒中量表(NIHSS)评分变化/(分,± s)

表1 两组高血压脑出血病人的美国国立卫生研究院卒中量表(NIHSS)评分变化/(分,± s)
注:①与同组治疗前比较,P<0.05。②与同组治疗7 d 比较,P<0.05。
治疗14 d 5.08±1.30①②3.89±1.04①②5.25<0.001组别常规组强化组t值P值例数54 54治疗前15.20±4.81 14.63±4.25 0.65 0.515治疗7 d 7.64±2.39①6.11±2.50①3.25 0.002
2.2 两组病人的脑水肿体积变化两组病人脑水肿体积均呈先升高后降低趋势,而重复测量方差分析结果显示,F组间=6.201、F时间=22.504、F交互=11.395,均P<0.001,表明治疗时间与降压方案存在交互作用,而时间因素对脑水肿体积变化的作用随降压方案的不同而差异有统计学意义。治疗7 d 时,两组病人的脑水肿体积较治疗3 d 时均有所增大,在治疗14 d 时,两组病人的脑水肿体积均显著缩小(P<0.05),且强化组的脑水肿体积均小于常规组(均P<0.05),见表2。
表2 两组高血压脑出血病人的脑水肿体积变化/(mL,± s)
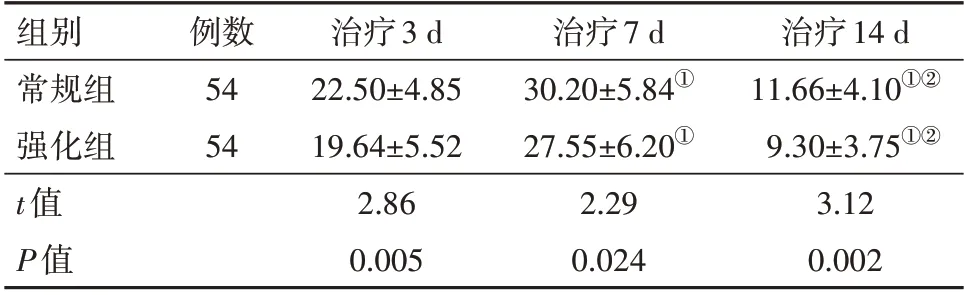
表2 两组高血压脑出血病人的脑水肿体积变化/(mL,± s)
注:①与同组治疗3 d比较,P<0.05。②与同组治疗7 d比较,P<0.05。
治疗14 d 11.66±4.10①②9.30±3.75①②3.12 0.002组别常规组强化组t值P值例数54 54治疗3 d 22.50±4.85 19.64±5.52 2.86 0.005治疗7 d 30.20±5.84①27.55±6.20①2.29 0.024
2.3 两组病人的治疗前后的各炎症反应因子比较治疗前,两组病人的血浆vWF、NF-κB、HMGB-1、CRP 水平差异无统计学意义(P>0.05),治疗7 d后,强化组的血浆vWF、NF-κB、HMGB-1、CRP 水平均低于常规组(P<0.05),且强化组各指标变化更为显著(P<0.05),见表3。
表3 两组高血压脑出血病人的治疗前后的各炎症反应因子比较/± s
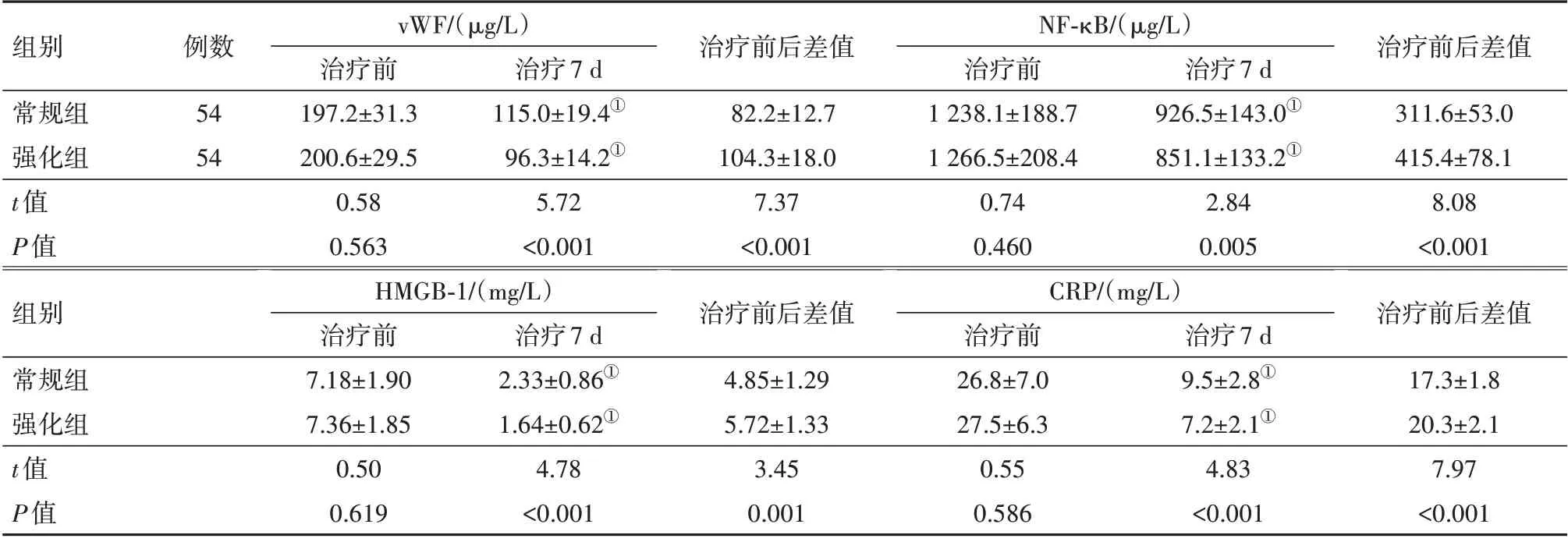
表3 两组高血压脑出血病人的治疗前后的各炎症反应因子比较/± s
注:vWF为血管性假血友病因子,NF-κB为核因子-κB,HMGB-1为高迁移率族蛋白-1,CRP为C反应蛋白。①与同组治疗前比较,P<0.05。
组别常规组强化组t值P值组别常规组强化组t值P值vWF/(µg/L)治疗前197.2±31.3 200.6±29.5 0.58 0.563 HMGB-1/(mg/L)治疗前7.18±1.90 7.36±1.85 0.50 0.619 NF-κB/(µg/L)治疗前1 238.1±188.7 1 266.5±208.4 0.74 0.460 CRP/(mg/L)治疗前26.8±7.0 27.5±6.3 0.55 0.586治疗前后差值311.6±53.0 415.4±78.1 8.08<0.001治疗前后差值17.3±1.8 20.3±2.1 7.97<0.001例数54 54治疗7 d 115.0±19.4①96.3±14.2①5.72<0.001治疗7 d 926.5±143.0①851.1±133.2①2.84 0.005治疗7 d 2.33±0.86①1.64±0.62①4.78<0.001治疗前后差值82.2±12.7 104.3±18.0 7.37<0.001治疗前后差值4.85±1.29 5.72±1.33 3.45 0.001治疗7 d 9.5±2.8①7.2±2.1①4.83<0.001
2.4 两组病人预后比较治疗3 个月后,强化组病人的预后良好率高于常规组的(P<0.05),见表4。

表4 两组高血压脑出血病人格拉斯哥预后量表评分比较
3 讨论
HICH 是临床常见的危急重症之一,长期高血压状态下脑动脉管壁硬化、变薄,弹性下降,当血压急剧升高时可导致脑破裂、出血。血肿占位效应导致脑组织继发性损伤,血肿扩大往往预示着HICH病人预后不良[10]。目前临床对于HICH 发生后血肿扩大的机制并不肯定,可能与多重因素有关,多数学者认为血肿扩大与血压关系密切相关,建议在发病早期进行有效的降压治疗,但对降压治疗目标尚未达成统一意见[11]。有研究认为,HICH 急性期机体血压调节机制失控,血压升高的原因比较复杂,并不是由颅内压升高这一单一因素引起,应激反应、尿潴留等也可能引起血压升高[12]。过度降低血压可导致脑灌注压降低,加重脑组织缺血而引起水肿,建议降压目标为收缩压160~180 mmHg,平均动脉压100~130 mmHg[13]。也有学者提出,血压剧烈波动可损伤血管内皮、破坏血脑屏障,甚至可能引起再出血或持续出血,导致HICH 进行性发展,最终导致病人死亡,因此建议在短时间内将收缩压下降至140 mmHg以下,并维持120~140 mmHg[14]。
本研究发现,治疗时间与降压方案存在交互作用,而时间因素对病人NIHSS 评分变化的作用随降压方案的不同而差异有统计学意义,在治疗7 d、14 d 时刻,采用强化降压治疗者的NIHSS 评分均低于对应时间点的采用常规降压治疗者,提示HICH 早期采用强化降压治疗可更好地促进病人神经功能恢复。与王锋等[15]的研究结果基本一致。可能由于迅速降压可减少血管内压力,防止原破裂血管持续出血或再出血,更快地阻止病情进展。血肿的占位效应可导致其周围的脑组织发生水肿、坏死,增加继发性出血风险。因此可以认为脑水肿的是脑出血后最严重的二次损伤,也是导致预后不良的重要原因[16]。本研究还发现,时间因素对脑水肿体积变化的作用随降压方案的不同而差异有统计学意义,治疗7 d 时两组病人的脑水肿体积较治疗3 d 时均有所增大,在治疗14 d 时刻,两组病人的脑水肿体积均显著缩小,采用强化降压治疗者的脑水肿体积小于采用常规降压治疗者。这一结果提示,在脑出血早期脑水肿逐渐加重,随着治疗后病情的控制,水肿程度逐渐减轻。HICH 早期采用强化降压治疗可更好地阻止脑水肿体积扩大,并促进脑水肿减轻。钟国富等[5]的研究也得到了类似的结论,这可能与强化降压治疗可阻止血肿扩大、阻断血肿占位效应。
另外,已有研究发现,HICH 发生后的神经功能损伤与局部炎症反应、血管内皮受损有关[17]。血压升高,尤其是收缩压升高,易致ICH 后血肿面积扩大,加重神经功能损伤程度。vWF 可反映血管损伤中程度,NF-κB 可参与炎症反应、氧化还原反应、细胞凋亡等,两者在脑出血发生中起重要参与作用[18]。多项研究显示,HMGB-1、CRP对急性脑出血病人炎症反应和脑组织水肿的发生和发展起着重要的作用[19-20]。本研究中采用强化降压治疗者治疗7 d 后的血浆vWF、NF-κB、HMGB-1、CRP 水平均低于采用常规降压治疗者,且治疗后改善程度明显高于常规降压者,而治疗后随访3个月发现,采用强化降压治疗者的预后良好率高于采用常规降压治疗者,提示HICH 病人早期采用强化降压治疗更有助于减轻炎症反应程度并改善预后,与何晓飞等[21]、章陈晨[22]的研究结果基本一致,这可能与强化降压治疗可通过阻断经典补体激活途径而减少炎性因子释放,进而保护血管内皮功能,防止发生级联反应,从而更好地减轻脑水肿程度、保护神经功能有关。
综上所述,幕上少量出血的HICH 病人早期采用强化降压治疗对于减轻脑水肿程度、促进病人神经功能恢复、改善预后具有一定的积极意义。

