长链非编码RNA小核仁RNA宿主基因4在胃癌中的表达及与预后的关系
谭莉霞,杨文义,闫春晓,王航宇,杨丙信,徐梦阳,武利萍
作者单位:河南大学第一附属医院消化内科,河南 开封475000
胃癌是一种常见的恶性肿瘤,被认为是第四大最常见的肿瘤类型,也是全世界癌症相关死亡的第二大原因[1]。由于胃癌早期多无明显症状,大多数胃癌病例在诊断时已发展为晚期,很大概率地限制了治疗范围。因此,对胃癌发病机制的研究对改进预防策略、开发早期诊断及管理治疗方法是必要的。近年来,长链非编码RNA(long non-coding RNA,LncRNA)在癌症中的作用越来越受到重视。研究发现,LncRNA 可参与调控基因转录及翻译进而参与多种癌症的发生发展过程[2-3]。小核仁RNA宿主基因4(small nucleolar RNA host gene 4,SN‑HG4)是一类小非编码RNA 分子,参与rRNAs、tRNAs、snRNAs 等其他RNA 的化学修饰[4]。最新研究报道称,SNHG4 表达上调与肝癌病人低生存率有关,是肝癌预后不良的独立预测因子[5]。Xu 等[6]研究发现,LncRNA SNHG4在骨肉瘤中高表达,且其表达水平与肿瘤大小及病人不良预后有关。上述研究表明LncRNA SNHG4 在多种癌症中差异性表达并对肿瘤进展起重要作用。本研究利用生物信息学方法通过iBio Tools v5.0 分析发现SNHG4 在胃癌中的表达水平明显升高,通过检测胃癌组织中Ln‑cRNA SNHG4 表达水平,分析其与病人临床病理参数及预后之间的关系,以期为临床诊断提供依据。
1 资料与方法
1.1 一般资料选取2015 年1 月至2016 年10 月于河南大学第一附属医院肿瘤科行手术根治术切除的113 例胃癌组织及82 例癌旁正常胃黏膜组织为研究对象。113 例胃癌病人中,男68 例,女45 例,年龄≥50 岁的66 例,<50 岁的47 例;临床分期Ⅰ~Ⅱ期42 例,Ⅲ~Ⅳ期71 例;低分化73 例,中高分化40 例;发生淋巴结转移79 例,未转移34 例。所有胃癌病人均经病理组织诊断确诊,均为首次治疗,术前未行放、化疗或其他抗肿瘤药物治疗,病人临床病理资料及随访资料完整。排除合并其他肿瘤病人及自身免疫性疾病病人。所有病人知情同意此次研究,本研究获得河南大学第一附属医院伦理委员会批准(20150213)。
1.2 方法
1.2.1 数据库来源 UALCAN(http://ualcan.path.uab.edu/index.html)是一个全面的癌症数据在线分析和挖掘的网站,是基于癌症基因组图谱(the can‑cer genome atlas,TCGA)分析和可视化目标基因的网站,可实现相关癌症基因生物标志物鉴定、表达图谱分析、生存分析等。本研究基于上述数据库,对SNHG4 在胃癌组织及癌旁正常胃黏膜组织中表达差异进行比较。
1.2.2 实时荧光定量逆转录聚合酶链反应(qRTPCR)检测LncRNA SNHG4 表达水平 首先按照Trizol 试剂盒(日本Takara 公司)说明书方法对胃癌组织及癌旁正常胃黏膜组织进行总RNA 的提取,利用逆转录试剂盒(美国Applied Biosystem 公司)将RNA 逆转录为互补DNA(cDNA),采用qRT-PCR 法检测LncRNA SNHG4 表达水平。qRT-PCR 反应体系共20 µL,其中SYBR Green qPCR Mix 10 µL,cD‑NA 2 µL,正、反向引物各1 µL,双蒸水6 µL。Ln‑cRNA SNHG4 以β 肌动蛋白(β-actin)为内参,引物序列由生工生物工程(上海)股份有限公司设计合成。LncRNA SNHG4 正向引物:5’-GCAGGTGA‑CAGTCTGCATGT-3’,反向引物:5’-TTTTA‑AGTCCCCTACCCCCATC-3’;β-actin 正向引物:5’-TGCTGTCCCTGTATFCCTCT-3’,反向引物:5’-TGATGTCACGCACGATTTT-3’。循环条件:95 ℃预变性2 min,90 ℃变性15 s,65 ℃延伸30 s,共40个循环。利用2−ΔΔCt法计算LncRNA SNHG4 相对表达水平。
1.3 随访所有胃癌病人术后均以电话或门诊形式进行随访,随访截止日期为2020 年10 月,随访时间范围为6~57 个月,中位随访时间21 个月,以病人死亡为随访终点事件。到随访日期结束,共计死亡72例,存活31例,失访10例,即72例发生终点事件。统计胃癌病人生存时间,绘制Kaplan-Meier 生存曲线,比较不同LncRNA SNHG4 表达水平病人生存情况。
1.4 统计学方法采用SPSS 25.0 软件进行数据的录入与分析。计数资料以例(%)表示;基于R 语言的survivalROC 包完成时间依赖性ROC 曲线绘制,同时通过约登指数获取用于生存分析分组的最佳阈值点。采用χ2检验分析LncRNA SNHG4 表达水平与胃癌病人临床病理参数的关系;生存分析采用Kaplan-Meier 法,组间生存曲线差异用log-rank 检验;多因素Cox 回归分析影响胃癌病人预后不良的危险因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 数据库分析SNHG4基因在胃癌组织及正常组织中的表达情况TCGA 数据库显示,SNHG4 基因在415 例胃癌组织中的表达水平为(1.95±0.62),明显高于其在34 例正常胃黏膜组织中的表达水平(0.43±0.12)(t=14.26,P<0.001)。
2.2 LncRNA SNHG4在胃癌组织及正常胃黏膜组织中的表达水平LncRNA SNHG4 在113 例胃癌组织中的表达水平为(1.67±0.64),明显高于其在82例癌旁正常胃黏膜组织中的表达水平(0.98±0.12)(t=9.63,P<0.001)。
2.3 胃癌组织中LncRNA SNHG4表达情况与病人临床病理参数之间的关系使用survivalROC 包绘制时间依赖性ROC 曲线,得到最佳截断值为1.816,故本研究以LncRNA SNHG4 水平是否大于1.816 将病人分为LncRNA SNHG4高表达组(>1.816)和低表达组(≤1.816)。结果显示,LncRNA SNHG4 水平高低与胃癌病人年龄、性别、肿瘤最大径、肿瘤位置无关(P>0.05),与病人临床分期、肿瘤分化程度、浸润深度、淋巴结是否转移有关(P<0.05),见表1。
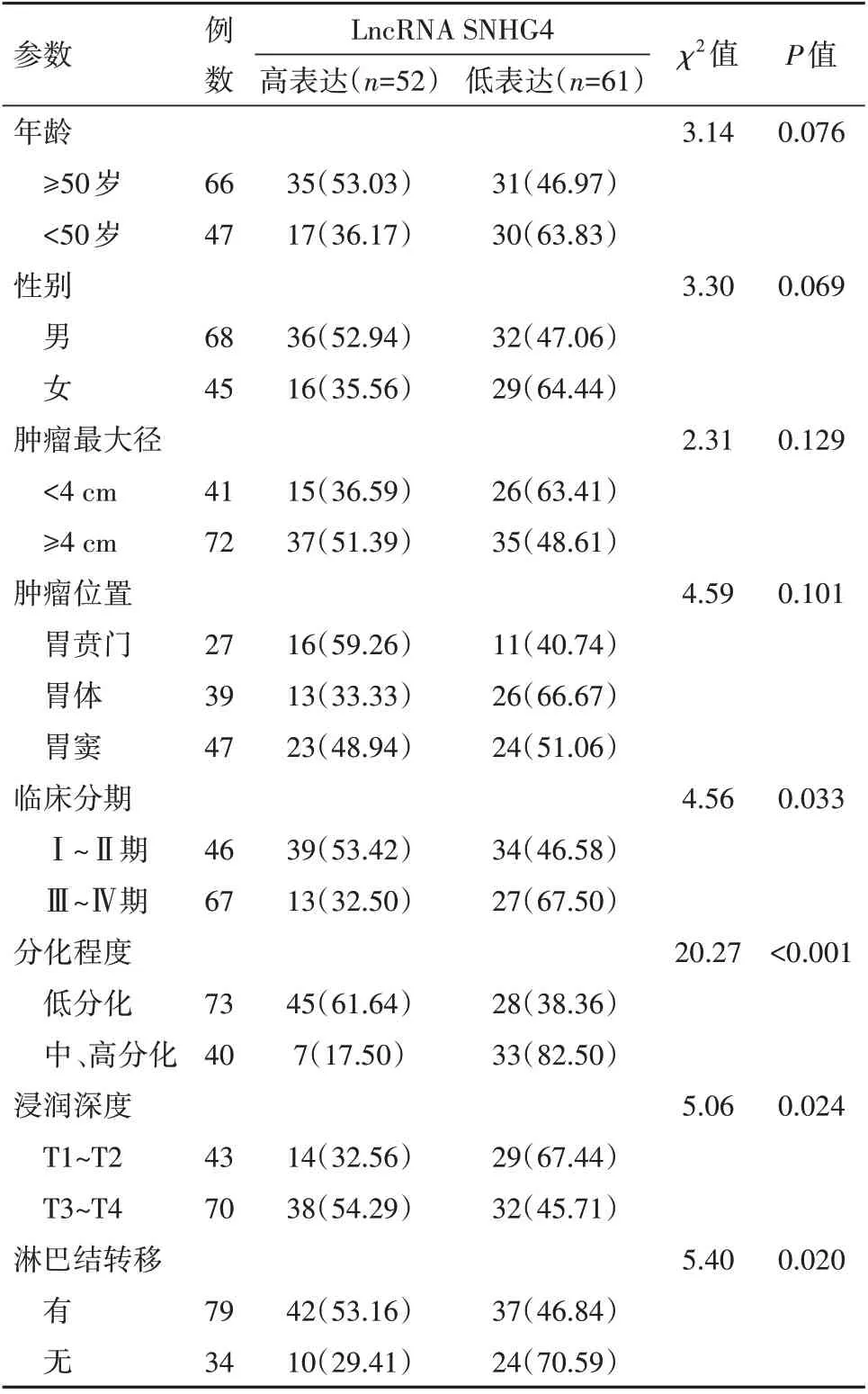
表1 胃癌组织中LncRNA SNHG4表达情况与病人临床病理参数之间的关系/例(%)
2.4 LncRNA SNHG4表达水平与胃癌病人生存时间的关系Kaplan-Meier 生存分析结果显示,Ln‑cRNA SNHG4 高表达组胃癌病人5 年累积生存率为28.85%,中位生存时间16.0 个月;LncRNA SNHG4低表达组胃癌病人5 年累积生存率为42.62%,中位生存时间27.0个月,log-rank检验差异有统计学意义(χ2=11.05,P<0.001)。
2.5 影响胃癌病人发生终点事件的单因素分析胃癌病人年龄、性别、肿瘤最大径、肿瘤位置与终点事件发生无关(P>0.05),临床分期、肿瘤分化程度、浸润深度、淋巴结转移与终点事件发生有关(P<0.05),见表2。
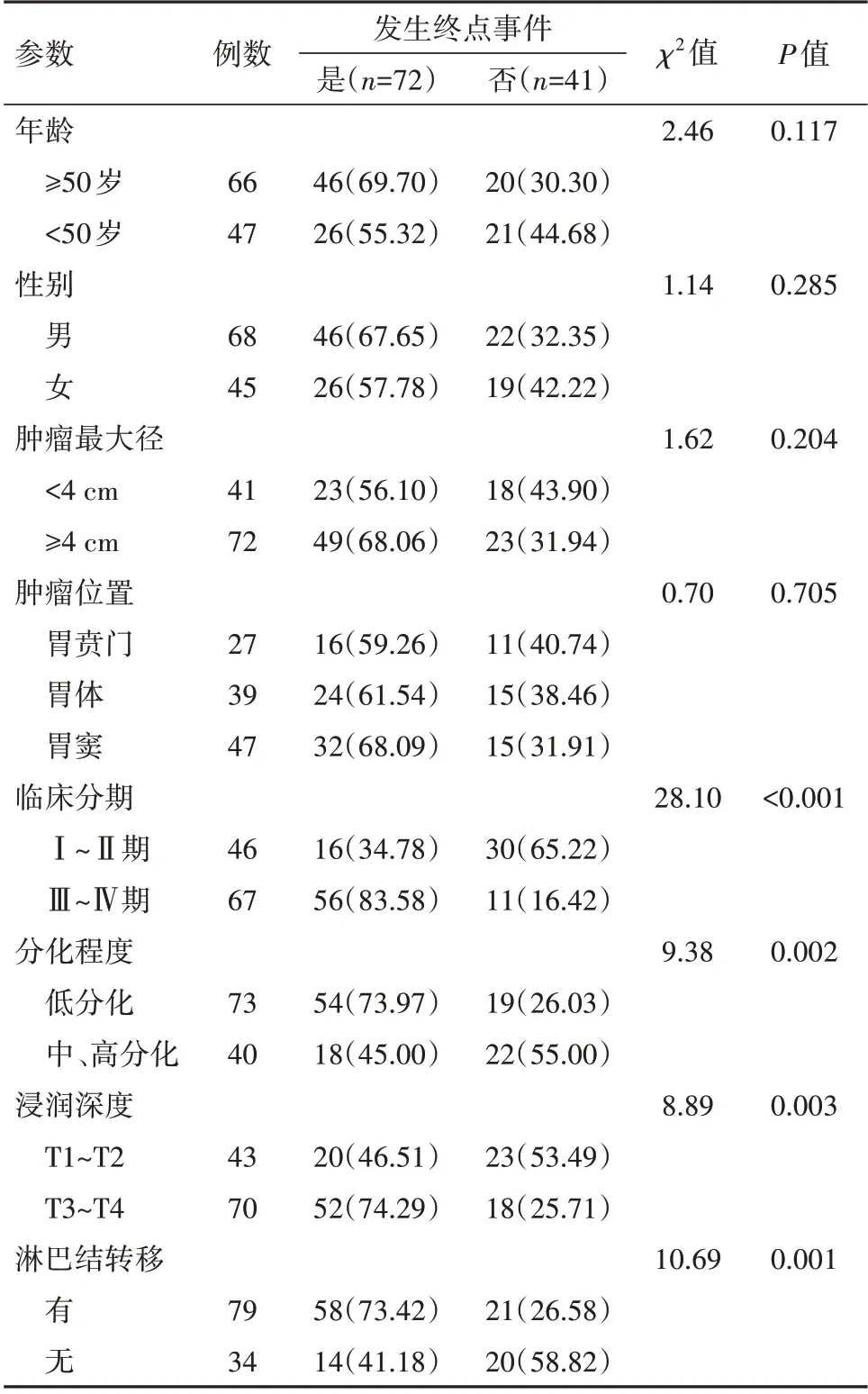
表2 影响胃癌病人发生终点事件的单因素分析结果/例(%)
2.6 影响胃癌病人预后不良的多因素Cox 回归分析将临床分期、肿瘤分化程度、浸润深度、淋巴结转移情况及LncRNA SNHG4 水平作为自变量进行多因素Cox回归分析,结果显示,临床分期Ⅲ~Ⅳ期、分化程度低、浸润深度T3~T4、淋巴结转移、Ln‑cRNA SNHG4高表达是影响胃癌病人预后不良的独立预测因素(P<0.05),见表3。
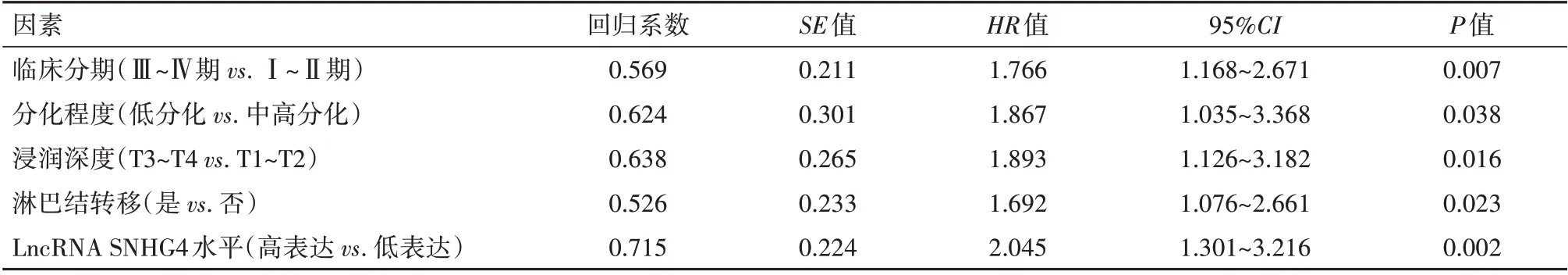
表3 影响胃癌病人113例预后不良的多因素Cox回归分析
3 讨论
胃癌的发生发展涉及多种基因共同作用,各个基因构成基因网络,通过调控肿瘤细胞增殖分化、迁移侵袭等生理病理过程参与胃癌进展各个阶段[7]。多项研究表明,基因的致癌作用主要是通过基因的转录和蛋白质编码实现的[8-10]。然而,最近研究发现,不到2%的人类基因组是编码基因,而超过90%的基因是在大多数系统中起调节作用的非编码基因,可在表观遗传修饰、转录和转录后等不同水平调控基因表达[11-12]。LncRNA 是一类长度超过200 bp 的功能性RNA 分子,由于缺失开放性阅读框而丢失编码蛋白功能,其在胃癌中的作用研究近年来成为热点。国内学者符伟玉等[13]通过细胞实验发现,利用LncRNA BC002811 构建的病毒载体在胃癌细胞中过表达,可提高肿瘤细胞的增殖能力。周士诚等[14]发现,LncRNA-C21orF96 在胃癌细胞中过表达能显著调控miR-875-5p 表达同时促进USF2 基因表达,促进胃癌细胞的侵袭和转移。另有报道称,LncRNA LOXL1-AS1 在胃癌组织和细胞中高度表达,其表达上调预示胃癌的预后不良,进一步研究发现LOXL1-AS1 通过诱导细胞增殖、迁移和上皮间质转化,加速胃癌肿瘤的恶化[15]。另有其他研究发现LncRNA 通过靶向调控miRNA 或蛋白表达,参与胃癌细胞的增殖、迁移等生理病理过程[16-17]。以上研究提示,多种LncRNA 参与胃癌的发展进程,然而LncRNA SNHG4在胃癌中作用尚缺乏研究。
随着研究的不断进展,LncRNA SNHGs 在消化道肿瘤中的作用越来越受到关注。SNHG1 作为SNORD22 的宿主基因,其位于染色体11q13,SNORD22 位于细胞核[18]。随后,SNHG3、SNHG5 等相继被报道。Wang 等[19]研究发现,SNHG7 在胃癌组织及细胞系中表达上调,体外实验证实抑制SN‑HG7 表达可明显抑制胃癌细胞增殖,促进细胞凋亡,细胞周期停滞在G1/G0 期,进一步研究发现SN‑HG7 可通过调节p15 和p16 表达部分参与胃癌的发生发展机制。本研究结果显示,LncRNA SNHG4 在胃癌组织中的表达水平明显高于癌旁正常胃黏膜组织,且其表达水平与病人临床分期、肿瘤分化程度、浸润程度、淋巴结是否转移有关,表明SNHG4在胃癌中呈高表达,可能发挥癌基因作用,并参与胃癌病人肿瘤细胞增殖、分化、迁移等病理过程,具体作用机制有待进一步体外细胞培养实验。Zhang等[20]利用TCGA 数据库评估了SNHG12 表达与胃癌病人临床病理特征及预后的关系发现,SNHG12 表达越高,肿瘤浸润深度越大,病人生存率越低;体外细胞实验发现SNHG12 通过激活磷脂酰肌醇3-激酶/AKT 通路诱导胃癌的发生。本研究进一步分析SNHG4 水平与胃癌病人生存时间的关系,结果显示,LncRNA SNHG4 高表达胃癌病人5 年累积生存率明显低于低表达病人;多因素Cox 回归分析结果显示,临床分期Ⅲ~Ⅳ期、分化程度低、浸润深度T3~T4、淋巴结转移、LncRNA SNHG4 高表达是影响胃癌病人预后不良的独立预测因素,LncRNA SN‑HG4 高表达病人预后不良风险是低表达的2.045倍,提示LncRNA SNHG4 表达水平与胃癌病人预后有关,可能作为胃癌病人预后的独立预测因子。
综上所述,LncRNA SNHG4 在胃癌组织中表达升高,与病人临床分期、肿瘤分化程度、浸润深度及淋巴结转移有关,其高表达是胃癌病人预后不良的独立预测因素,可能为胃癌病人预后评估提供参考。本研究仅在临床病理方面分析了的LncRNA SNHG4 表达差异,具体作用机制有待进一步细胞实验研究及验证。

