不同部位重复经颅磁刺激对脑卒中后抑郁患者的抑郁状态ATP酶活性及P300的影响
剡 军 王永正 赖彩琼
德阳市人民医院,四川 德阳 618000
2019 年Lancet 发表文章指出:脑卒中已成为中国发生率、致死率和致残率最高的疾病[1]。脑卒中后抑郁(post-stroke depression,PSD)是脑卒中后常见的并发症,流行病学显示18%~33%的脑卒中患者可能继发PSD[2]。根据《精神障碍诊断和统计手册》,PSD是指患者表现出除脑卒中症状以外的精神障碍综合征,包括抑郁情绪、兴趣缺失、睡眠障碍等临床表现[3]。PSD不仅阻碍脑卒中患者的康复训练,也影响患者后续生活质量,给家庭、社会带来巨大的经济负担,甚至严重威胁到患者生命。
经颅磁刺激是一种利用高强度时变的脉冲磁场作用于中枢神经系统,通过在大脑皮质产生动作电位,从而影响脑内代谢和神经电生理活动的一种磁刺激技术。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)可以连续对皮层进行程序化刺激,是一种非侵入性、无痛、安全的神经调控技术,现已在临床中得到广泛应用。临床研究显示rTMS 可以有效改善PSD 抑郁状态,提高患者的生活质量。BO RYUN KIM等[4]发现连续2周的高频rTMS刺激患者左侧DLPFC,能有效改善PSD 患者的抑郁状态,降低患者的抑郁量表得分。而国内亦有多项研究证明,高频rTMS 能缓解PSD 患者相关症状,上述研究刺激部位均选择左侧DLPFC[5-9]。然而,牛玉莲等[10]发现1 Hz 低频刺激PSD 患者右侧DLPFC,能有效降低患者的汉密尔顿抑郁量表(HAMD)得分,改善血清神经元特异性烯醇化酶(NSE)等相关指标。而与之相似的多篇研究也均选择低频刺激右侧DLPFC[11-12]。而通过文献检索,发现高频刺激左侧DLPFC与低频刺激右侧DLPFC的对比性研究较少[13],且存在观察指标简单,未引入实验室检查、电生理等客观指标;同时也没有将高频左侧DLPFC、低频右侧DLPFC以及双侧刺激DLPFC进行横向对比。为填补上述空白,本研究旨在观察不同部位rTMS在PSD患者中的临床疗效,并从ATP酶活性以及P300 电位的角度探讨其可能机制。
1 资料和方法
1.1 一般资料选取2019-09-2020-09在德阳市人民医院康复科就诊的123 例PSD 患者为研究对象。本研究通过了我院伦理审查(编号2018015),所有患者均已签署知情同意书。纳入标准:(1)符合第4 届脑血管病会议所制定的脑卒中的诊断标准[14],并经过头颅CT或MRI影像学核实;(2)符合《脑卒中后抑郁临 床 实 践 的 中 国 专 家 共 识》[14]诊 断 标 准;(3)HAMD-17评分>8分[15];(4)右利手;(5)为首次卒中,卒中前无抑郁症状;(6)病程小于6个月。排除标准:(1)伴严重脏器功能不全和(或)严重感染、恶性肿瘤者;(2)个人或家族有精神障碍和癫痫史者;(3)存在意识障碍、认知障碍以及表达沟通障碍者;(4)体内有金属内固定物或安装有心脏起搏器的患者。剔除和脱落标准包括:(1)治疗期间擅自接受其他有关治疗,未按本试验治疗方案进行治疗者;(2)自动出院或失访者;(3)治疗过程中出现严重不良事件者。采用SPSS 21.0生出的随机数字和序号分为左侧组、右侧组和双侧组各41例,研究过程中左侧组脱落2例,右侧组脱落4 例,双侧组脱落1 例,右侧组有1 例为rTMS 中诱发癫痫而剔除,其余为出院退出试验。最终左侧组39例,右侧组37例,双侧组40例。3组患者在性别、年龄、病程方面等无统计学差异,具有可比性,见表1。

表1 3组患者年龄、病程、性别比较Table 1 Comparison of age,course of disease and sex of patients in 3 groups
1.2 方法所有患者均接受常规的脑卒中药物治疗及常规康复训练(物理治疗、作业治疗等)。并且,针对PSD,3 组均接受口服舍曲林治疗,初始剂量为50 mg/d,1周后视患者情况可逐渐增加到100~200 mg/d,连续治疗6周。左侧组在上述治疗的基础上,采用高频rTMS 治疗。具体流程:患者取仰卧位或坐位,开机测量出静息运动阈值(rMT),将电极置于患者左手的小鱼际肌,肌肉完全放松后,在支配该肌肉的M1区给予较大强度的单次TMS,待记录到波形、潜伏期稳定的MEP后,逐渐降低刺激强度,肌电仪所记录的10次刺激中至少有5次能使左手小鱼际肌产生抽动的最小强度即为静息MT。治疗过程中,线圈与头皮相切,具体刺激部位为左侧背外侧前额叶皮质(DLPFC),线圈柄向后,设置好刺激参数之后开始治疗。具体参数:磁刺激强度为80%的静息运动阈值,频率为10 Hz,单个序列刺激时间4 s,刺激20 个序列,20 min/次。右侧组采用低频刺激患者右侧DLPFC。操作流程与左侧组一致,线圈与头皮相切选择右侧DLPFC,磁刺激强度为80%的静息运动阈值,频率为1 Hz,单个序列刺激时间4 s,刺激20个序列,20 min/次。双侧组即采用10 Hz 高频刺激左侧DLPFC 以及采用1 Hz 低频刺激右侧DLPFC,相关参数与前两组一致。3组的rTMS治疗均为1次/d,每周治疗5 d,连续治疗6周。
1.3 观察指标与判断标准在治疗前、治疗6 周后评估患者以下指标,评估员经过专门培训,且患者的分组情况对评估员设盲。
1.3.1 抑郁状态评估:采用HAMD-17量表评估患者的抑郁状态[16]。评分标准为:≤7分,无抑郁症状;8~17分,可能有轻度抑郁症;18~24分,可能有中度抑郁症;≥25分,可能有重度抑郁症。
1.3.2 神经功能评估:采用美国国立卫生院卒中量表(NIH stroke scale,NIHSS)[17]进行评估,该量表包括意识水平、凝视、视野、面瘫、上肢运动、下肢运动、肢体共济失调、感觉、语言、构音障碍、忽视共11个项目。0 分为无卒中症状;1~4 分为轻度;5~15 分为中度;16~20分为中重度;21~42分为重度。
1.3.3 生活质量评估:采用脑卒中专用生活质量量表(stroke specific quality of life scale,SS-QOL)进行生活质量评估[18],本量表总分在0~100 分波动,分值与生活质量呈正相关。
1.3.4 实验室检测:取患者空腹静脉血,以3 000 r/min转速离心约10 min,取血清,采用酶联免疫吸附方法检测S100β蛋白(S100β)、血清神经元特异性烯醇化酶(NSE)、瞬时受体电位通道1 蛋白(TRPC1)的水平;采用比色法检测血浆红细胞膜ATP 酶(Na+-k--ATP、Ca2+-Mg2+-ATP)的酶活性。
1.3.5 事件相关电位的视觉P300 指标:采用丹迪高速肌电诱发位仪keypoint 进行事件相关电位视觉P300测试,视觉P300由100张彩色图片构成,其中靶刺激和非靶刺激的比例为20 ∶80,记录P3 靶点的潜伏期和波幅。
1.3.6 不良事件记录:在试验期间,记录患者跟服用药物及使用rTMS 治疗相关的不良事件,包括恶心、呕吐、头痛、癫痫等。
1.4 统计方法采用SPSS 21.0进行统计,本研究计量资料符合正态分布采用均数±标准差(±s)表示,多组间比较采用方差分析,治疗前后组内比较采用配对t 检验,组间两两比较采用LSD 检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 相关量表评估结果治疗前,3 组HADM-17、NIHSS、SS-QOL 评分比较差异均无统计学意义(P>0.05);治疗6周后,3组指标均优于治疗前,差异有统计学意义(P<0.05);而双侧组在HADM-17、NIHSS两项评分优于其余2 组(P<0.05),在SS-QOL 评分3 组间差异无统计学意义(P>0.05),见表2。
表2 3组间HADM-17、NIHSS、SS-QOL评分比较(分,±s)Table 2 Comparison of HADM-17,NIHSS and SS-QOL scores among 3 groups (scores,±s)
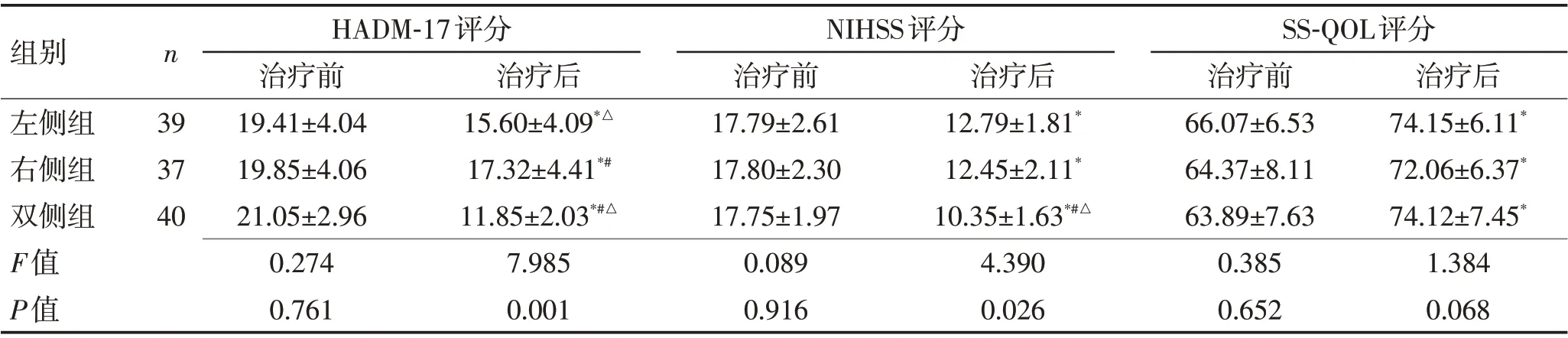
表2 3组间HADM-17、NIHSS、SS-QOL评分比较(分,±s)Table 2 Comparison of HADM-17,NIHSS and SS-QOL scores among 3 groups (scores,±s)
注:与治疗前相比,*P<0.05;与左侧组相比,#P<0.05;与右侧组相比,△P<0.05;
组别左侧组右侧组双侧组F值P值n 39 37 40 HADM-17评分治疗前19.41±4.04 19.85±4.06 21.05±2.96 0.274 0.761治疗后15.60±4.09*△17.32±4.41*#11.85±2.03*#△7.985 0.001 NIHSS评分治疗前17.79±2.61 17.80±2.30 17.75±1.97 0.089 0.916治疗后12.79±1.81*12.45±2.11*10.35±1.63*#△4.390 0.026 SS-QOL评分治疗前66.07±6.53 64.37±8.11 63.89±7.63 0.385 0.652治疗后74.15±6.11*72.06±6.37*74.12±7.45*1.384 0.068
2.2 实验室检查治疗前,3组各项指标比较差异均无统计学意义(P>0.05);治疗6 周后,除右侧组Na+-k--ATP酶活性一项指标外,3组各项指标均优于治疗前,差异有统计学意义(P<0.05);而双侧组在S100β、TRPC1、Na+-k--ATP、Ca2+-Mg2+-ATP优于其余2组(P<0.05),在NSE 指标双侧组仅优于右侧组(P<0.05),与左侧组无差异(P>0.05),见表3、4。
表3 3组间S100β、NSE、TRPC1比较(±s)Table 3 Comparison of S100β,NSE and TRPC1 among three groups between NSE and TRPC1 (±s)

表3 3组间S100β、NSE、TRPC1比较(±s)Table 3 Comparison of S100β,NSE and TRPC1 among three groups between NSE and TRPC1 (±s)
注:与治疗前相比,*P<0.05;与左侧组相比,#P<0.05;与右侧组相比,△P<0.05;
组别左侧组右侧组双侧组F值P值n 39 37 40 S100β/(ng/L)治疗前0.76±0.09 0.74±0.13 0.77±0.12 0.846 0.351治疗后0.53±0.08*△0.61±0.11*#0.47±0.09*#△4.364 0.026 NSE/(g/L)治疗前16.19±1.98 16.50±2.05 15.34±2.40 0.982 0.129治疗后10.32±1.55*△13.37±1.82*#9.84±1.63*△4.399 0.025 TRPC1/(ng/L)治疗前569.37±51.38 573.84±62.18 575.58±60.49 0.185 0.859治疗后653.94±60.35*△631.83±58.10*#682.37±53.45*#△6.836 0.003
2.3 视觉P300检查治疗前,3组P3靶点潜伏期和波幅的比较差异均无统计学意义(P>0.05);治疗6周后,除右侧组波幅外,3组两项指标均优于治疗前,差异有统计学意义(P<0.05);而双侧组在潜伏期和波幅均优于其余2组(P<0.05),见表5。
表5 3组间P3靶点潜伏期和波幅比较(±s)Table 5 Comparison of P3 target latency and amplitude between groups (±s)
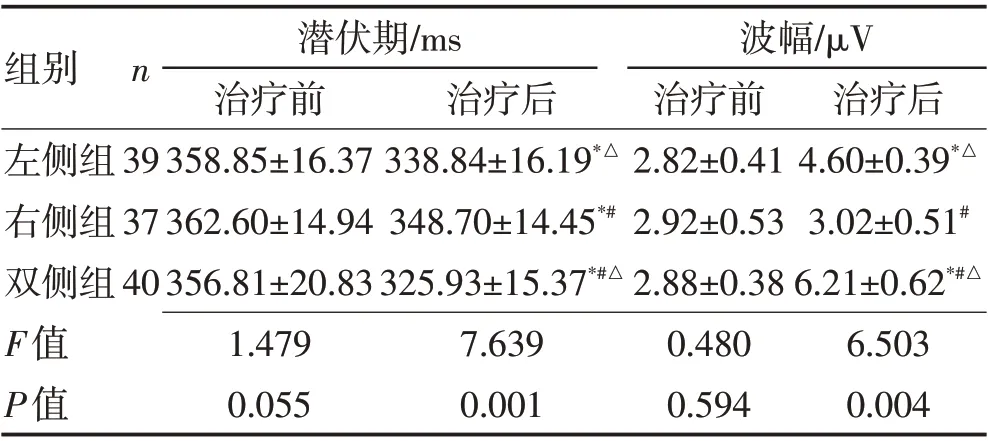
表5 3组间P3靶点潜伏期和波幅比较(±s)Table 5 Comparison of P3 target latency and amplitude between groups (±s)
注:与治疗前相比,*P<0.05;与左侧组相比,#P<0.05;与右侧组相比,△P<0.05;
组别左侧组右侧组双侧组F值P值n 治疗后4.60±0.39*△3.02±0.51#6.21±0.62*#△6.503 0.004 39 37 40潜伏期/ms治疗前358.85±16.37 362.60±14.94 356.81±20.83 1.479 0.055治疗后338.84±16.19*△348.70±14.45*#325.93±15.37*#△7.639 0.001波幅/μV治疗前2.82±0.41 2.92±0.53 2.88±0.38 0.480 0.594
表4 3组间血浆ATP酶活性比较(±s)Table 4 Comparison of plasma ATPase activity among 3 groups (±s)
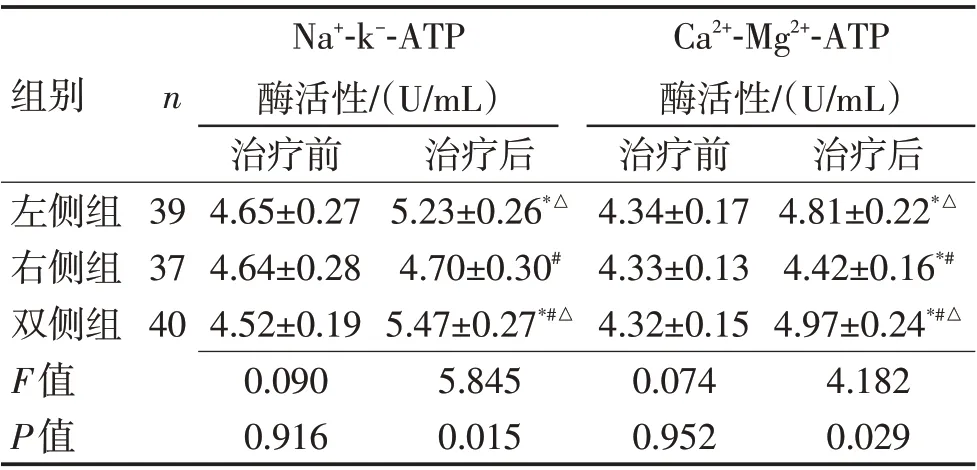
表4 3组间血浆ATP酶活性比较(±s)Table 4 Comparison of plasma ATPase activity among 3 groups (±s)
注:与治疗前相比,*P<0.05;与左侧组相比,#P<0.05;与右侧组相比,△P<0.05;
组别n左侧组右侧组双侧组F值P值39 37 40 Na+-k--ATP酶活性/(U/mL)治疗前4.65±0.27 4.64±0.28 4.52±0.19 0.090 0.916治疗后5.23±0.26*△4.70±0.30#5.47±0.27*#△5.845 0.015 Ca2+-Mg2+-ATP酶活性/(U/mL)治疗前4.34±0.17 4.33±0.13 4.32±0.15 0.074 0.952治疗后4.81±0.22*△4.42±0.16*#4.97±0.24*#△4.182 0.029
2.4 不良事件记录试验期间,3 组患者均未发生呕吐、恶心等严重不良事件。但左侧组有2例出现与rTMS治疗相关的轻微头痛,于第2天缓解。
3 讨论
PSD 是卒中常见并发症,表现为悲观、情绪低落、不积极进行康复训练。随着每年卒中人数增多,本病发病率亦在逐渐攀升。在过去多认为本病是患者卒中后由于躯体、家庭以及社会环境改变导致心理平衡失调从而引起一过性抑郁状态,因而容易在临床上被忽略。但研究发现,PSD 可严重影响患者的功能恢复以及后续的日常生活;因此现今PSD 也逐渐引起临床重视。PSD的治疗大致可以分为抗抑郁药物治疗和非药物治疗[19-22]。鉴于前者有诸多局限性,近年来非药物治疗的探索在逐渐加深,而rTMS作为近年发展起来的新型研究及治疗手段,具有无痛、无创、操作简单及安全可靠等优点,已经广泛运用在脑卒中后的肢体、认知、言语、精神等诸多障碍之中,但其中rTMS对PSD的具体刺激部位仍存在一定争议[23-27]。
现代解剖研究显示大脑边缘系统-前额叶皮质-纹状体-苍白球-丘脑神经解剖环路,特别是前额叶皮质与PSD的发生密切相关[21,28-30],其中,背外侧前额叶(DLPFC)是调节认知和情绪的重要脑区[22,31-33]。具体而言,右侧DLPFC主要调节令人沮丧的情绪,如低落或厌恶情绪;左侧DLPFC 则调节相对比较正面的情绪,如快乐开心。而过往对rTMS 的研究发现,低频rTMS主要作用是降低血流速度,抑制皮质兴奋性;相反刺激频率>5 Hz 的高频rTMS 主要作用是提高血流速度,增强皮质兴奋性[34-38]。因此,从理论上讲,通过高频刺激提高左侧DLPFC兴奋性以及通过低频降低右侧DLPFC兴奋性均可以改善抑郁状态。
首先,左侧组和右侧组对比显示,左侧组在HADM-17评分、各项实验室指标以及P300结果均优于右侧组。可见通过10Hz 高频rTMS 能更有效降低PSD 患者抑郁状态,此结果与多篇前人研究相一致[24-25,39-41]。DUBIN等[26]发现,高频rTMS更能有效地提高γ-氨基丁酸/谷氨酰胺神经递质释放,重建PSD神经通路。其次,本研究发现通过对高频刺激左侧DLPFC+低频刺激右侧DLPFC的联用方案,其效果更佳。且该结果的机制可能与提高PSD患者血浆中的Na+-k--ATP、Ca2+-Mg2+-ATP 酶活性有关。研究显示,卒中后脑组织的缺血血氧后可出现级联反应,即脑组织发生严重Ca2+内流紊乱,导致胞内Ca2+浓度升高,继而激活氨基酸毒性,诱发一系列病理反应,如炎症反应、细胞凋亡等,均是脑卒中后神经细胞死亡的共同通路。而本研究所观察的S100β是一种钙离子依赖蛋白,高表达代表神经毒性增强;TRPC1是一种抑郁保护因子,其低表达与钙超载诱发的细胞凋亡密切相关。可见,Ca2+内流紊乱是PSD 的前期环节。而Na+-k--ATP、Ca2+-Mg2+-ATP酶是维持细胞Na+、Ca2+内环境稳定的重要机制,其活性减低可促进Ca2+内流。同时,有学者表明,在内源性抑郁及阿尔兹海默病症伴随抑郁的患者中,抑郁的发生与Na+-k--ATP、Ca2+-Mg2+-ATP酶的活性降低密切相关[27]。结合本研究的实验结果,可提示高频+低频联用的rTMS 提高血浆中Na+-k--ATP、Ca2+-Mg2+-ATP 酶活性从而有效阻断级联反应、保护神经细胞是改善PSD患者抑郁状态的可能机制之一。最后,视觉P300 则从电生理的角度出发,进一步丰富本研究的观察维度。视觉P300包括N1、P2、N2、P3等诸多成分,其中P3 属于内源性成分,能反映情绪情感等高级大脑功能;而PSD患者常表现出波幅减低,潜伏期延长的变化[28]。而本研究通过高低频rTMS联用干预,结果显示双侧组在潜伏期均低于其余2组,波幅均高于其余2 组,差异有统计学意义(P<0.05),可见其电生理指标得到一定改善。综上所述,高低频rTMS联用能更有效改善PSD患者的抑郁状态及神经功能。
本研究存在不足之处在于,样本量不足,需要多中心、大样本的研究来进一步验证临床结果。同时,ATP 酶活性是本研究重要的切入点,但受血脑屏障的影响,rTMS 通过ATP 酶活性改善PSD 患者抑郁状态的作用机制还值得更多基础实验加以验证和进一步探讨。

