心肌肌钙蛋白I(cTnI)荧光免疫层析试剂研究
程涛
(安邦(厦门)生物科技有限公司,福建厦门 361028)
对于急性心肌梗死患者,发病90 min内为其最佳的时间窗,由于常规的心肌标志物检测需采集血液后送往实验室进行检测,此过程往往耗时较长,不利于患者诊断及预后[1]。荧光层析免疫试剂配合便携式分析仪器可以进行床旁采样、现场检测,此试剂程序简单、检测速度快,对于急诊科急性胸痛患者的诊断具有重要临床意义[2]。本研究研制了心肌肌钙蛋白 I(cTnⅠ)的荧光免疫层析试剂并进行了性能评价,报道如下。
1 材料与方法
1.1 材料与试剂
鼠抗cTnI单克隆抗体(clon1),珠海博美生物科技有限公司;羊抗cTnI多克隆抗体(clon2),菲鹏生物股份有限公司;荧光微球,200 nm,长沙美牛生物科技有限公司;硝酸纤维素膜,规格2.5 cm×100 m,默克化工技术(上海)有限公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC),纯度≥99%,酪蛋白钠盐(casein.Na),纯度≥95%,购自Sigma公司;磷酸氢二钠、磷酸二氢钠、氯化钠,分析纯,国药集团化学试剂有限公司;塑料卡,规格2 cm×10 cm,厦门欣海盛塑胶有限公司;玻璃纤维,杭州韩感科技有限公司。
1.2 仪器与设备
KQ-250DE型超声波清洗器,昆山市超声仪器有限公司;QB-128型旋转混匀仪,海门市其林贝尔仪器制造有限公司;TGL-20M型高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;HM3230型三维平面点膜喷金仪,上海金标生物科技有限公司;ZQ4200型数控感应斩切机,上海金标生物科技有限公司;AF-100型荧光免疫分析仪,安邦(厦门)生物科技有限公司。
1.3 方法
1.3.1 包被板制备
把硝酸纤维素膜和吸水纸依次粘贴在PVC板上。用磷酸盐缓冲液(pH=7.0)将羊抗cTnI多克隆抗体及羊抗兔IgG多抗稀释至1 mg/mL,以1 μL/cm的包被量包被于硝酸纤维素膜上,在湿度≤30%条件下干燥16~24 h,制备得cTnI包被板备用。
1.3.2 标记物制备
将1 mL荧光微球原液加入到9 mL PBS溶液中,超声30 s后以18 000 r/min的转速离心30 min,小心去除上清。加入10 mL PBS溶液,超声60 s,混匀。取0.4 mL的0.6 mg/mL EDC溶液加入到洗涤后的荧光微球溶液中,用旋转混匀仪混匀1 h,离心(18 000 r/min、30 min),小心去除上清。加入10 mL PBS溶液超声30 s混匀。以0.5 mg/mL蛋白浓度加入鼠抗cTnI单克隆抗体,在旋转混匀仪上混匀2 h。加入1 mL10%的BSA溶液进行封闭,旋转混匀仪上混匀14~18 h。18 000 r/min、离心30 min,小心去除上清,加入10 mL PBS溶液,超声60 s,标记完成,制得cTnI的标记物2~8 ℃条件下保存。以相同方法制备兔IgG荧光微球标记物。
1.3.3 标记物结合垫制备
用标记物稀释液稀释cTnI标记物和兔IgG标记物,终浓度为0.1 mg/mL,制得标记物喷涂溶液。使用喷金仪以1 μL/cm的喷量把标记物喷涂溶液固定在标记垫上。喷涂后,标记垫放置在湿度≤30%环境下晾干16~24 h。
1.3.4 样品垫制备
配制样品垫处理液,10 mmol/L PBS溶液(pH=7.4)中包含0.3 mg/mL的抗RBC和1%的casein.Na,取40 mL样品垫处理液加在玻璃纤维上,铺匀液体后在湿度≤30%环境下干燥16~24 h。
1.3.5 检测卡制备
在包被板上依次放置标记物结合垫和样品垫。组装好的检测板用数控感应斩切机切成4 mm宽的检测条,将检测条放在PVC塑料卡里面压紧,与干燥剂一起放在铝箔袋中封装保存。
1.3.6 试剂的定标
把国家标准物质和cTnI抗原分别用含有1%BSA的10 mmol/L PBS缓冲液(pH=7.0)稀释制成0.1 ng/mL、0.2 ng/mL、1.0 ng/mL、5.0 ng/mL、20.0 ng/mL和50.0 ng/mL 6个浓度点,用检测卡进行检测。信号值和浓度值使用四参数方程进行拟合,得到的标准曲线写入IC卡中。
1.3.7 试剂检测方法
血清的加样量为100 μL,全血的加样量为120 μL。反应15 min后进行读数。数据采用SPSS软件进行处理。
2 结果与分析
2.1 准确性
用cTnI国家标准品制备的参考品,浓度分别为0.3 ng/mL、10 ng/mL,每个浓度参考品均作为样本各检测3孔,检测3次,检测0.3 ng/mL参考品平均值0.295 ng/mL,相对偏差-1.67%;检测10 ng/mL参考品平均值10.38 ng/mL,相对偏差3.8%。
2.2 分析灵敏度
2.2.1 空白限(LoB)的建立
用空白样本(pH=7.0、10 mmol/L PBS溶液+1%BSA)进行检测,每天测试2次,每次重复测定2次,共测定20次。检测结果属于正态分布,平均值为0.017,标准偏差SD=0.004,空白限LoB=0.024。
2.2.2 检出限(LoD)的建立
选取5个低浓度样本,用试剂对各样本进行重复检测,每天检测5次,连续检测3 d,最终得到75个低浓度的结果,如表1所示。
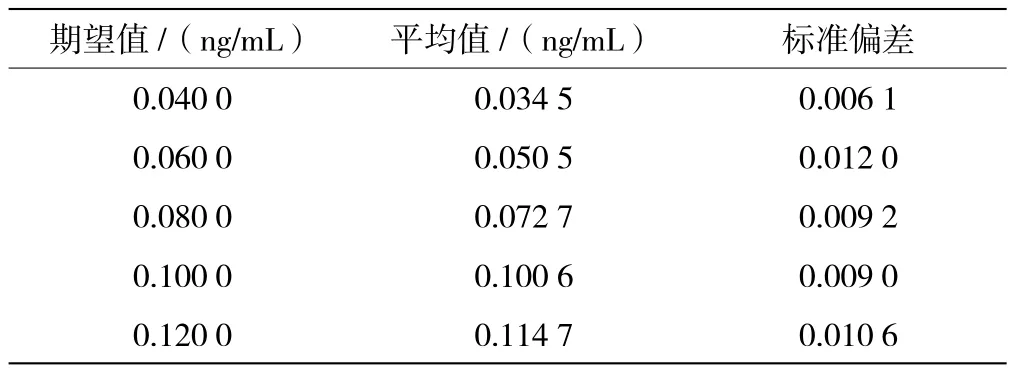
表1 低值样本测定结果(n=15)
根据检测结果进行统计分析:低浓度样本检测结果进行正态性检测,P=0.002<0.05,结果不呈正态分布,按非参数方法估计LoD。取0.07 ng/mL作为试剂的检出限。
2.3 精密性
取心肌肌钙蛋白I(cTnI)测定试剂盒(荧光免疫层析法),分别用浓度为0.3 ng/mL、10.0 ng/mL的参考品进行检测,每天检测1次,每次每个浓度平行检测2次,连续检测20 d,进行精密度分析;2个浓度参考品检测结果的变异系数分别是7.54%和9.00%。
2.4 特异性
心肌肌钙蛋白T(cTnT)、心肌肌钙蛋白C(cTnC)、骨骼肌型肌钙蛋白I(sTnI)分别用参考品稀释液进行稀释,制备成浓度为1 000 ng/mL的特异性样本;用试剂分别检测上述制备样本,每个样本平行检测3次。检测结果表明,在1 000 ng/mL浓度条件下,cTnI检测结果均<0.07 ng/mL,未出现非特异反应现象。
2.5 干扰试验
按照1 mL高、中、低浓度样本+0.1 mL PBS溶液(10 mmol/L、pH=7.0,含1% BSA)的方式制得对照样本,按照1 mL样本+0.1 mL干扰物溶液(3 850 μmol/L胆红素、440 mmol/L甘油三酯、22 g/L血红蛋白和16 500 IU/mL类风湿因子)的方式制得干扰样本。用检测试剂分别检测对照样本和干扰样本,计算与对照样本的相对偏差,结果见表2。由表2可知,干扰物在实验浓度条件下不影响样本检测结果。
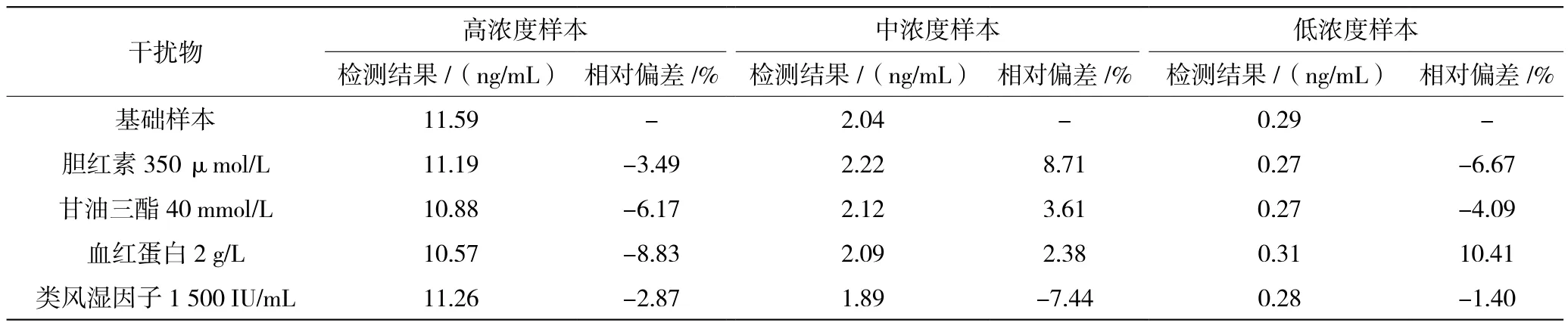
表2 干扰实验样本检测结果
2.6 线性范围
将cTnI抗原用参考品稀释液进行稀释,配制成系列浓度点。检测系列浓度点样本,每个样本测试3次,建立标准曲线方程。用该曲线方程计算浓度样本的测定值,以理论浓度(x)为自变量,以检测结果均值(y)为因变量进行线性回归,绘制出剂量反应曲线,确定线性范围。如图1所示,试剂线性方程y=1.001 7x-0.003 6,相关系数R2=0.999 9。因此,心肌肌钙蛋白I(cTnI)测定试剂盒(荧光免疫层析法)的线性范围为0.1~50.0 ng/mL。
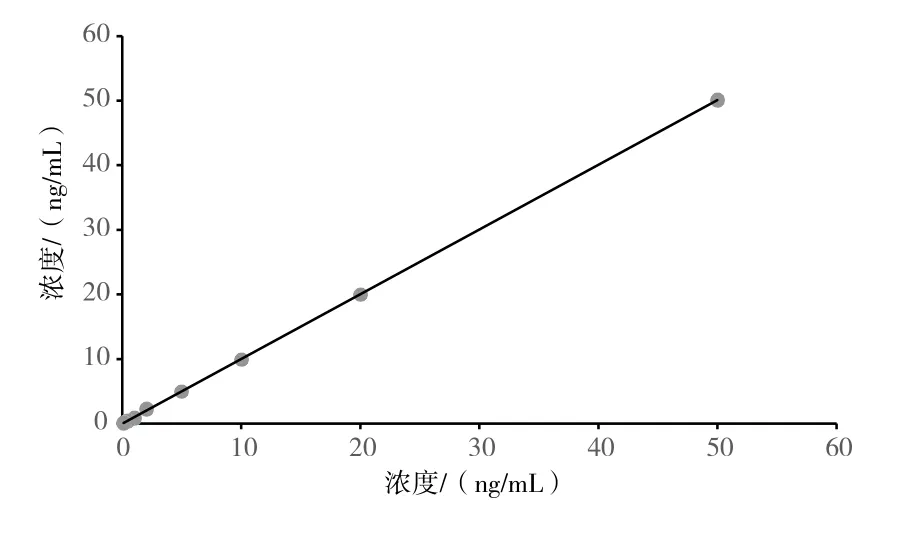
图1 浓度线性图
2.7 血清、血浆和全血检测对比
准备好6种不同颜色的真空采血管,用于采集血样制备血清、抗凝血浆样本,以红色采样管的血清样本结果为基准,比较其他血清、血浆样本对检测结果的影响,见表3。准备5组样本,红细胞压积分别为20%~30%、30%~40%、40%~50%、50%~60%及60%~70%。以血浆样本结果为基准,比较不同红细胞压积全血样本对检测结果的影响,见表4。结果显示,红细胞压积在30%~50%范围内对检测结果与血浆相比无显著性差异。常规的促凝剂采血管(橘红色)、惰性分离胶采血管(黄色)、肝素钠抗凝剂采血管(绿色)、EDTA-K2抗凝剂采血管(紫色)及枸橼酸钠抗凝剂采血管(蓝色)检测结果与血清管(红色)一致,不同采血管均不影响试剂的检测结果。
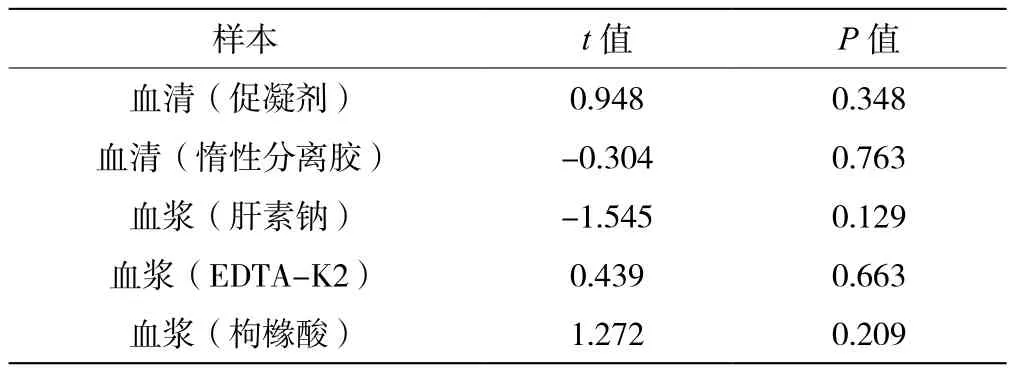
表3 血清与血浆样本检测结果
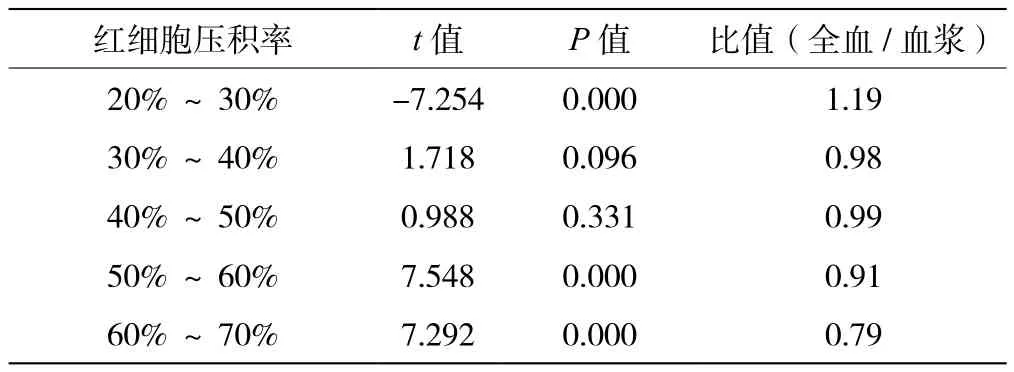
表4 不同红细胞压积率全血样本统计分析结果
2.8 临床性能验证
采用与已批准上市、临床普遍认为质量较好的产品进行同步盲法对比试验研究,考察考核试剂的临床应用性能与该已上市产品的等效性。104例样本的检测结果见表5。
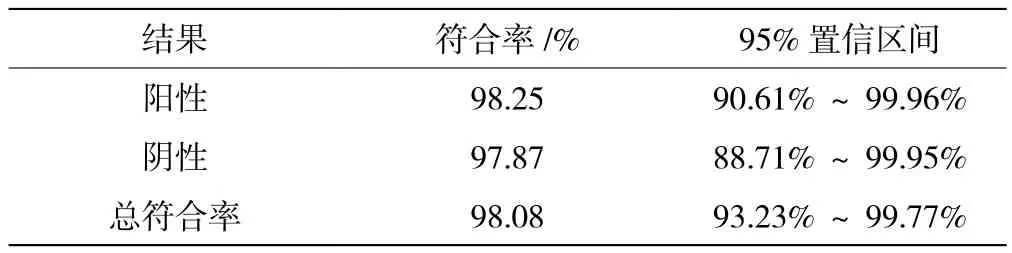
表5 104例样本检测结果的符合率
Bland-Altman一致性评价[3]:所有的点均在95%一致性界限以内;在一致性界限范围内,比值均在0.8~1.2,认为两种方法具有较好的一致性。
2.9 分段回归分析
分段回归分析结果如图2、图3。其中图2为对比试剂检测值<2的回归分析,图3为对比试剂检测值≥2的回归分析。
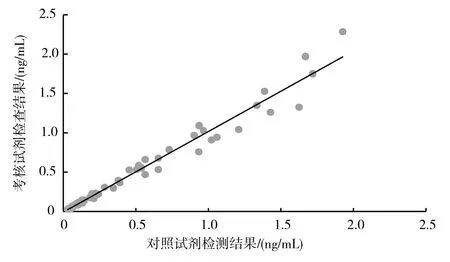
图2 考核试剂与对比试剂测试结果线性图(R2=0.971 6)
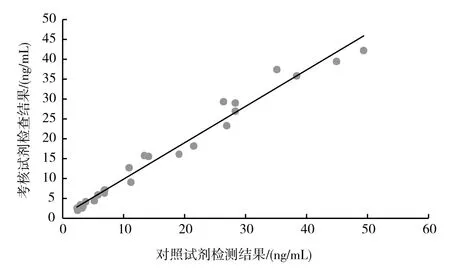
图3 考核试剂与对比试剂测试结果线性图(R2=0.978 8)
104例血清样本中,1例样本对比试剂检测结果为阳性,考核试剂检测结果为阴性;1例样本对比试剂检测结果为阴性,考核试剂检测结果为阳性;该2例样本两种试剂检测结果均在参考值附近,认为该样本属于临界值样本。本心肌肌钙蛋白I(cTnI)测定试剂盒(荧光免疫层析法)与已批准上市、临床普遍认为质量较好的产品的检测结果无统计学差异,并且具有高度一致性。
3 结论
近年来,我国急性心肌梗死的发病率越来越高,且发病逐渐年轻化。WHO推荐指南将心电图、cTnI等心肌酶谱检测视为临床诊断急性心肌梗死的金标准。在临床中,缩短急性心肌梗死的诊断时间对于患者预后具有重要的临床意义。对研制的cTnI荧光免疫层析试剂进行评价,结果表明该试剂准确度高,灵敏度好,抗干扰能力强,临床检测符合性好,作为化学发光试剂和其他同类型试剂的有益补充,可以在急诊科急性胸痛患者的诊断中发挥出重要的临床价值。

