广州人群尿液有机磷阻燃剂的暴露与健康风险
李晓静,李 琴,周金华,郭重山,钟 嶷*,余应新
广州人群尿液有机磷阻燃剂的暴露与健康风险
李晓静1,2,李 琴3,周金华3,郭重山3,钟 嶷3*,余应新2
(1.上海大学环境与化学工程学院,环境污染与健康研究所,上海 200444;2.广东工业大学环境科学与工程学院,环境健康与污染控制研究院,粤港澳污染物暴露与健康联合实验室,广东省环境催化与健康风险控制重点实验室,广东 广州 510006;3.广州市疾病预防控制中心,广东 广州 510440)
针对广州480名普通群众,利用尿液作为检测基质,研究人体内有机磷酸酯阻燃剂(OPFRs)代谢物的浓度水平,暴露的潜在来源,阐明其健康风险,并与其他包括邻苯二甲酸酯在内的多种有机污染物的健康风险对比筛选出高风险污染物.结果表明,广州居民体内普遍检出OPFRs代谢物,其平均浓度为6.59ng/mL,尤其是二-β,β-氯乙基磷酸,占总量的68.5%,是唯一检出率高于50%的OPFRs.OPFRs暴露水平受多因素影响,城区高于郊区,男性高于女性,短期内室内装修高于未装修,第三产业工作居民高于第一和第二产业,说明区域和性别以及生活和工作环境对OPFRs暴露有重要影响.非致癌健康风险评估发现,约25%的人群风险商高于1,存在非致癌健康风险,其健康风险与邻苯二甲酸酯相当.有41%的人群因OPFRs或邻苯二甲酸酯暴露存在非致癌风险,说明这2种污染物的暴露值得进一步关注.研究结果可为降低OPFRs污染物暴露带来的健康风险提供了数据基础.
有机磷阻燃剂;代谢物;人体暴露;健康风险;风险评估
有机磷酸酯阻燃剂(OPFRs)是一系列结构相似,大多数具有磷酸三酯结构的一类使用量很大的阻燃剂,约占有机磷系阻燃剂使用总量的20%[1],主要包含烷基、卤代烷基和芳香基取代的OPFRs[1-2].目前,已经在大气,水体,土壤,食物等各类环境介质中检测出OPFRs[3-6].OPFRs具有各类潜在的毒性,长期暴露磷酸三丁酯(TBP)会对神经系统造成损伤[7];三(1,3-二氯-2-丙基)磷酸盐(TDCIPP)和磷酸三苯酯(TPHP)具有内分泌干扰效应[8-9];代谢物二(1,3-二氯-2-丙基)磷酸酯(BDCIPP)和双(丁氧基乙基)磷酸酯(BBOEP)可能会干扰婴儿的生长[10-11].
OPFRs可通过呼吸,膳食和皮肤接触等途径进入人体,后在代谢酶的作用下,经过I相和II相代谢,可分别形成Ⅰ相脱卤,脱烷基和羟基化产物以及Ⅱ相葡萄糖酸等结合产物.动物实验表明,氯代烷基OPFRs(如TDCIPP和TCEP)暴露后能分别形成代谢产物BDCIPP和二-β,β-氯乙基磷酸(BCEP),同时,与葡萄糖醛酸结合的代谢产物也被检出[12].烷基类OPFRs,如TBP和磷酸三(2-丁氧基)乙酯,在动物和体外实验中均检出了代谢产物BBOEP及相关的羟基化产物和葡萄糖醛酸结合产物[13-14].芳香基类OPFRs,如TPHP,能够被代谢成二酯化合物磷酸二苯酯(DPHP)及其相关产物[15].作为溴系阻燃剂的优良替代产品,OPFRs目前还未受到严格的限制,人体暴露的OPFRs能够快速代谢生成的代谢物(mOPFRs),其人体暴露及健康风险的研究较少.
国内外学者常利用代谢产物mOPFRs来表明人体OPFRs暴露水平并阐明和健康的内在关联.通过尿液中mOPFRs和大气中OPFRs的关联研究发现,DPHP和BCEP与其母体化合物显著相关,大气中OPFRs是尿液中mOPFRs的潜在来源[16].类似的,有研究利用尿液中mOPFRs的浓度水平来评估OPFRs的摄入量,发现近期家中有装修的居民,其尿液中BDCIPP浓度要比其他人群高,这可能是因为家具耗材中的OPFRs释放环境或大气中,增加了人体暴露量[17].效应研究表明,血液中的磷酸二丁酯(DBP)和DPHP浓度与促甲状腺激素水平成正相关,DPHP和氧化应激标志物相关,表明mOPFRs的暴露在一定程度上与DNA损伤以及甲状腺功能破坏有关[18].相似的,母体尿液中BDCIPP和婴儿体重,脐带血中胰岛素和瘦素存在一定的相关性,说明BDCIPP可能具备一定的代谢干扰性[19].由于OPFRs的代谢产物和人体健康密切相关,评估其人体内暴露显得尤为重要.
本文采取直接进样-液相色谱/质谱联用测定广州480名普通人群尿液中的mOPFRs,分析其分布特征和可能暴露来源,结合健康体检参数和问卷调查信息,分析广州普通人群暴露OPFRs的影响因素,及其带来的健康风险,结合本文前期对其他有机污染物的研究[20],筛选出高风险化合物.
1 材料与方法
1.1 实验材料
OPFRs二酯代谢物标样包含双(1-氯-2-丙基)磷酸酯(BCIPP),BCEP,DPHP,BDCIPP,DBP和BBOEP以及同位素标记的内标8-BCEP,12-BCIPP,10-DPHP,10-BDCIPP,18-DBP和8-BBOEP均购自加拿大Toronto Research Chemicals公司.HPLC级甲醇,乙腈,二氯甲烷购自德国Merck公司.HPLC级乙酸购自中国上海安谱实验科技股份有限公司.分析纯盐酸购自中国国药控股有限公司.乙酸钠和磷酸二氢钾固体粉末购自美国Fisher Scientific公司. β-Glucuronidase/Arylsulfatase酶购自美国Sigma- Aldrich公司.
1.2 人群信息与样品采集
于2018年7月~8月,在广州4个区域(2个城区, XY和HT,2个郊区,CZ和DH)共采集480名普通居民(5~77周岁)尿液样本.经志愿者(未成年人由监护人)签订知情同意书后以调查问卷收集相关人体指标信息,包括身高,体重等指标,以及个人生活环境,日常活动和家庭情况等(表1).采集晨尿样品(50mL)于玻璃瓶,样品储存在装有干冰的盒子运送到实验室置于–20ºC冰箱冷冻保存,待进一步处理分析.
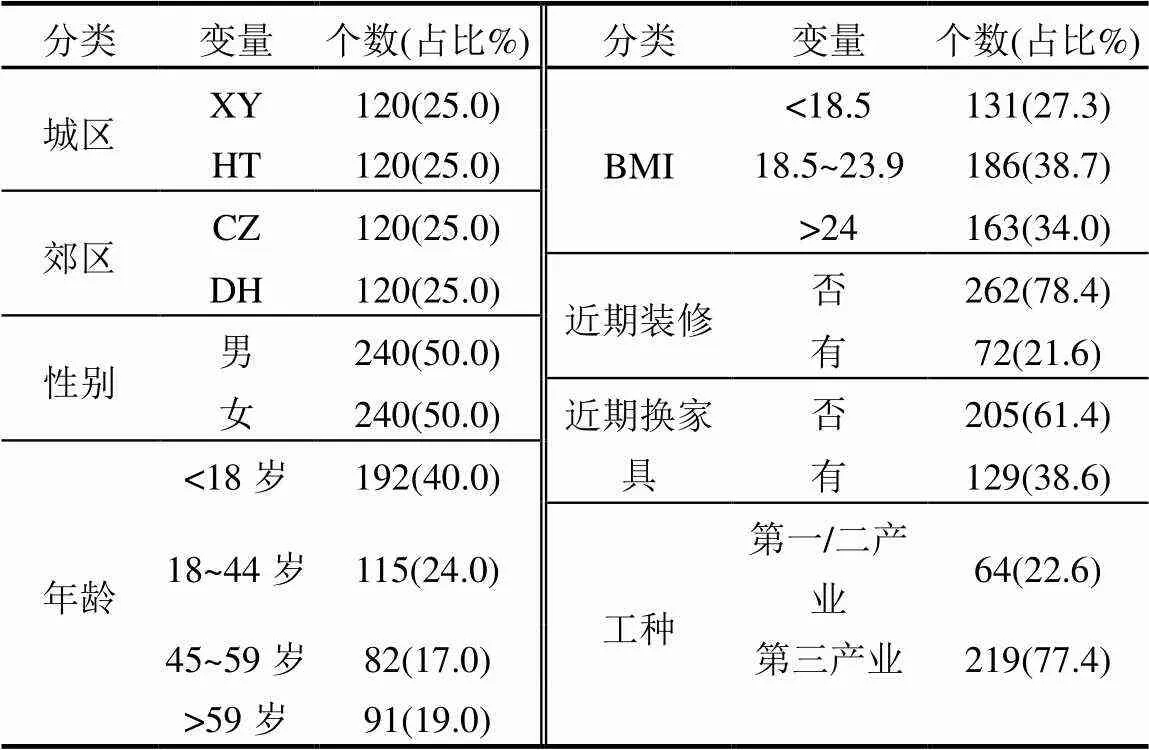
表1 人群基本信息
注:BMI为身体质量指数.
1.3 样品处理和仪器分析
将500μL尿液样品转移至EP管,加入一定量的内标物质,然后加入10μL β-葡萄糖醛酸苷酶/芳基硫酸酯酶,放置在37℃恒温震荡箱中过夜进行酶解,后加入500μL乙腈涡旋混匀并沉淀蛋白,然后将样品离心10min(转速12000r/min,4℃),转移上清液至进样瓶,样品于−20℃储存待分析.
mOPFRs采用Thermo Fisher的TSQ Endura高效液相色谱串联三重四极杆质谱联用仪进行测试.流动相A为含0.1%乙酸的水,B为甲醇,流速为0.3mL/min.梯度洗脱程序如下:10%甲醇保持0~ 1min,10%~40%甲醇保持1~2.5min.从40%~95%甲醇,保持2.5~4min, 95%甲醇保持4~6min,6~8min甲醇从95%下降到10%.进样量为2μL,柱温设定在40℃.TSQ Endura的操作参数如下:鞘气流速35unit,辅助气流速10unit.喷雾电压3500V,离子源温度320℃,离子传输管温度350℃.电离模式为负电离条件.使用Thermo软件Xcalibur处理原始数据.
1.4 质量控制
为了减少潜在的污染和干扰,实验中所用的玻璃器皿,使用前用清水洗干净,并在碱液中浸泡12h,自来水、超纯水清洗3遍后,烘干备用.非玻璃器皿耗材使用前依次用甲醇、二氯甲烷、正己烷分别润洗3次.每批20个样品中同时添加过程空白、溶剂空白和基质加标样品.基质加标样品中mOPFRs的回收率为89%~132%.标准曲线范围为0.01~ 1000ng/mL,所有目标物在范围内校准,且校准曲线的相关系数2都大于0.99.BCEP、BCIPP、DPHP, BDCIPP、DBP和BBOEP的仪器检出限(LOD)分别为0.609,2.000,0.187,1.355,0.111和6.00ng/mL,定量检出限(LOQ)分别为2.029,6.667,0.622,4.516,0.371和20.0ng/mL.
1.5 健康风险评估
为评估OPFRs暴露带来的健康风险,本文以非致癌效应为毒性终点,以每日总摄入量评估暴露量(TEDI),以风险商(HQ)评估其非致癌风险,以加和作用计算总风险商(HI),HQ或者HI大于1表示化合物对人类健康构成潜在非致癌风险,其计算公式如下:
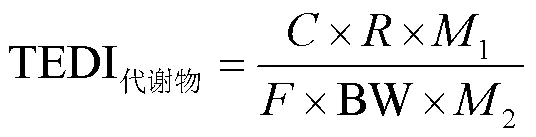
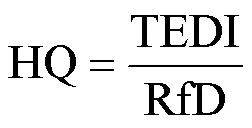
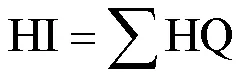
式中:TEDI[μg/(kg-BW×d)]为每个OPFR的每日摄入量;为尿液中mOPFR的浓度,ng/mL;为24h尿液排出量,L/d;BW为体重,kg;表示尿液中mOPFR排出量占其母体总摄入量的比例,本文以0.18计算[21]; RfD为参考剂量,其中各化合物的参考剂量如下: BCEP,2.2μg/(kg-BW×d);BCIPP,5μg/ (kg-BW×d);DPHP,7μg/(kg-BW×d);BDCIPP,1.5μg/(kg-BW×d);DBP,2.4μg/(kg-BW×d);BBOEP,1.5μg/(kg-BW×d).1和2则分别代表母体及其代谢物的分子量, g/mol.
为了筛选广州人群人体有机物污染物暴露的高风险污染物,结合本文前期工作包括羟基多环芳烃,邻苯二甲酸酯代谢物,对羟基苯甲酸酯,二苯甲酮,三氯生等污染物的暴露[20],综合评估并筛选高风险污染物.本研究用蒙特卡罗模拟用来评估健康风险的不确定性和变异性,并做累积分布曲线.HQ分布基于,和BW参数的变化,经检验,,和BW分布呈现对数正态分布(几何均值;几何标准偏差),离散均匀分布(最小值;最大值)和威布尔分布(刻度;形状),其中浓度参数(ng/mL)对羟基苯甲酸酯:对数正态分布(268;26561);二苯甲酮:对数正态分布(0.64; 0.27);双酚:对数正态分布(788:771032);三氯生:对数正态分布(6.36;5.40);羟基多环芳烃:对数正态分布(37.5; 81.26);邻苯二甲酸酯代谢物:对数正态分布(0.83:1.26);有机磷酸酯代谢物:对数正态分布(0.27; 0.27);尿液体积(L/d):离散均匀分布(1159:2552);体重(kg):威布尔分布(81.29;4.95).输出结果是在Crystal Ball©(Oracle, Redwood City, CA, USA)进行60000次试验计算得出.
1.6 数据统计与分析
化合物的最终浓度以ng/mL表示,通过Thermo Xcalibur对原始谱图进行积分并带入标准曲线计算每个样本的实际浓度.数据图表使用SPSS 21.0和Origin 9.0进行统计分析.若化合物浓度低于LOD,则按未检出处理;高于LOD但低LOQ且检出率小于50%则按照1/4LOQ计算,大于50%按照1/2LOQ计算.本文大样本方差之间的相关性采用Spearman参数,变量之间的差异性采用 Jonckheere-Terpstra和Mann-Whitney U检验分析,统计显著性水平设定为<0.01和<0.05.
2 结果与讨论
2.1 mOPFRs的检出率与浓度水平
总体上,mOPFRs的检出率为70.4%,其中BCEP的检出率最高(62.9%),其他单体化合物的检出率在3.1%~21.9%之间(表2).就不同区域而言, BCEP在XY、HT、CZ和DH的检出率分别为73.3%、81.7%、51.7%和45%.这个检出率略高于其他国家(表3),如比利时,加拿大和澳大利亚:本研究中DPHP,BDCIPP和BBOEP的检出率低于其他研究结果.
广州地区居民尿液中mOPFRs平均浓度为6.59ng/mL,其中浓度最高的化合物为BCEP(4.51ng/ mL),其次依次为DBP(1.14ng/mL), DPHP (0.29ng/ mL), BDCIPP(0.29ng/mL), BCIPP (0.23ng/mL)和BBOEP(0.12ng/mL).4个地区各单体化合物浓度差异小,但是DH地区BDCIPP和BBOEP未检出.与其他地区对比(表3),本研究中BCEP浓度最高,且高于武汉以及加拿大安大略省等地区;浓度排第2位的DBP与其他地区相比仍处于偏高水平,而BDCIPP和DPHP总体上处于中等水平.
2.2 mOPFRs的组成特征和来源分析
在所有区域中,BCEP均占比最高,整体占比达到68.5%,其他单体依次为DBP(17.3%),BDCIPP (4.45%), DPHP(4.44%), BCIPP(3.50%)和BBOEP (1.82%) (图1).不同区域组成上略有差异,如CZ区DBP的组成比例略高(26.7%),而DH区BDCIPP和BBOEP未检出.Chen等[22]也有类似发现,BCEP和DBP是最丰富的2种化合物.BCEP在mOPFRs中的高贡献主要是由于其母体化合物磷酸三氯乙基酯(TCEP)的大量使用.据报道,广州是TCEP的重要生产基地[4].
为进一步分析mOPFRs的潜在来源,研究了mOPFRs之间的相关性(表4).结果表明,mOPFRs各单体存在较强的相关性,例如:BCIPP和BDCIPP (<0.01)、BCIPP和BBOEP(<0.01),BDCIPP和BBOEP(<0.01)等.说明这些mOPFRs 可能有共同的来源或暴露途径,BBOEP和DPHP的母体化合物经常在制造业中充当增塑剂或润滑剂,且其在生物体中的代谢途径相似[23].通常OPFRs是混合一起添加在各种消费品中,如TCIPP(BCIPP的母体化合物)和TPHP(DPHP的母体化合物)常混合添加至聚氨酯泡沫中[24].本研究中BCIPP和多种mOPFRs有较强的相关性就说明了它们来源相似.然而,本研究中含量最高的化合物BCEP和其他化合物相对弱相关关系,说明BCEP也可能存在着其他的暴露来源或者多因素的影响.BCEP的母体TCEP是应用最广泛的一种OPFR,常见于塑料、纺织品、墙纸、聚氨酯泡沫、聚氯乙烯等产品中[1],由于其水溶性较强,能够存在于各种环境介质中,因此,其来源也相对广泛,可通过各种途径进入人体[1,25-26].
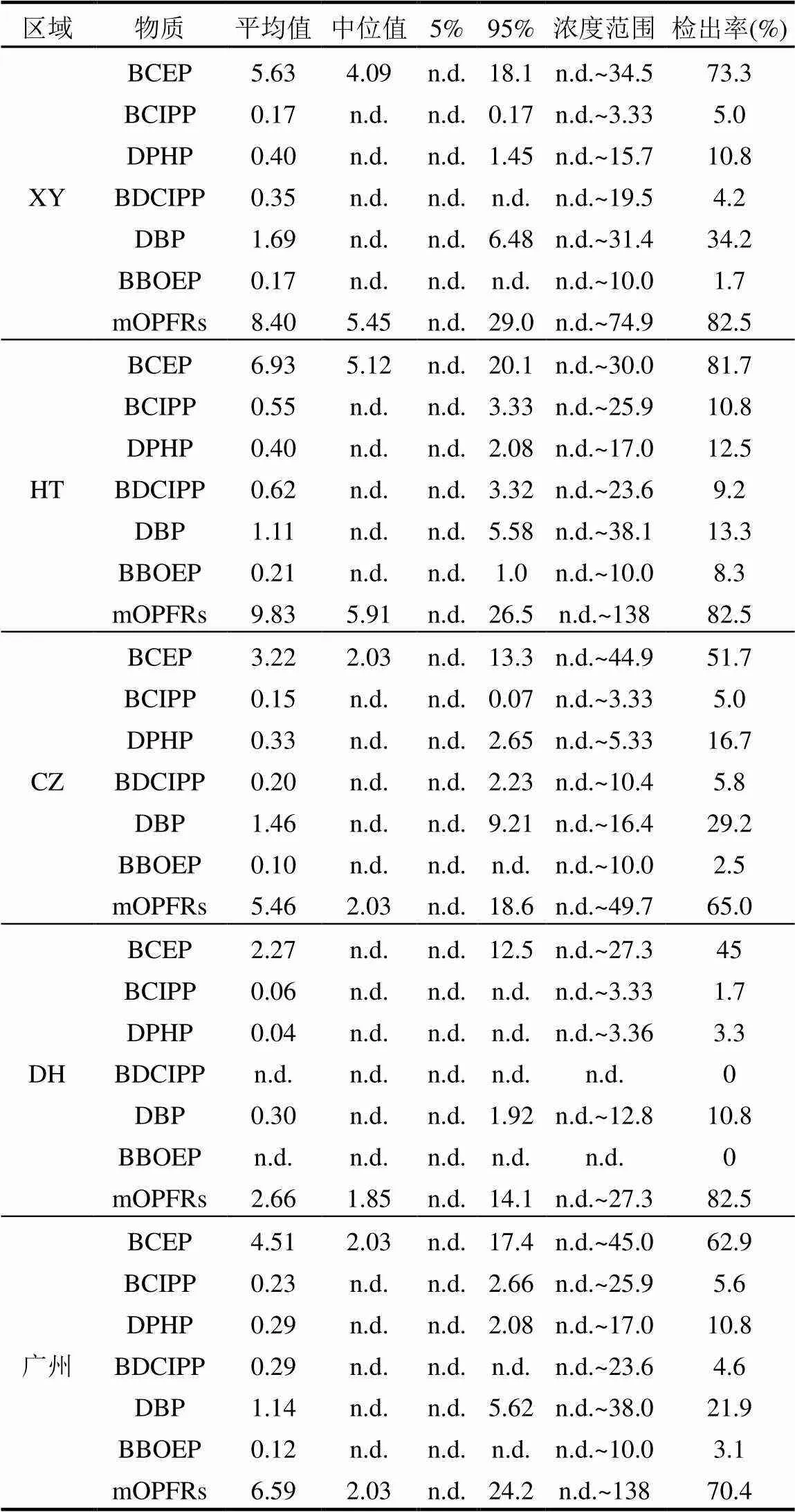
表2 广州普通人群尿液中mOPFRs浓度水平(ng/mL)
注:n.d为未检出.
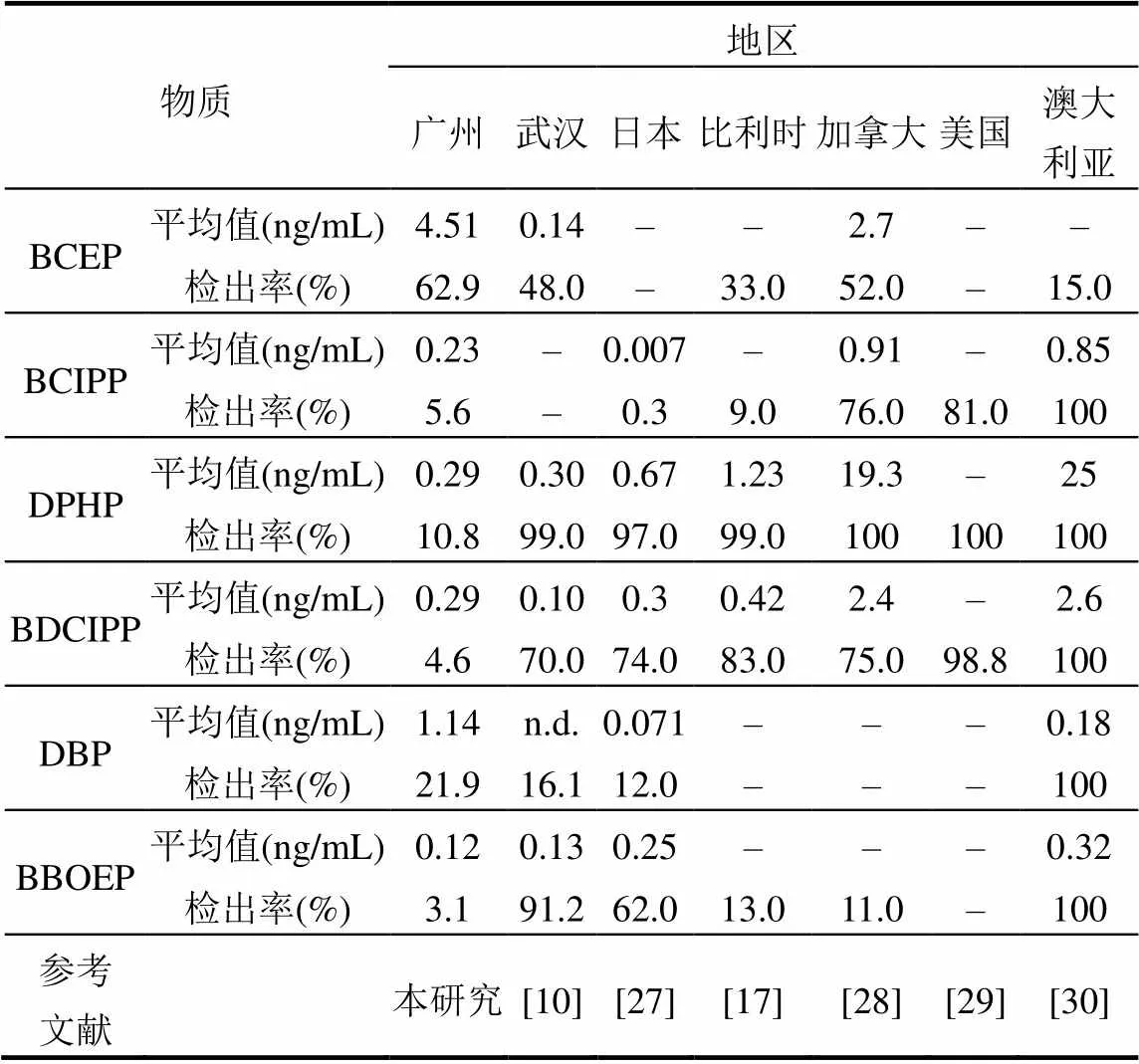
表3 不同地区人群尿液mOPFRs浓度比较
注:n.d为未检出;-为无数据.
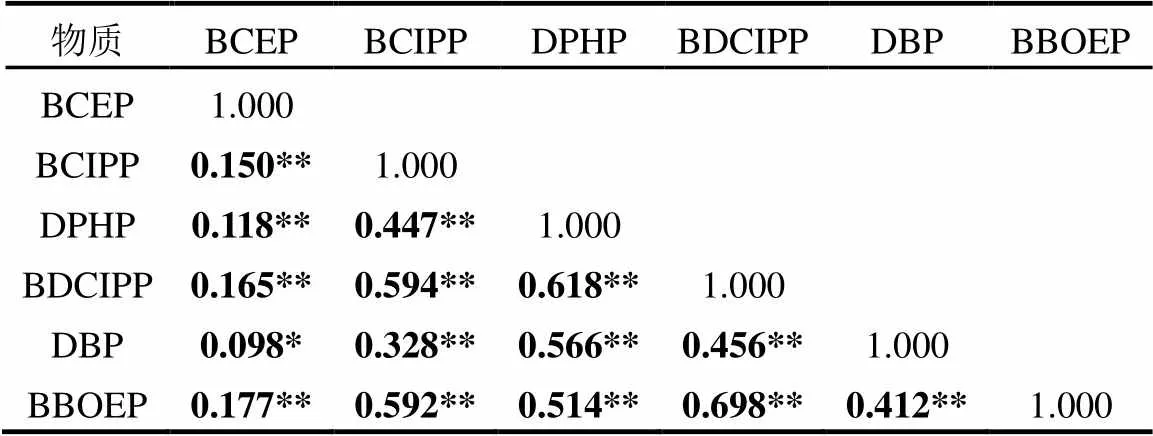
表4 广州普通人群尿液中mOPFRs各个化合物相关系数
注:**表示<0.01;*表示<0.05.
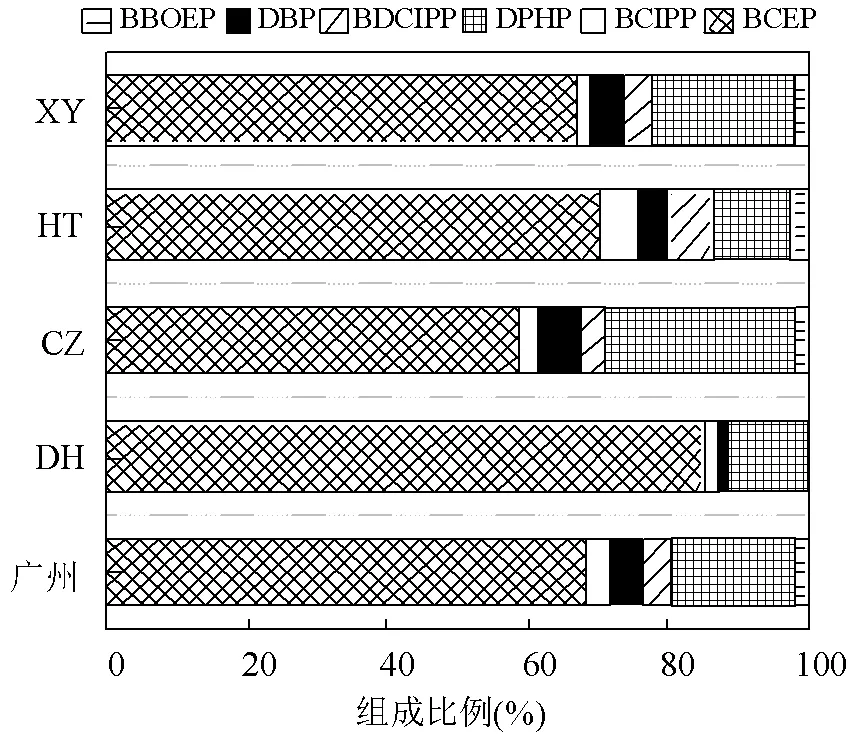
图1 广州普通人群尿中mOPFRs的组成分布
2.3 影响mOPFRs暴露水平的因素
分析了mOPFRs与采样区域,性别,年龄和身体质量指数(BMI)之间的关系与差异,并深入分析了居住和生活环境可能带来的影响.结果表明,城郊居民尿液样品中mOPFRs浓度之间有显著差异,城区高于郊区(<0.01)(图2a),特别是BCEP,城区居民尿液中BCEP的平均浓度为6.27ng/mL,而郊区为2.73ng/mL.这可能主要是由于BCEP的原型化合物TCEP大量用于建筑物的屋顶隔热材料以及丙烯酸树脂,胶粘剂和隔音涂料等,而城区人口密度大,建筑材料的使用量显著高于郊区,增加了TCEP的暴露量.类似的城乡差异也有报道,如Sun等[31]研究发现,商业区居民尿液中DPHP和BBOEP浓度远远高于住在工业区和农业区的居民,且不同区域之间差异显著(=0.014).与城乡差异类似,性别之间也存在统计学差异(<0.05)(图2b),男性尿液中mOPFRs的平均浓度为7.40ng/mL,显著高于女性尿液(5.77ng/mL) (图2b).对于单个化合物来说也有类似差异(如BCEP),这可能是因为男性和女性生活习惯,行为上差异等因素导致.例如,男孩玩玩具接触频率一般比女孩多,成年人男性工作场所环境可能比女性污染严重.类似结果也有文献报道,尤其是BCEP[32].此外,也有相反的文献报道,即女性尿液中的mOPFRs比男性高,表现在DPHP、TEHP和BCDIPP,研究认为这可能是女性使用的个人护理品中有添加这类物质所致[30].
与上述情况不同,本研究未发现年龄和BMI的影响(图3c和d),不同组别之间浓度水平无显著性差异.这与Hoffman等的报道不同,其发现尿液中mOPFRs和年龄存在显著的负相关关系,婴儿尿液中的BDCIPP和DPHP浓度要比成人高[24];类似地,在Van den Eede等[14]的研究中,儿童尿液中浓度高.其认为可能是儿童日常玩具中含有OPFRs,在手-口接触作用下经口暴露导致浓度升高.
为了进一步研究影响mOPFRs浓度的因素,本研究分析了室内装修、从事行业的可能影响(图3e).由于OPFRs在生物体中的半衰期较短,如TPHP等在鱼体、大鼠体内半衰期约0.7~100h[23],尿液中的mOPFRs反映了近期的暴露.结果表明,近期有家庭装修的群体其尿液中mOPFRs平均浓度(7.97ng/mL)高于未装修人群(6.47ng/mL).除BCEP外,其余mOPFR单体化合物浓度都存在这种情况.但是,本研究未发现近期是否换家具对mOPFRs浓度的影响.这说明,BCEP的来源不是室内装修材料,而其他mOPFRs母体化合物与家具无关的一些日常装修材料有关.同时,研究发现,志愿者从事职业属性对其尿液中的mOPFRs影响较大,从事第三产业相关职业的人体尿液中mOPFRs的浓度为从事第一或者第二产业相关职业人群的2倍,甚至10倍(图3e).由此可见,日常工作环境对人体OPFRs暴露的影响很大.
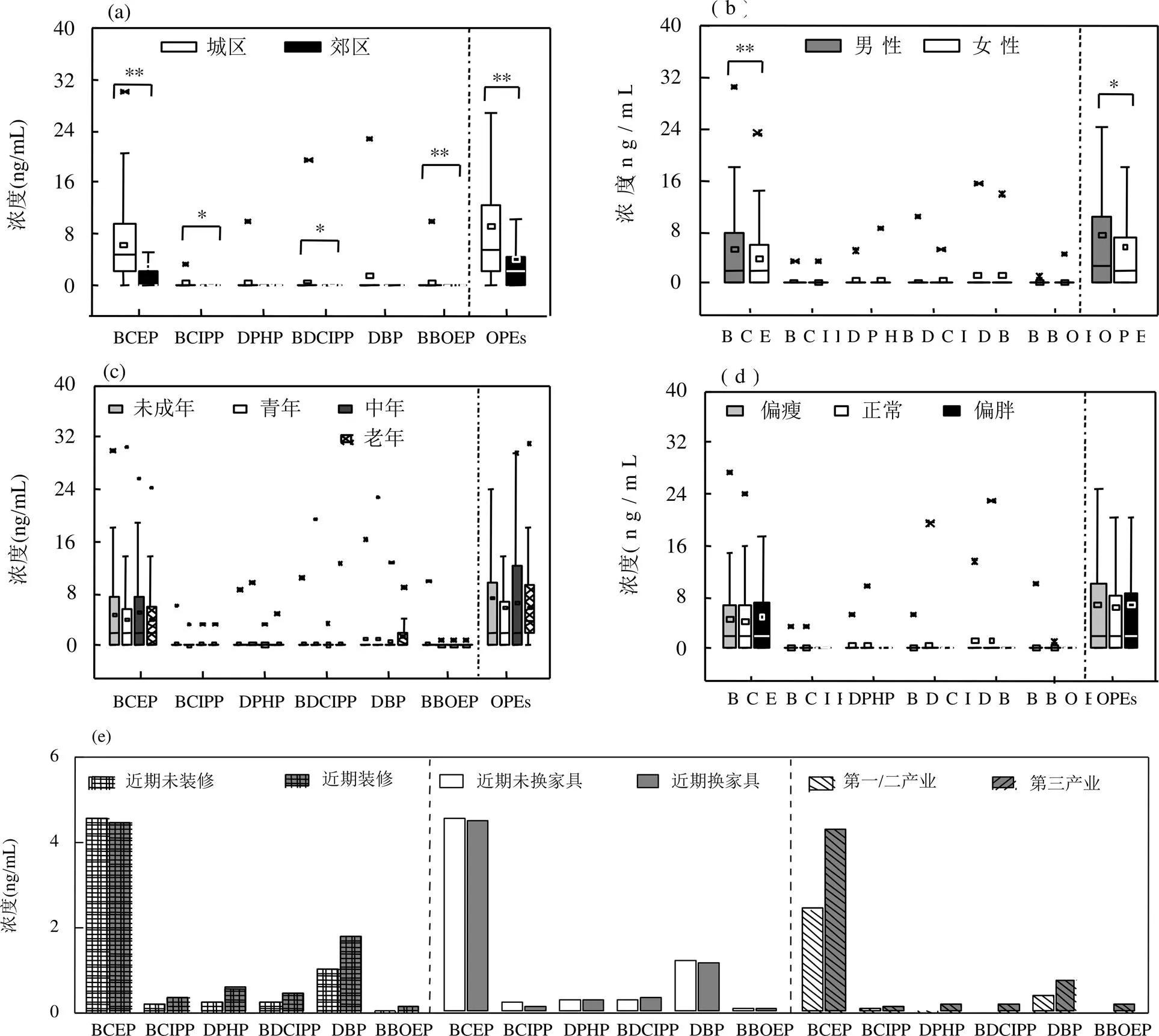
图2 不同因素条件下尿液中mOPFRs暴露水平的差异
2.4 人体暴露健康风险评估
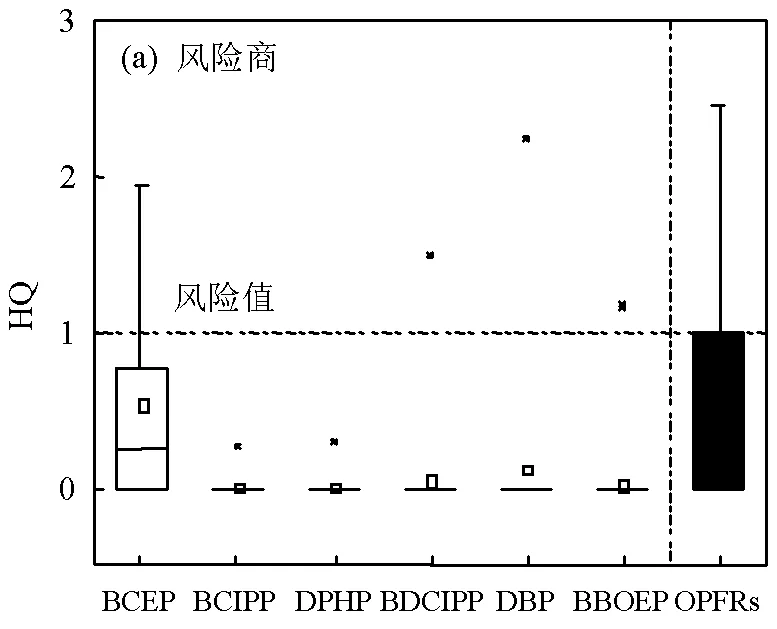
为了解这些人群因OPFRs暴露带来的健康风险,本研究采用HQ和HI值进行分析,当HQ值<1,说明某OPFR单体暴露超过可接受风险,存在潜在非致癌风险,而当HI值<1,说明OPFRs总暴露存在潜在非致癌风险.结果表明(图3a),BCEP,BCIPP, DPHP,BDCIPP,DBP和BBOEP的HQ平均值分别为0.54,0.012,0.012,0.054,0.13和0.025,累积风险系数HI平均值为0.77,均未超出风险限值1.mOPFRs的HQ范围为0~8.8,95%分位值为2.74,HQ超出1,说明部分人存在一定的健康风险,尤其是BCEP暴露,其HQ的95%分位值为2.05.为分析居民整体健康风险水平,本文给出了累积概率分布(如图3b),在480名志愿者中,有24.6%的人因OPFRs暴露可能带来潜在非致癌风险.对于BCEP暴露,考虑到在这些志愿者中,其检出率超过50%,达到了62.9%,有19.0%的人因BCEP暴露存在潜在非致癌风险,BCEP的人体暴露与健康风险值得人们进一步关注.
为了进一步分析OPFRs带来的健康风险,本研究与其他污染物(包括对羟基苯甲酸酯、双酚类、多环芳烃、三氯生、邻苯二甲酸酯等)暴露进行对比.结合本文前期对相同人群尿液中这些污染物分析[20],基于lg(HQ)值进行蒙特卡罗模拟概率累积曲线分析(图3c),结果表明,这些志愿者中有25.4%人因为邻苯二甲酸酯的暴露而存在非致癌风险,与OPFR的24.6%相当.而在这些人中,有41.0%的人邻苯二甲酸酯或OPFRs暴露超过风险水平.其他化合物未超过非致癌健康风险水平.由此可见,广州相当一部分人因为邻苯二甲酸酯和OPFR的暴露而存在非致癌风险,由这两种污染物导致的非致癌健康风险值得关注.
3 结论
3.1 OPFRs代谢物在人体中普遍存在,检出率达到70%, BCEP是主要的单体化合物,浓度为4.51ng/mL. OPFRs暴露来源受多种因素影响,人体暴露OPFRs呈现出城乡差异和性别差异,居住环境以及工作环境对OPFRs人体暴露有重要影响.
3.2 健康风险研究结果表明,有约25%的人体暴露OPFRs超过健康风险限值,与邻苯二甲酸酯暴露带来的健康风险相当.整个群体中约41%人暴露OPFRs或邻苯二甲酸酯超过可接受风险,存在非致癌风险,因此这两种污染物导致的非致癌健康风险值得关注.
[1] Van der veen I, De Boer J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012,88:1119–1153.
[2] Gao D W, Wen Z D. Phthalate esters in the environment: A critical review of their occurrence, biodegradation, and removal during wastewater treatment processes [J]. Sci. Total Environ., 2016,541:986– 1001.
[3] Chen P, Zhong Y, Chen K C, et al. The impact of discharge reduction activities on the occurrence of contaminants of emerging concern in surface water from the Pearl River [J]. Environ. Sci. Pollut. Res., 2020, 27:30378–30389.
[4] Liu Y E, Luo X J, Corella P Z, et al. Organophosphorus flame retardants in a typical freshwater food web: Bioaccumulation factors, tissue distribution, and trophic transfer [J]. Environ. Pollut., 2019,255(2): 113286.
[5] Sha B, Dahlberg A K, Wiberg K, et al. Fluorotelomer alcohols (FTOHs), brominated flame retardants (BFRs), organophosphorus flame retardants (OPFRs) and cyclic volatile methylsiloxanes (cVMSs) in indoor air from occupational and home environments [J]. Environ. Pollut., 2018,241:319–330.
[6] 刘 琴,印红玲,李 蝶,等.室内灰尘中有机磷酸酯的分布及其健康风险[J]. 中国环境科学, 2017,37(8):2831–2839.
Liu Q, Yin H L, Li D, et al. The distribution and health risk of organophosphates in indoor dust [J]. China Environmental Science, 2017,37(8):2831–2839.
[7] Auletta C S, Weiner M L, Richter W R. A dietary toxicity/oncogenicity study of tributyl phosphate in the rat [J]. Toxicology, 1998,128: 125–134.
[8] Dodson R E, Van den Eede N, Covaci A, et al. Urinary biomonitoring of phosphate flame retardants: Levels in california adults and recommendations for future studies [J]. Environ. Sci. Technol., 2014, 48:13625–13633.
[9] Rosenmai A K, Winge S B, Moller M, et al. Organophosphate ester flame retardants have antiandrogenic potential and affect other endocrine related endpoints in vitro and in silico [J]. Chemosphere, 2021,263:127703.
[10] Luo D, Liu W, Wu W X, et al. Trimester-specific effects of maternal exposure to organophosphate flame retardants on offspring size at birth: A prospective cohort study in China [J]. J. Hazard. Mater., 2021,406:124754.
[11] Zhao Y, Ding J, Lv L, et al. Exposure to organophosphate flame esters during early pregnancy and risk of spontaneous abortion: A case- control study [J]. Chemosphere, 2020,268:12937.
[12] Burka L T, Sanders J M, Herr D W, et al. Metabolism of tris(2- chloroethyl) phosphate in rats and mice [J]. Drug Metab. Dispos., 1991,19:443–447.
[13] Suzuki T, Kondo K, Uchiyama M, et al. Some sulfur-containing metabolites of tri-n-butyltin chloride in male rats [J]. J. Agr. Food Chem., 1999,47:4791–4798.
[14] Van den Eede N, Heffernan A L, Aylward L L, et al. Age as a determinant of phosphate flame retardant exposure of the australian population and identification of novel urinary pfr metabolites [J]. Environ. Int., 2015,74:1–8.
[15] Su G Y, Letcher R J, Crump D, et al. In vitro metabolism of the flame retardant triphenyl phosphate in chicken embryonic hepatocytes and the importance of the hydroxylation pathway [J]. Environ. Sci. Tech. Let., 2015,2:100–104.
[16] Qin R X, Tang B, Zhuang X, et al. Organophosphate flame retardants and diesters in the urine of e-waste dismantling workers: associations with indoor dust and implications for urinary biomonitoring [J]. Environ. Sci. Proc. Impacts, 2021,23(2):357–366.
[17] Bastiaensen M, Gys C, Colles A, et al. Exposure levels, determinants and risk assessment of organophosphate flame retardants and plasticizers in adolescents (14~15years) from the Flemish Environment and Health Study [J]. Environ. Intern., 2021,147:106368.
[18] Yao Y M, Li M Q, Pan L Y, et al. Exposure to organophosphate ester flame retardants and plasticizers during pregnancy: Thyroid endocrine disruption and mediation role of oxidative stress [J]. Environ. Int., 2021,146:106215.
[19] Kuiper J R, Stapleton H M, Wills-Karp M, et al. Predictors and reproducibility of urinary organophosphate ester metabolite concentrations during pregnancy and associations with birth outcomes in an urban population [J]. Environ. Health-Glob, 2020,19(1):155.
[20] Li X J, Zhong Y, He W Y, et al. Co-exposure and health risks of parabens, bisphenols, triclosan, phthalate metabolites and hydroxyl polycyclic aromatic hydrocarbons based on simultaneous detection in urine samples from guangzhou, south china [J]. Environ. Pollut., 2021,272:115990.
[21] Fromme H, Lahrz T, Kraft M, et al. Organophosphate flame retardants and plasticizers in the air and dust in German daycare centers and human biomonitoring in visiting children [J]. Environ. Int., 2014, 71:158–163.
[22] Chen Y, Fang J Z, Ren L, et al. Urinary metabolites of organophosphate esters in children in south china: Concentrations, profiles and estimated daily intake [J]. Environ. Pollut., 2018,235: 358–364.
[23] Hou R, Xu Y P, Wang Z J. Review of opfrs in animals and humans: Absorption, bioaccumulation, metabolism, and internal exposure research [J]. Chemosphere, 2016,153:78–90.
[24] Hoffman K, Butt C M, Chen A, et al. High exposure to organophosphate flame retardants in infants:Associations with baby products [J]. Environ. Sci. Technol., 2015,49:14554–14559.
[25] Castorina R, Butt C, Stapleton H M, et al. Flame retardants and their metabolites in the homes and urine of pregnant women residing in california (the chamacos cohort) [J]. Chemosphere, 2017,179:159– 166.
[26] Wang Y, Hou M M, Zhang Q N, et al. Organophosphorus flame retardants and plasticizers in building and decoration materials and their potential burdens in newly decorated houses in china [J]. Environ. Sci. Technol., 2017,51:10991–10999.
[27] Bamai Y A, Bastiaensen M, Araki A, et al. Multiple exposures to organophosphate flame retardants alter urinary oxidative stress biomarkers among children: The hokkaido study [J]. Environ. Int., 2019,131:105003.
[28] Siddique S, Harris S A, Kosarac I, et al. Urinary metabolites of organophosphate esters in women and their relationship with serum lipids: An exploratory analysis [J]. Environ. Pollut., 2020,263:114110.
[29] Hammel S C, Zhang S, Lorenzoa A M, et al. Young infants’ exposure to organophosphate esters: Breast milk as a potential source of exposure [J]. Environ. Intern., 2020,143:106009.
[30] He C, Toms L M L, Thai P, et al. Urinary metabolites of organophosphate esters: Concentrations and age trends in australian children [J]. Environ. Int., 2018,111:124–130.
[31] Sun X W, Li D K, Liang H, et al. Maternal exposure to bisphenol a and anogenital distance throughout infancy: A longitudinal study from shanghai, china [J]. Environ. Int., 2018,121:269–275.
[32] Bokhorst C L, Bakermans-kranenburg M J, Fonagy P, et al. The importance of shared environment in mother–infant attachment security: a behavioral genetic study [J]. Child. Dev., 2003,74:1769– 1782.
Urinary metabolites of organophosphorus flame retardants in Guangzhou population: Exposure and health risk.
LI Xiao-jing1,2, LI Qin3, ZHONG Yi3*, ZHOU Jin-hua3, GUO Chong-shan3, YU Ying-xin2
(1.Institute of Environmental Pollution and Health, School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China;2.Guangdong, Hong Kong and Macao Joint Laboratory of Pollutant Exposure and Health, Guangdong Key Laboratory of Environmental Catalysis and Health Risk Control, Institute of Environmental Health and Pollution Control, School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006, China;3.Guangzhou Center for Disease Control and Prevention, Guangzhou 510440, China)., 2022,42(3):1410~1417
This article was aimed at the 480general population in Guangzhou, using urine as a test matrix to study the concentration levels of metabolites of organophosphate flame retardants (mOPFRs), the potential sources of exposure, and clarified their health risks. Among the co-exposure with other organic pollutants such as phthalates, we tried to identify the chemicals with the highest health risks.The results showed that the mOPFRs were detectable in Guangzhou residents overall, with an average concentration of 6.59ng/mL. The bis(2-chloroethyl) phosphate accounted for 68.5% of the total mOPFRs, and was the only mOPFR with detection frequency higher than 50%. A number of factors influenced the levels of mOPFRs. The urban areas had a higher level than the suburban areas, and the levels of mOPFRs in males were higher than those in females. Besides, more mOPFRs were detected in interior decoration than in undecorated areas in the short term, and the levels were higher in workers in the tertiary industry than in primary and secondary industries. Our results also observed a correlation between OPFR exposure levels and region, gender, living, and working environment. Non-carcinogenic risk assessment showed that approximately 25% of the population had a risk quotient higher than a unit, which suggested potential non-carcinogenic risks. The non-carcinogenic risks of phthalates were consistent with that calculated based on the data in the literature. There were 41.0% of the general population had a potential non-carcinogenic risk from exposure to OPFRs and phthalates, suggesting that we should pay more attention to these chemicals. Our current study provided data basis for reducing the health risks caused by these pollutants.
organophosphorus flame retardants;metabolites;human exposure;non-carcinogenic risks;risk assessment
X503.1
A
1000-6923(2022)03-1410-08
李晓静(1990-),女,江苏连云港人,博士,研究方向为环境有机污染物与人体健康风险评估.发表论文7篇.
2021-08-04
国家自然科学基金资助项目(41991311,41977303)
*责任作者, 研究员, 13794425389@139.com

