桑属植物总RNA的提取及花青素合成基因MCHS的鉴定
李姣玉,邢玉薪,姚悦璠,刘开创,康少博,杨 艳
(1.太原科技大学 化学与生物工程学院,山西 太原 030006;2.福建农林大学 生命科学学院,福建 福州 350000;3.哈尔滨医科大学 生命信息学院,黑龙江 哈尔滨 150000)
植物组织中总RNA 的提取是分子生物学研究的基本手段之一,基因获得、cDNA 文库、Northern 印迹、基因转录调控等现代生物技术手段均需以高质量的RNA 为前提。目前的RNA提取方法有Trizol、CTAB法、SDS-酚等,但目前桑科植物总RNA 提取报道相对较少[1-2]。桑果中含有大量的花色素苷类物质,该物质具有防止UV、病原菌对植物产生伤害,调节生长素在植物体内的运输,消除动植物细胞内氧自由基、消炎、抗癌等多种功能[3]。
研究表明,类黄酮等花色素的生物合成途径包含3 个阶段。首先,苯丙氨酸脱氢酶(Phenylalanine dehydrogenase,PAL)催化苯丙氨酸为肉桂酸,经肉桂酸-4-羟基化酶(Cinnamic acid 4 hydroxylase,C4H)、4-香豆酰辅酶A 连接酶(4-Coumarate coenzyme A ligase,4CL)催化,生成香豆酰辅酶A(P-Coumaroyl-CoA);其次,查尔酮合成酶(Chalcone synthase,CHS)催化香豆酰辅酶A 和丙二酰辅酶A(Malonyl-CoA)生成柚皮素查尔酮,即查尔酮,查尔酮再经查尔酮异构酶(Chalcone isomerase,CHI)催化转化成柚皮素;最后,黄烷酮3-羟化酶(Flavanone 3-hydroxylase,F3H)进一步催化为二氢黄酮醇化合物,在二氢黄酮醇还原酶(Dihydroflavonol 4-reductase,DFR)、花青素合成酶(Anthocyanidin synthase,ANS)催化作用下,分别形成天竺葵素、矢车菊素和翠雀素等物质。报道表明,CHS、CHI 和F3H 是花青素形成所必需,其抑制或过表达均会影响植物最终的花色及抗逆性状态等[3],见图1。
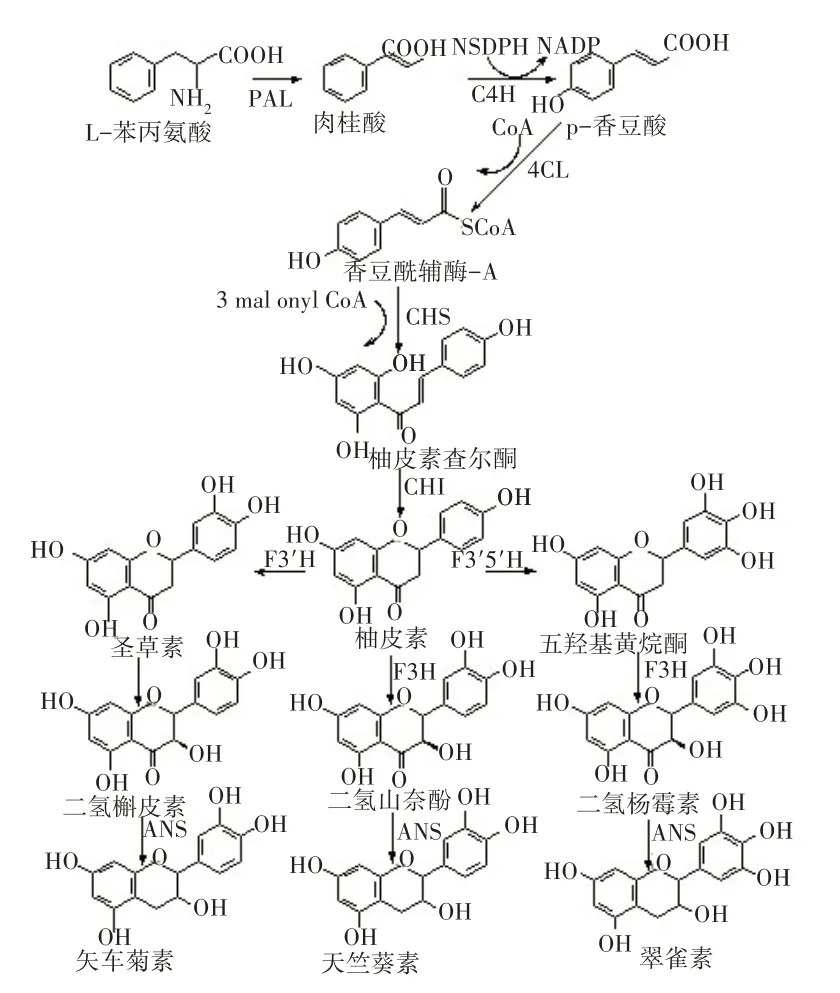
图1 花青素生物合成途径Fig.1 The biosynthesis pathway of anthocyanins
本研究以桑叶及果实为试验材料,通过改进和优化的Trizol 法提取其RNA 并克隆桑叶MCHS基因或类似MCHS基因本研究以桑叶及果实为试验材料,并改进优化Trizol 法提取RNA 及克隆桑叶MCHS基因,其不仅有助于从分子水平研究桑科类黄酮代谢机制,还为研究MCHS的进化、桑葚花青素提取、合成与鉴定等提供基础。
1 材料和方法
1.1 试验材料及试验用品处理
样品:新鲜桑叶及其果实。5 月底—7 月初,采集于太原科技大学南校区,-80℃冰箱保存备用,用于总RNA提取。
试验所用试剂均由灭菌的0.1%DEPC水配制;研钵、玻璃器皿等由0.1%DEPC 水处理24 h后,进行20~30 min的高压灭菌;氯仿、苯酚等药品均为分析纯;Trizol 试剂为上海生物工程有限公司产品;逆转录试剂盒PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)购自宝生生物有限公司。
本试验所用PCR引物根据收录于NCBI上的桑科CHE设计,NCBI 登录号:KT630885,具体序列见表1,引物序列由北京华大基因有限公司合成。
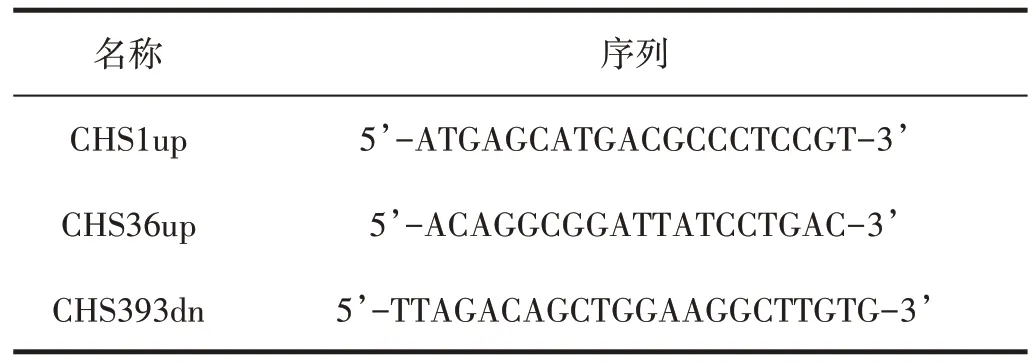
表1 扩增MCHS基因引物序列Tab.1 Primer of MCHS gene
1.2 试验方法
1.2.1 Trizol法提取总RNA
取0.1 g新鲜样品放入液氮预冷的研钵中,边加液氮边研磨,直至细粉状为止;预先在离心管中加入1 mL Trizol 溶液,迅速将研磨好的细粉加入离心管中;立即用振荡器振荡2 min,随后在室温下振荡10 min,静止数秒后,放入冰箱冷藏,使温度降为4℃,离心5 min,转速为12 000 rpm;预先在新离心管中加入200 μL 氯仿,将上清液迅速转移至离心管,立即振荡2 min,随后在室温下振荡5 min,静置2 min后,放入冰箱冷藏,使温度降为4 ℃,然后离心10 min,转速为12 000 rpm;于新离心管中加入200 μL 氯仿,将上清液迅速转移至离心管,快速振荡15 s,放入冰箱冷藏,使温度降为4℃,然后离心10 min,转速为12 000 rpm;预先在新的离心管中加入500 μL异丙醇,将上清液迅速转移至离心管,缓慢颠倒离心管;-80℃下沉淀1h;从冰柜中取出含有RNA 沉淀的离心管,在4℃的条件下离心10 min,转速为12 000 rpm,小心弃上清;随后加入1 mL 75%乙醇,振荡器振荡,在4℃下离心5 min,转速为12 000 rpm,小心弃上清,短暂离心后用移液枪吸去剩余上清,超净台自然干燥2 min,加入16 μL DEPC 处理后重新溶解。
1.2.2 RT-PCR扩增MCHS基因
使用Takara 公司的PrimeScript ™RT reagent Kit with g DNA Eraser 试剂盒,将所提取的桑叶总RNA 反转录为cDNA并以该cDNA 为模板进行PCR 检测,PCR 引物为反应体系为(20 μL)为:10×PCR buffer 4.5 μL,2.5 mmol/L dNTP 2.0 μL,上游引物(10 μmol/L)2.0 μL,下游引物(10 μmol/L)2.0 μL,Taq DNA 聚合酶(5U/μL)0.5 μL,反转录产物2 μL,ddH2O 9 μL。反应程序为:95℃预变性5 min,95℃变性1 min,55℃退火30 s,72℃延伸1 min 20 s,30 个循环;72℃延伸10 min,4℃保存备用。取5 μL 扩增产物,经1.0%琼脂糖凝胶电泳,观察记录结果。
1.3 总RNA的完整性及质量检测
1.3.1 电泳检测
DEPC 水稀释TAE 后,取2 μL 的RNA 样品与1 μL 溴酚蓝混合后进行0.8%琼脂糖凝胶电泳,电泳时间为30 min,电压为100 V,在紫外凝胶成像系统上对RNA 条带的清晰度和完整性进行观察,并拍照记录。
1.3.2 RNA质量检测
参照奥斯伯等的方法,取10 μL总RNA溶液,加DEPC 水稀释至1 mL,分别在230 nm、260 nm 和280 nm 处测量吸光值。并计算A260/A280、A260/A230的比值。
RNA产量(μg)=RNA浓度(μg/mL)×VDEPC-H2O(mL)
2 结果与讨论
2.1 Trizol法提取的桑叶及果实中总RNA的质量分析
见图2,使用Trizol 法从桑叶及桑葚中均可以提取出总RNA,但通过电泳分析发现,在条带完整性和强度上,从叶和果中获得的RNA 存在差别。果实中因糖、酚含量较高,28 s和18 s 条带较模糊,且无5.8 s,同时放置一周后,样品组织中RNA大部分降解。
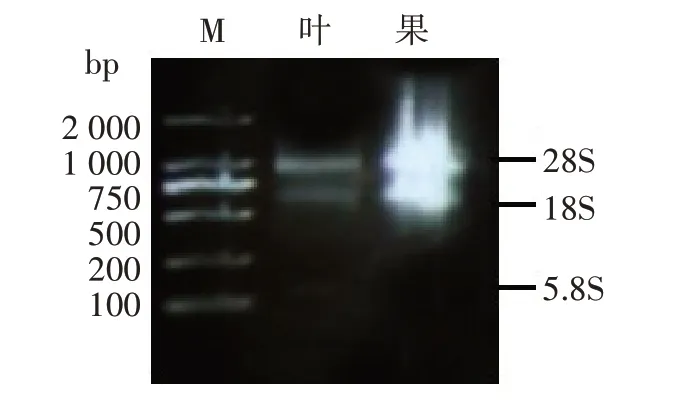
图2 桑叶与桑果总RNA电泳检测Fig.2 Electrophoresis for total RNA of mulberry leaves and mulberry
桑叶中提取的RNA 条带完整,带型较好,未发生明显的降解,28 s 的亮度是18 s 的2 倍左右,并且5.8 s 亮度较弱,说明该样品的完整性良好。
2.2 Trizol法提取的总RNA纯度和得率
从表2 可以看出,提取自桑叶中的RNA,其OD260 nm/OD280 nm 的值在1.8~2.0,可说明未受蛋白质或酚类污染;而提取自桑果中的RNA,其OD260 nm/OD280 nm 的值<1.8,说明受蛋白质及其他有机物污染较明显。在后续的RTPCR 试验中,使用无污染的桑叶RNA 进行反转录及MCHS基因扩增。

表2 Trizol法提取的RNA的纯度及得率Tab.2 Isolated RNA purity and yield by Trizol methods
2.3 桑叶MCHS基因的鉴定
以提取的桑叶总RNA 为模板进行RT-PCR 检测,引物是根据NCBI上已收录的桑科CHE设计2对简并引物MCHS(1-393)、MCHS(36-393),其中MCHS(1-393)扩增为查尔酮酶基因的全长序列,MCHS(36-393)扩增的为查尔酮酶的关键区域,RT-PCR 结果,见图3。从桑叶RNA 中获得的查尔酮合成酶基因全长序列为1 200 bp 左右,关键区域序列为1 000 bp左右,序列大小与大多数物种CHS相似。
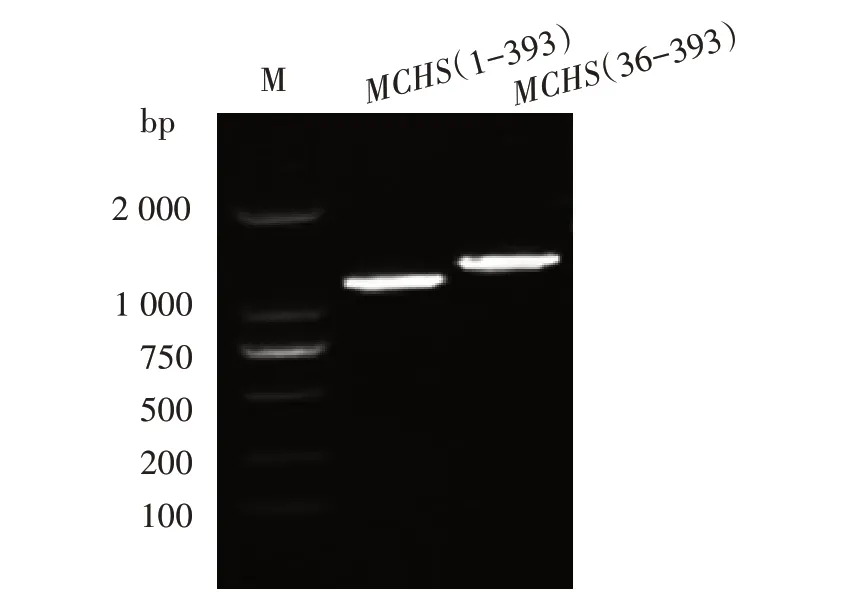
图3 桑叶提取MCHS基因扩增结果Fig.3 MCHS by RT-PCR isolated from mulberry leaves
3 结论
山西桑属资源丰富,研究报道表明,桑属资源含有丰富的活性蛋白、维生素、氨基酸、胡萝卜素、矿物质等;同时桑果还具有补肝益肾、补血养颜等功效。以桑叶作为研究对象,对其细胞水平进行深入研究,其结果对于山西省桑葚的种植、开发与推广具有重要实践性意义。
在桑属植物的类黄酮生物合成过程中,MCHS是第一关键酶,对其抑制或过表达将直接影响苯丙氨酸和丙二酰-CoA的结合,从而影响花色素合成、抗病性以及抗UV 性等。有研究表明,利用RNA 干扰技术使花素夏堇中的CHS 基因沉默,或矮牵牛CHS基因突变,均可获得花色花粉不同的新品种[6]。
本研究以桑葚为试验材料,通过改进和优化的Trizol 法提取其RNA 并克隆桑叶MCHS基因,Trizol 法提取桑科RNA操作简单,结合氯仿、苯酚等提取试剂,提取时间为2~3 h。该方法具有可重复性强、提取RNA 完整性好等优点,所提取RNA 可直接进行后续的RT-PCR 反转录试验,不需要DNase消化,因此是植物RNA 的理想提取方法之一,该结果为分子水平上揭示花青素的形成机理奠定基础。

