GPSM1在疾病中的研究进展
王 璐,陈 阳,宋瑶琳,邢晓明
G蛋白偶联受体(GPCR)介导的跨膜信号转导是生物体普遍存在的一种信号转导机制。在经典的G蛋白信号通路中,G蛋白通过与GPCR结合激活下游靶点,调控机体大多数生命活动。但也有不依赖GPCR即可激活G蛋白的一类蛋白质,G蛋白信号调节蛋白1(G-protein signaling modulator 1, GPSM1)为该类蛋白之一。GPSM1是近年医学研究的热点之一,研究显示,GPSM1不仅参与调控有丝分裂、细胞自噬及膜蛋白转运,还与多种疾病密切相关,如食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)、前列腺癌(prostate cancer, PCa)、多囊肾疾病(polycystic kidney disease, PKD)及糖尿病等。本文对GPSM1的相关文献进行综述,拟为GPSM1在疾病中的研究提供参考。
1 GPSM1的染色体基因定位及结构
GPSM1又称为G蛋白信号转导激活蛋白3(AGS3),归属于G蛋白信号转导蛋白(AGS)家族[1],于1999年由Takesono等[2]和Cismowski等[3]通过酵母基因筛选系统鉴定出来,并发现其可以以非受体依赖的方式激活异三聚体G蛋白信号。GPSM1起鸟嘌呤核苷酸解离抑制剂的作用,抑制鸟苷二磷酸从Gα亚基解离,并竞争性地阻止Gβγ亚基偶联Gα亚基[4-5]。GPSM1由GPSM1基因编码,位于染色体9q34.3上,包含14个外显子,由650个氨基酸残基组成,相对分子质量为72 KDa,具有一个由7个四肽重复(TPR)序列和4个G蛋白调节因子(GPR)基序组成的模块化结构域[3,6],两者由中间的连接区域连接[7]。GPSM1定位于细胞胞质,广泛分布于肝脏、肾脏、心脏和胰腺等多种组织中[1, 8-9]。
2 GPSM1的功能及其与疾病的联系
2.1 GPSM1的功能AGS家族成员中,GPSM1的功能最多样化。GPSM1能够调节有丝分裂纺锤体的方向、cAMP的产生、膜蛋白的运输和细胞的不对称分裂,并涉及广泛的系统及细胞功能(图1),包括对成瘾和渴望行为的适应性反应、自噬、膜蛋白转运、新陈代谢、心血管功能、肾损伤、纤毛生物学、牙髓干细胞的成骨分化、囊肿生成、PKD、不对称细胞分裂和免疫反应[4, 7, 9-18]。
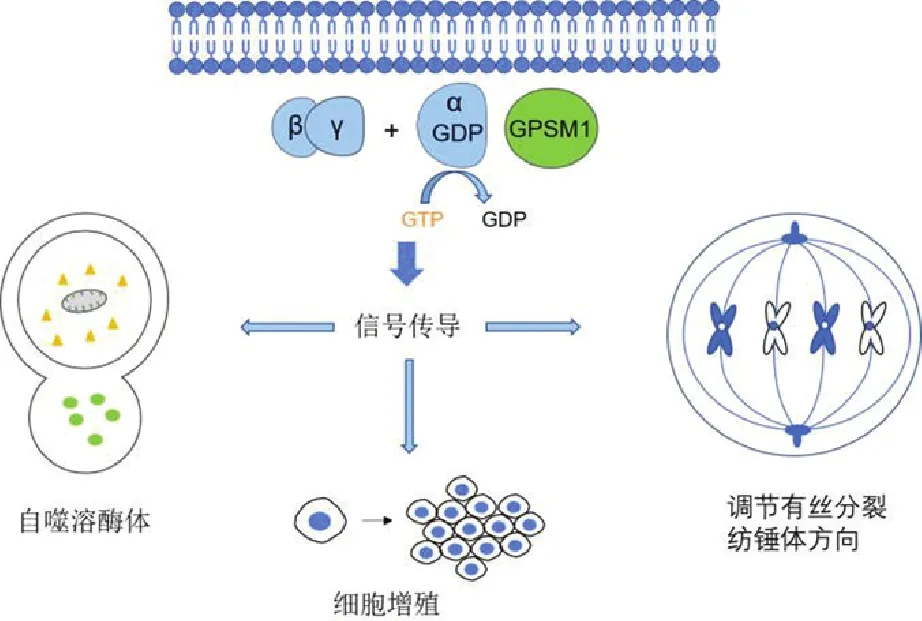
图1 GPSM1生理功能示意图
2.2 GPSM1与疾病
2.2.1GPSM1与肿瘤 GPSM1在ESCC、PCa和多发性骨髓瘤(multiple myeloma, MM)中均表达异常,并与结直肠癌细胞自噬活动相关[4, 19-21]。
Shi等[19]采用免疫组化和Western blot法对85例ESCC中GPSM1的表达进行检测,并进行了单因素和多因素生存分析,以确定其对预后的指导意义。结果发现,与正常组织相比:GPSM1在人ESCC组织中的表达显著降低。单因素生存分析显示,高表达GPSM1的ESCC患者生存期更长,其是影响患者总生存期的独立预后因素。此外,虽然GPSM1在肿瘤细胞中的精确生物学功能尚未确定,但该实验结果表明GPSM1与ESCC的进展和预后有关。GPSM1是ESCC中肿瘤细胞增殖的重要调控因子,可能是一种潜在的诊断生物学标志物或食管癌潜在的诊治靶点之一。
PCa是男性泌尿生殖系统常见的恶性肿瘤,早期患者给予雄激素剥夺治疗,效果佳[22]。Adekoya等[20]采用Western blot法检测GPSM1在人PCa细胞系中的表达,发现与正常前列腺上皮细胞系RWPE1相比,GPSM1在LNCaP、MDA PCA 2b和DU-145细胞中的表达水平均升高。实验结果表明,GPSM1在PCa细胞系中高表达促进肿瘤生长,干扰GPSM1表达后则抑制肿瘤的进展。与对照组相比,GPSM1的缺失促进肿瘤微环境中丝裂原活化蛋白激酶(MAPK)的激活并上调雄激素受体(AR)的表达。研究结果显示,GPSM1可通过MAPK/AR依赖的途径调节PCa的进程,推动PCa的发生。综上所述,GPSM1的高表达促进PCa的发展。如果能够深入探究GPSM1在前列腺肿瘤发展过程中的具体发生机制,将会为PCa的诊断、治疗及预后的改善提供新思路。
MM中的肿瘤细胞黏附在骨髓微环境中的基质细胞或细胞外基质上,诱导对药物介导的凋亡产生抵抗,这种现象被称为细胞黏附介导耐药(cell adhesion-mediated drug resistance, CAM-DR)。由于细胞黏附介导的耐药性仍然是治疗MM的主要障碍[23],而细胞黏附在耐受药物介导的细胞凋亡过程中起至关重要的作用。已有研究证实GPSM1可通过增强环磷酸腺苷反应元件结合蛋白的磷酸化(p-CREB)发挥重要的抗凋亡作用[24]。Shao等[21]从蛋白水平研究了GPSM1在阿霉素介导的MM细胞凋亡中的表达模式并在细胞黏附模型中检测了GPSM1蛋白表达变化,以便更深入地了解GPSM1的抗凋亡作用及其在MM细胞中的作用。结果发现干扰GPSM1后MM细胞与纤维连接蛋白及HS-5细胞的黏附率降低;同时MM细胞对阿霉素、米托蒽醌和地塞米松的耐药性降低。以上结果表明GPSM1可能在MM发生、发展过程中发挥促进作用[21]。
自噬是体内蛋白降解的重要途径之一,自噬失调可能诱发癌症[25]。研究表明,胞质异源三聚体GNAI3蛋白可以调节人结肠癌HT-29细胞系的自噬[26]。最近,GPSM1被证明能与GDP结合形式的GNAI3蛋白相互作用。这表明GPSM1可能与GNAI3一同参与结直肠癌细胞自噬过程。由此Pattingre等[4]对GPSM1在肠道细胞自噬中的作用开展了相关研究,发现GPSM1编码的mRNA在人肠道细胞系(Caco-2和HT-29)中表达,且GPSM1与GNAI3蛋白在结直肠癌细胞中均定位于细胞质。转染过表达GPSM1的质粒后发现:过表达组细胞的自噬率与对照组相比增加约2倍。以上表明GPSM1能够参与结直肠癌细胞的自噬代谢活动,刺激并促进结直肠癌细胞发生自噬。这也提示GPSM1可能与结直肠癌的发生机制相关,其可能是一种潜在的诊断结直肠癌的生物学标志物。
2.2.2GPSM1与气道炎症 MUC1是一种表达于黏膜上皮细胞顶端表面的跨膜黏蛋白[27],在减轻呼吸道炎症中起重要作用,其功能障碍与慢性炎症性呼吸系统疾病的发病有关[28]。基质细胞衍生因子1(SDF-1a;CXCL12)与其受体趋化因子受体4(CXCR4)的偶联在炎症和肿瘤转移中起重要作用[29]。
Choi等[30]的研究表明,GPSM1的过表达下调了肿瘤坏死因子α(TNFα)的表达,上调了白细胞介素-6(IL-6)的表达;而干扰GPSM1后上调了TNFα的表达,下调了IL-6的表达。相反,抗炎细胞因子转化生长因子β(TGFβ)起相反的作用。这些结果提示GPSM1在气道炎症中具有抑制作用,能下调气道中TNFα的表达。
此外,GPSM1的GPR基序在调节炎症微环境中MUC1的表达和细胞因子的产生方面起关键作用。GPSM1的GPR基序能够显著降低MUC1的表达,而突变的GPR基序Q34A肽可增加MUC1和TGFβ的表达,降低TNFα和IL-6的表达。动物实验表明,GPR Q34A肽可通过抑制CXCL12诱导的小鼠肺黏膜上皮化生,减少炎性细胞数量和炎性细胞因子的产生。说明GPSM1突变的GPR Q34A肽是气道上皮细胞中一种新的抑制肽,在体内能够抑制CXCL12诱导的肺炎症反应,调节气道中的炎症微环境。该研究是首例证明GPSM1的GPR基序具有抗炎作用的报道,也是首例证明GPR基序与MUC1在气道炎症过程中有协同作用的报道,这些发现为呼吸道疾病中GPCR/G蛋白/G蛋白调节的辅助蛋白介导的免疫反应的分子机制提供新的见解。
2.2.3GPSM1与PKD PKD是一种遗传性疾病,表现为肾脏和肝脏中上皮细胞的异常增生[13]。人类多囊肾病是由PKD1、PKD2或PKHD1基因突变引起的。PKD是由肾小管上皮细胞(RTECs)产生的薄壁囊肿中的液体不断积聚,导致肾实质损伤和非囊性肾组织纤维化[31]。异源三聚体G蛋白信号通路的激活是PKD病理、生理过程中的重要特征之一。Nadella等[14]报道GPSM1在常染色体隐性PKD(ARPKD)和常染色体显性PKD(ADPKD)的啮齿类动物和人类中异常过表达。
在ARPKD模型中,多囊肾小鼠肾脏中GPSM1蛋白表达比正常小鼠明显增高。多囊肾大鼠肾脏中的GPSM1蛋白表达在第8~26周期间有一过性的增加。在ADPKD模型中,多囊肾小鼠肾脏中GPSM1的表达高于野生型小鼠。人ADPKD肾脏中GPSM1呈强表达,而正常人肾脏中GPSM1呈弱表达。以上结果表明ARPKD、ADPKD模型鼠和人ADPKD肾脏中GPSM1蛋白表达增加,GPSM1促进PKD发生、发展。
有研究证实肾上皮细胞活性受GPSM1的调节,并与ERK5的激活有关[32]。该研究提示PKD肾小管上皮细胞中GPSM1异常表达与上皮细胞增殖有关,GPSM1可能通过调节GαPKD中的亚单位参与调控上皮细胞的功能。GPSM1-Gα信号可能参与激活非经典G蛋白通路,促进肾上皮细胞的增殖。该研究可能为针对GPSM1-Gα的抗囊性药物的开发提供思路,用于治疗PKD和其他可能的增生性疾病。
2.2.4GPSM1与原发性卵巢功能不全(premature ovarian insufficiency, POI) POI被定义为40岁之前的卵巢功能不全,是一种由于原始卵泡池耗尽而导致卵巢功能丧失的疾病[33]。根据最新研究进展,Cai等[34]首先通过全外显子测序发现GPSM1是导致POI的易感基因。使用卵巢颗粒细胞(granulosa cells, GC)进行qRT-PCR和Western blot实验,结果表明大鼠卵巢中GPSM1的表达水平在卵泡发育期比原始卵泡期增加。免疫组化结果表明,GPSM1在大鼠卵巢中广泛表达。敲低GPSM1表达后进行CCK-8实验及流式细胞术检测,结果发现GC的增殖率显著降低且凋亡率升高,表明GPSM1能够促进GC的增殖。结果提示GPSM1对POI的作用可能是通过cAMP-PKA-CREB信号通路实现,为GPSM1的研究拓宽了思路。
2.2.5GPSM1与2型糖尿病(type 2 diabetes mellitus, T2DM) T2DM是一种以慢性高血糖为特征的代谢性疾病[35]。最近,全基因组关联研究(genome-wide association studies, GWAS)报道了GPSM1与T2DM的关联。GPSM1在不同种族人群中出现的频率不同,但与T2DM的相关性主要体现在亚洲人群中[36]。然而,在不同种族中GPSM1与T2DM的具体关联机制尚未报道。
Ding等[37]采用了精细定位等方法探究GPSM1在骨骼肌胰岛素抵抗中的作用。对来自7个GWAS的21 897例T2DM患者和32 710例健康者的GPSM1基因合计128个单核苷酸多态性进行分析。结果发现在亚洲人群中,GPSM1内含子9的rs28539249单核苷酸多态性与T2DM显著相关,rs28539249参与了转录调控和T2DM发生的相关过程。进行肥胖小鼠模型实验后发现,高脂饮食诱导的肥胖小鼠骨骼肌中GPSM1的mRNA表达水平较对照组小鼠明显增加;且肥胖小鼠中GPSM1的表达水平与小鼠血糖和胰岛素水平呈显著正相关。该研究证实了肥胖小鼠骨骼肌中GPSM1的表达增加,且与T2DM的性状相关。对GPSM1进行深入探究,可能为T2DM患者带来福音。
3 结语
目前GPSM1的研究工作已经进行了20余年,随着医学科研水平的提高和发展,GPSM1在细胞水平的功能逐渐被发现,GPSM1的表达与多种疾病之间的关系正逐步得到验证。已有研究结果证实,GPSM1在气道炎症、PCa、MM、PKD以及糖尿病中发挥促进作用,而在ESCC中发挥抑癌作用。正是由于GPSM1在多种疾病中发挥的作用错综复杂,使得其具有重要的临床价值。对GPSM1参与的多种细胞学功能的深入研究将为疾病的治疗提供更多的潜在靶点,并且对改善患者的临床预后具有重要意义。

