鼻腔鼻窦EBV阳性浆细胞瘤7例临床病理分析
李 涛,宋国新,李 霄,孙浩然,李 海,刘 冲
浆细胞肿瘤(plasma cell neoplasms, PCN)是由终末分化的B细胞产生,通常分泌具有重链重排的单克隆丙种免疫球蛋白(immunoglobulin, Ig),或称M蛋白。PCN包括多种亚型:浆细胞骨髓瘤、浆细胞瘤、Ig沉积病、骨硬化性骨髓瘤(亦称POEMS综合征)等,其中浆细胞瘤又分为骨孤立性浆细胞瘤和骨外(髓外)浆细胞瘤。骨外(髓外)浆细胞瘤是发生于骨外软组织的局限性孤立性肿瘤,最常见于上呼吸道,尤其是老年人的口咽、鼻腔鼻窦和喉等部位,形态学特点类似骨内孤立性浆细胞瘤[1]。近年,有学者发现部分发生于鼻腔鼻窦的浆细胞瘤伴有EB病毒(Epstein-Barr virus, EBV)感染,但WHO(2017)淋巴造血系统肿瘤分类中未提及该特征,目前也仅有少量的个案报道[2-7],两者之间潜在的关联尚不明确。本文着重探讨原发于鼻腔鼻窦的EBV阳性浆细胞瘤的临床病理学特征及其与相关肿瘤的鉴别诊断,为临床和病理医师提供参考。
1 材料与方法
1.1 材料收集2017年1月~2020年12月江苏省人民医院/南京医科大学第一附属医院病理学部诊断的22例鼻腔鼻窦浆细胞瘤,其中7例为EBV阳性浆细胞瘤(占31.8%)。
1.2 方法
1.2.1HE及免疫组化 标本均经10%中性福尔马林充分固定,常规脱水、石蜡包埋、3 μm厚连续切片、HE染色、中性树胶封固。免疫组化染色采用EnVision两步法,所用一抗包括CD3(SP7)、CD5(SP19)、CD20(L26)、PAX-5(MX017)、CD79a(MX076)、CD38(MX044)、CD138(MI15)、MUM1(MUM1P)、CD30(Ber-H2)、CD56(MX039)、C-myc(EP121)、Ki-67(MIB-1)等,均购自福州迈新公司,利用Lumatas全自动免疫组化染色仪进行制片。
1.2.2EBER原位杂交 石蜡4 μm厚切片,烘烤后进行脱蜡和水化,随后进行蛋白酶K处理、杂交孵育、显色、水洗、苏木精复染、梯度乙醇脱水、中性树胶封固等程序。其中EBV编码的小RNA(EBER)探针购自北京中杉金桥公司,以EBV阳性的鼻咽癌作为阳性对照,用PBS代替探针作为阴性对照,实验过程中酶处理和杂交孵育过程严格遵守无菌操作,保证实验室和所有器械等均为专用,避免RNA酶污染。阳性结果判断标准:仅为细胞核着色,胞质和胞膜着色为阴性(核分裂除外)。
1.2.3FISH 石蜡3 μm厚切片2张,烘烤后进行脱蜡和水化,胃蛋白酶消化10 min,后经70%、85%和100%梯度乙醇脱水固定,自然干燥。然后转入暗室进行基因变性和杂交,加入探针放入原位杂交仪进行杂交反应及后续处理,待实验完毕,晾干,利用荧光显微镜观察基因的突变形式。C-myc基因断裂重组检测试剂盒购自北京金菩嘉公司,所用探针为GLP C-myc(8q24)。判读标准:10%以上肿瘤细胞出现1个黄色融合信号、1个红色信号和1个绿色信号为阳性(正常为2个黄色信号)。
1.2.4Ig基因重排检测 DNA提取试剂盒采用QIAamp DNA FFPE Tissue Kit,引物系统符合BIOMED-2标准,PCR反应液购自上海源奇生物公司,在ABI3130遗传分析仪上进行片段扫描的克隆性分析,再根据“BIOMED-2解读指南”进行判断分析,其中单克隆结果为:目的范围内出现明确单峰荧光信号或在弱的多信号背景中出现明确单峰信号判断为单克隆性重排;显示连续多荧光信号的钟型曲线判断为多克隆性重排。实验过程包含质控要求:若标本在100、200、300、395 bp位置收集到ROX荧光信号(红色峰),则表示标本DNA的质量和数量符合要求;反之,重新检测样品,若仍无荧光信号则检测结果报告为“用于检测的DNA数量或者质量不合格,无法进行检测”。检测基因(含有效监测范围)如下:管家基因(100、200、300、394 bp)、FR1-JH(310~360 bp)、FR2-JH(250~295 bp)、DH-JH(110~290 bp、390~420 bp)、Vk-Jk(120~160 bp、190~210 bp、260~300 bp)、Vk-Kde+intron-Kde(210~250 bp、270~300 bp、350~390 bp)。
2 结果
2.1 临床特征7例均为老年男性患者,年龄范围58~70岁,平均65.7岁。发病部位包括鼻腔(3例)、鼻窦(2例)、鼻中隔(1例)、鼻前庭(1例)。肿瘤直径1~3.5 cm,平均2.2 cm。所有患者均为孤立性偶发病例,无免疫抑制剂治疗、器官移植以及浆细胞骨髓瘤等相关病史,主要临床表现依据发病频率依次为:鼻出血(5/7)、鼻塞(5/7)、鼻息肉(2/7)、不规则新生物(2/7)、疖肿(1/7)。
2.2 病理特征7例肿瘤性浆细胞呈弥漫实性生长,根据浆细胞分化成熟度分为三个级别:1级2例,肿瘤细胞分化好,具有成熟浆细胞形态,细胞呈卵圆形,核偏位,染色质深染、均质状或呈“车辐状”分布在核膜边缘,无核仁,有丰富的嗜碱性胞质和核周空晕(图1);2级1例,肿瘤细胞分化较不成熟,瘤细胞体积大,核染色质疏松,核质比例高,核异型增加,核仁明显,可见双核或多核细胞,但胞质仍较丰富、嗜碱性,核周空晕可见(图2);3级4例,瘤细胞分化更为不成熟,其中1例呈现浆母细胞样形态(核大空泡状,核仁明显、居中,核分裂易见,胞质较少聚集在细胞膜边缘,核周空晕不明显或缺如,图3),另外3例呈现间变性形态(显著的多形性和异形性,图4)。为进一步观察肿瘤的病理特征,将本组7例再分为分化成熟组2例和不成熟组5例,其中2例分化成熟组中部分区域仍散在分布较为不成熟的肿瘤性浆细胞。
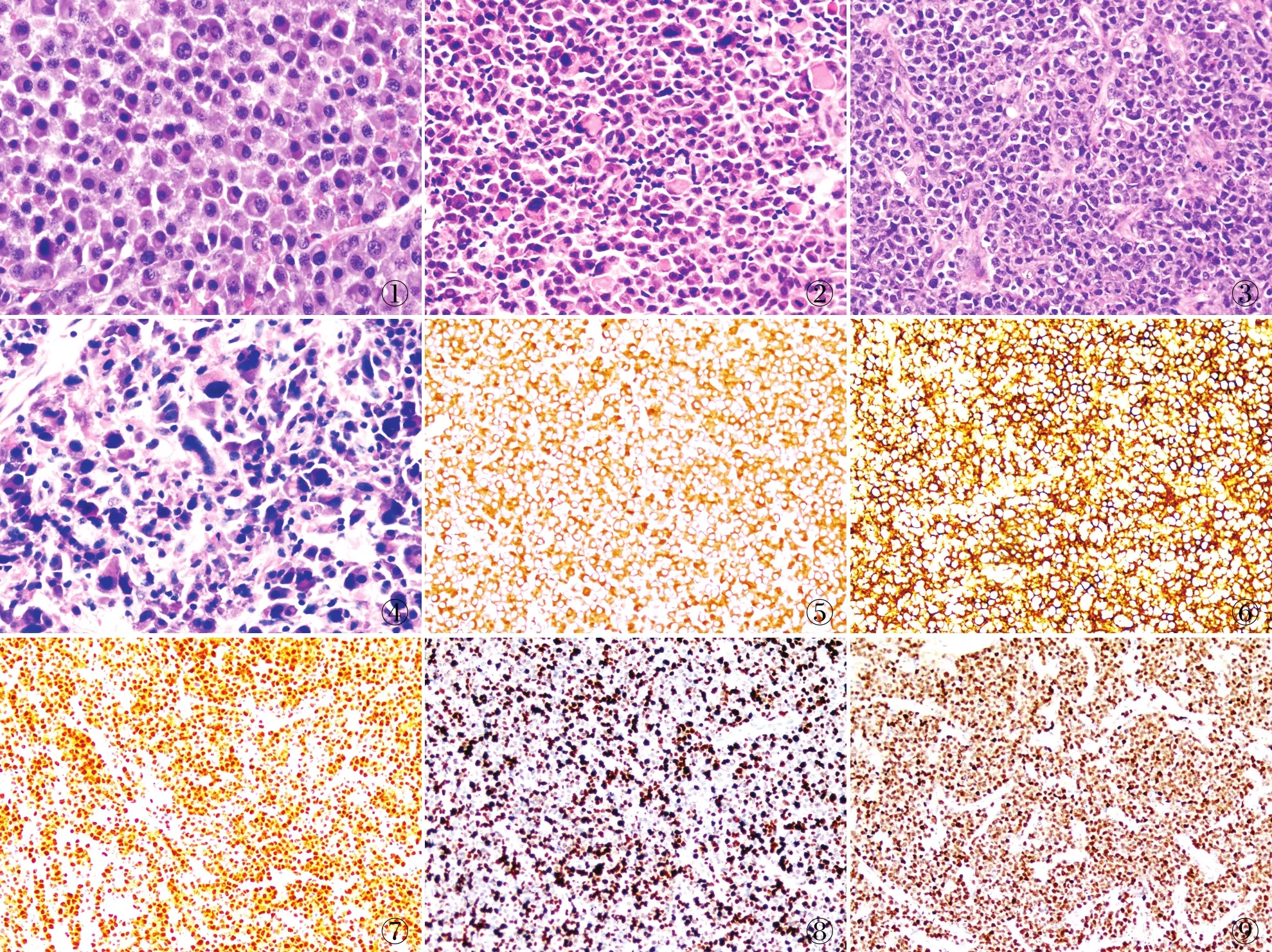
图1 肿瘤细胞具有成熟浆细胞形态,异型小,细胞呈卵圆形,核偏位,染色质深染、均质状或呈“车辐状”分布 图2 肿瘤细胞分化较不成熟,瘤细胞体积大,核染色质疏松,核质比例高,核异型增加 图3 肿瘤细胞呈浆母细胞样,具有大而空泡状的细胞核,核仁明显、居中,核分裂易见 图4 肿瘤细胞异型性显著(体积增大,核形不规则、核仁显著、多核、巨核),符合间变性特征 图5 肿瘤细胞弥漫表达CD79a,EnVision两步法 图6 肿瘤细胞弥漫表达CD138,EnVision两步法 图7 肿瘤细胞弥漫表达MUM1,EnVision两步法 图8 具有浆母细胞样形态特征的肿瘤Ki-67增殖指数高达90%,EnVision两步法 图9 EBER原位杂交检测阳性
2.3 免疫表型肿瘤细胞主要表达CD79a(图5)以及浆细胞分化的标记,如CD38、CD138(图6)、MUM1(图7),阳性率均为100%,不表达CD20和PAX-5。Ki-67增殖指数为10%~90%,其中分化成熟组为10%~20%,分化不成熟组为40%~90%(图8)。Ki-67阳性率>70%的3例肿瘤细胞CD30阴性、CD56阳性。
2.4 EBER原位杂交检测22例浆细胞瘤中7例出现弥漫强阳性,阳性定位于细胞核,呈棕黄色(图9),7例切片阳性质控和阴性质控组织较理想着色或不着色,提示EBER原位杂交检测阳性。
2.5 FISH检测7例C-myc基因断裂重组检测镜下所见C-myc基因为2个黄色信号或表现为1红1绿1黄比率<10%,提示C-myc基因均未发生易位。
2.6 Ig基因重排检测7例均为阳性,其中5例表现为IGH和IHK(重链和轻链)重排,1例表现为IGH重排,1例表现为IGK重排,涉及的基因及出现频率为:FR2-JH(6/7)、FR1-JH(1/7)、DH-JH(1/7)、Vk-Kde+intron-Kde(5/7)、Vk-Jk(1/7)。所有病例均可见轻链限制性表达(κ或λ)。
2.7 预后7例患者6例获得随访资料,1例失访,随访2.7~40个月,均存活,至今无复发或转移,其中4例术后进行了放疗,1例进行细胞免疫治疗,1例未进行治疗。
3 讨论
浆细胞瘤伴EBV阳性这一特征并未在WHO(2017)淋巴造血系统肿瘤分类中提及,目前仅为少数个案报道[2-9],文献报道该现象多见于移植后的浆细胞瘤[4]。本组22例鼻腔鼻窦浆细胞瘤中EBV阳性7例(占31.8%)。肿瘤细胞CD79a、MUM1、CD138、CD38阳性,CD20和PAX-5阴性。Ig基因重排检测均为阳性并可见轻链限制性表达(κ或λ)。C-myc基因断裂重组检测均为阴性。患者均为孤立性偶发病例,无免疫抑制剂治疗、器官移植以及浆细胞骨髓瘤等相关病史。7例均符合骨外(髓外)孤立性浆细胞瘤的临床病理特征,但与一般的浆细胞瘤不同的是所有病例EBER原位杂交检测均呈阳性。
EBV又称人类疱疹病毒-4型(human herpesvirus-4, HHV-4),是一种普遍存在的双链DNA病毒,主要感染人口咽上皮和淋巴细胞,通过病毒的包膜糖蛋白Gp350与B淋巴细胞表面的CD21受体结合,优先感染B淋巴细胞[10]。目前,已明确EBV与许多疾病有关,包括上皮和间叶性肿瘤以及淋巴造血系统疾病等,但其发病机制的确切作用尚未完全明了[11]。EBV的生命周期具有原发感染(包括溶解复制阶段)和潜伏期双向性特点:原发感染阶段,由于宿主缺乏对病毒的免疫力,病毒可破坏口咽细胞。接下来的几天和几周内,细胞免疫和体液免疫得以发展,病毒潜伏在记忆B细胞中,使记忆B细胞成为EBV贮存库,被病毒感染的细胞便逃避了机体的免疫识别[10]。尽管全球90%以上的人口感染了EBV,但仅有一小部分相关感染会导致肿瘤转化[10-11]。研究发现EBV血清阳性的健康个体中,受EBV感染的记忆B细胞向浆细胞的终末分化与病毒复制和EBV裂解周期的启动有关,呈现一种限制性潜伏期模式[2,6,12]。EBER作为EBV编码的小RNA,属于EBV的表达产物,在EBV感染的细胞核中以高拷贝数存在,可能参与了抑制细胞凋亡、诱导细胞增殖和肿瘤形成等过程[13]。结合本组分析发现鼻腔鼻窦的浆细胞瘤虽然少见,但发病人群中EBV感染率占31.8%,尽管相关机制尚不明确,推测EBV可能与浆细胞瘤的发生有一定的关系,需要扩大样本量进行深入探究。
本组7例肿瘤细胞均呈弥漫浸润,形态上依据浆细胞分化程度呈完整的谱系,即肿瘤细胞从成熟到不成熟形态,甚至呈现间变性或浆母样特征。本组3例呈间变性特征,1例具有浆母细胞样形态特点,此外分化较为成熟的2例中也有部分区域散在分布分化较为不成熟的浆细胞。肿瘤增殖指数在2例分化较成熟组分别为10%和20%,在5例分化不成熟组为40%~90%。查阅文献发现,个别学者亦观察到EBV阳性浆细胞瘤的形态学特征可表现为浆母细胞性、局灶浆母细胞性或间变性[14]。结合本组病例,发现EBV对肿瘤的形态和增殖活性可造成一定的影响。
鉴别诊断:当EBV阳性浆细胞瘤中存在间变性或浆母细胞样形态特征时,需与浆母细胞淋巴瘤(plasmablastic lymphoma, PBL)进行鉴别[15]。PBL更易呈EBV阳性(阳性率为60%~75%,发生于口腔黏膜的阳性率接近100%),同时具有高增殖活性[1],其形态及免疫表型等诸多特征均与EBV阳性浆细胞瘤极为相似,但两者临床治疗方案却截然不同,因此PBL是EBV阳性浆细胞瘤最重要的鉴别点之一。PBL好发于HIV阳性的男性患者,大部分肿瘤细胞类似于B免疫母细胞,目前归类于大B细胞淋巴瘤范畴。形态学具有较大的变化范围,从弥漫和镶嵌排列到显著的浆细胞性分化,肿瘤细胞具有显著的异型性、核偏位、胞质丰富、核仁明显、核分裂象易见,可见凋亡小体等。PBL细胞具有浆细胞表型,表达CD138、CD38、Vs38c、IRF4/MUM1,不表达或弱表达CD20、PAX-5,但与浆细胞瘤不同的是该肿瘤常表达EMA、CD30,不表达CD56,Ki-67增殖指数一般较高(>90%)[1]。遗传学上MYC基因是在PBL中最早报道的异常基因[16],也是PBL中最常见的染色体异常(阳性率达49%)[17]。本组有3例Ki-67呈高增殖指数(>70%),但CD30阴性、CD56阳性,C-myc基因断裂重组检测均为阴性,不符合PBL的特点,尽管形态存在间变性或浆母细胞样的特点,最终诊断为EBV阳性浆细胞肿瘤,伴有间变性或浆母细胞样形态特征。另一方面当肿瘤细胞形态学呈现分化较为成熟以及伴有Ki-67低增殖指数时,需进一步与低级别的结外边缘区黏膜相关淋巴组织淋巴瘤伴广泛的浆样分化以及浆细胞单克隆性增殖鉴别[18-19]。因此,外检中如果发现浆细胞瘤存在间变性或浆母细胞样特征时,需考虑EBV感染的可能性,同时还要充分的询问患者是否存在免疫抑制治疗、器官或组织移植等病史[4]。
7例患者6例获得随访资料,1例失访,随访时间2.7~40个月,至今均存活,其中4例术后进行了放疗,1例进行细胞免疫治疗,1例未进行治疗。有研究报道,EBER阳性患者预后良好,无侵袭性临床病程,但与EBER阴性患者相比,EBER阳性患者更容易出现疾病进展(复发/进展为多发性骨髓瘤)[5],由于目前所观察的样本较小,该结论仍需进一步探讨。
EBV的存在对肿瘤的形态和增殖活性具有一定的影响,但对该疾病发病机制和发展的影响仍需进一步观察,有待大样本数据的荟萃分析,建议病理医师在今后的外检工作中增加浆细胞肿瘤EBV的检测,为进一步认识该肿瘤的生物学行为储备病例资料。

