早期胃癌内镜下胃黏膜剥离术完全切除后复发的风险模型构建
陈文妹,毛 苇,孔灿灿,邝继孙,邱敏霞,楼润龙
(海南省人民医院海南医学院附属海南医院消化内科,海南 海口 570300)
胃癌是临床常见的消化道恶性肿瘤之一,病死率居所有肿瘤第2位,严重影响患者的健康与生活质量[1]。早期胃癌(early gastric carcinoma,EGC)是指胃黏膜或黏膜下层细胞发生癌变的恶性肿瘤,其归类不考虑肿瘤大小及是否发生淋巴结转移[2]。内镜下胃黏膜剥离术(endoscopic submucosal dissection,ESD)是一种在内镜下将癌变的胃黏膜完整剥离的微创技术,具有创伤小、应激反应轻、并发症少、术后恢复快、复发率低、预后效果好等优点,是目前治疗EGC的主要方法之一[3]。有研究发现,ESD完全切除的预后效果明显优于普通ESD,但仍有部分患者术后复发,且复发原因尚不清楚[4]。因此,本研究旨在通过筛选EGC患者ESD完全切除后复发的危险因素,建立可预测复发的列线图模型,以期为EGC患者制定更为合理的个性化诊疗方案提供理论参考,并为患者术后复发的防治策略提供数据支持。
1 资料与方法
1.1 临床资料
选取2010年3月至2016年2月我院消化内科收治的行ESD治疗的EGC患者。纳入标准:①年满18周岁;②首次行ESD;③经术后病理检查确诊为EGC;④符合ESD治疗指征;⑤病灶完整切除;⑥临床资料完整。排除标准:①合并其他恶性肿瘤;②存在凝血功能障碍;③ESD术后行2期手术治疗。最终共纳入308例患者。本研究经我院医学伦理委员会批准(20091007002)。
1.2 资料收集
收集EGC患者的年龄、性别、BMI、吸烟史、合并高血压、合并糖尿病、胃溃疡、幽门螺旋杆菌(Helicobacter pylori,Hp)感染、肿瘤直径、分化程度、浸润深度、阳性淋巴结数、肿瘤部位、手术时间、术中出血量、病灶切除面积等临床资料。
1.3 随访
随访时间自患者行ESD治疗结束开始,之后每3个月随访一次,每次随访均于医院行内镜检查,若发现可疑病灶,则行病理检查进行诊断,以观察是否复发。随访截止时间为患者复发或随访满48个月,根据随访结果将患者分为复发组和无复发组。
1.4 统计学方法

2 结果
2.1 无复发组与复发组临床资料比较
本研究中有273例(88.64%)患者未复发,纳入无复发组;35例(11.36%)患者复发,纳入复发组。2组年龄、性别、BMI、吸烟史、合并高血压、合并糖尿病、胃溃疡、肿瘤直径、分化程度、浸润深度、肿瘤部位、手术时间、病灶切除面积比较,差异无统计学意义(P>0.05),Hp感染、术中出血量、阳性淋巴结数比较差异具有统计学意义(P<0.05),见表1。
2.2 EGC患者ESD术后复发的Cox回归分析
单因素Cox回归分析显示,Hp感染阳性、阳性淋巴结数≥3个、术中出血量大是EGC患者ESD完全切除后复发的危险因素;多因素Cox回归分析显示,Hp感染阳性、阳性淋巴结数≥3个是EGC患者ESD完全切除后复发的独立预测因素,见表2。
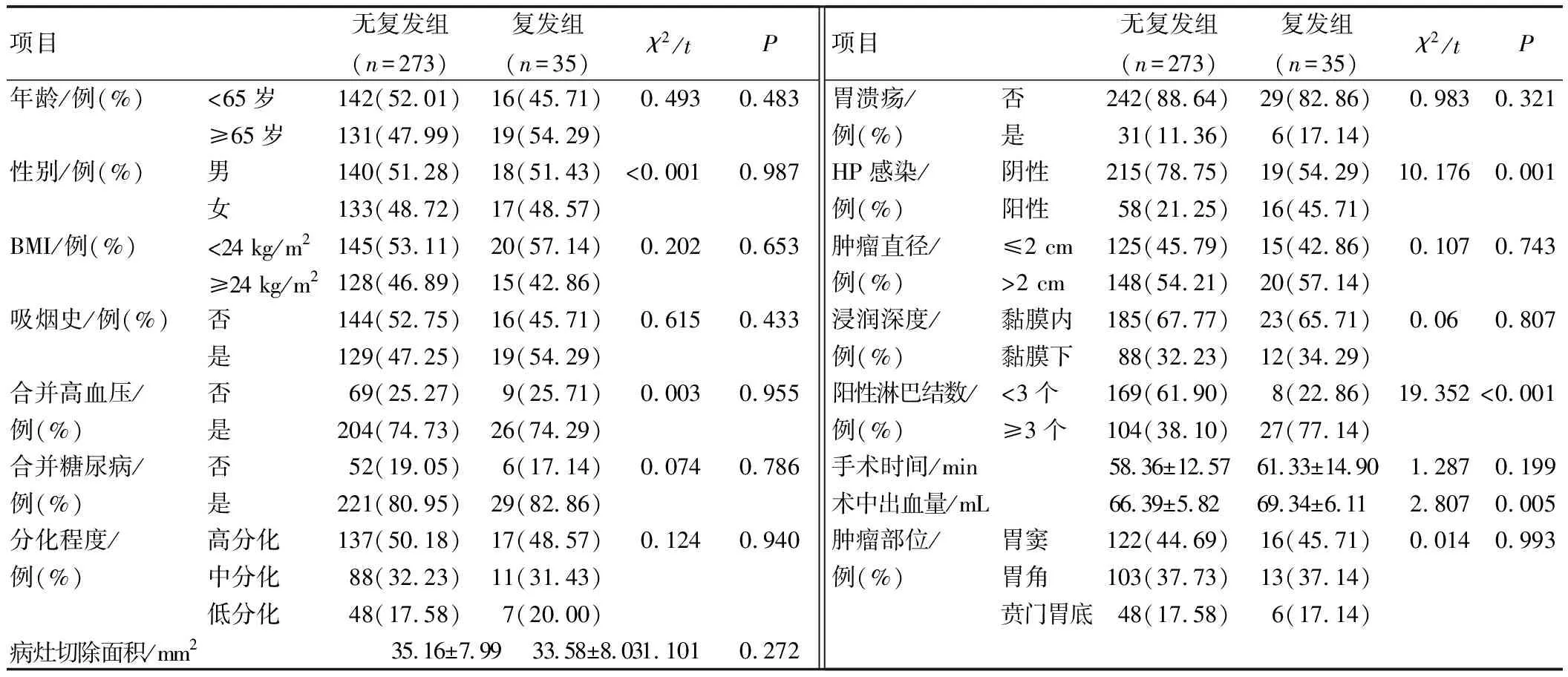
表1 无复发组与复发组临床资料比较
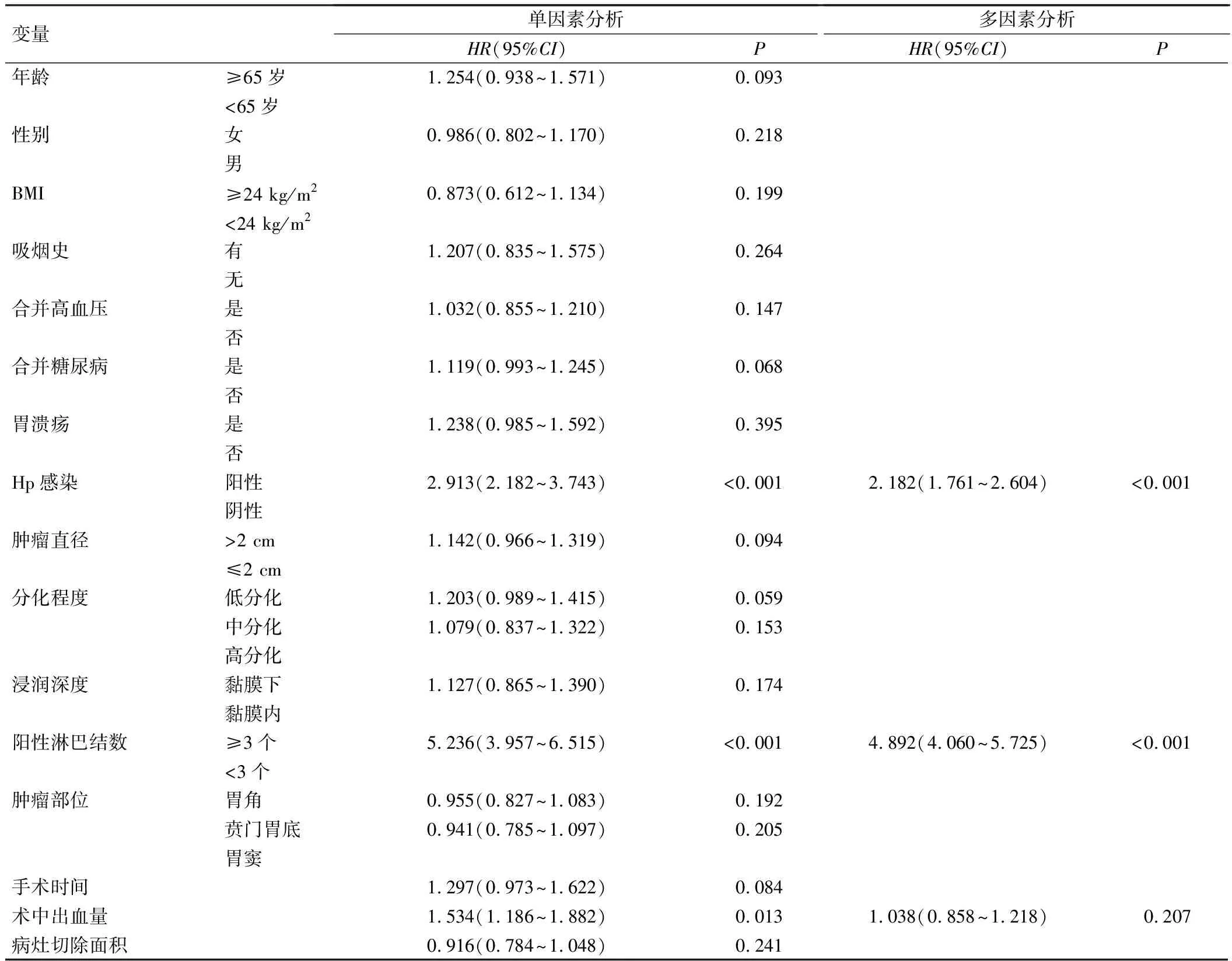
表2 EGC患者ESD术后复发的Cox回归分析
2.3 构建预测EGC患者ESD术后复发的列线图模型
将多因素Cox回归分析中的独立预测因素作为预测因子构建列线图模型(图1),预测EGC患者ESD术后复发的风险。根据患者的实际情况,定位各预测因素对应的线段于评分标尺上,每个预测因素会获得1个分值,将各预测因素的分值相加,所得总分定位于总分轴上,所对应的风险系数可反映EGC患者ESD术后复发的风险。列线图模型结果显示,阳性淋巴结数≥3个对EGC患者ESD术后复发的预测能力比Hp感染阳性强。
2.4 列线图模型的准确度评价
对本研究建立的列线图模型的准确度进行评价,其校准图见图2。校正指数C-index为0.916(95%CI:0.882~0.951),校准图中实际曲线与理想曲线较为贴合,表明列线图模型对EGC患者ESD术后复发的预测情况与实际情况具有较高的一致性。
2.5 列线图模型的区分度评价
绘制列线图模型预测EGC患者ESD术后复发的ROC曲线(图3),AUC为0.933(95%CI:0.919~0.947),表明该模型区分度较高。
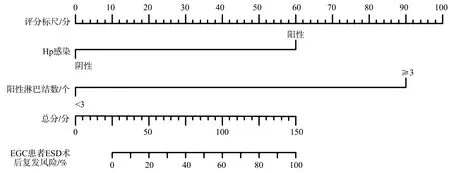
图1 EGC患者ESD术后复发的列线图模型
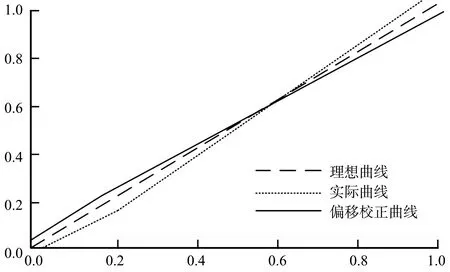
图2 预测EGC患者ESD术后复发的列线图模型校准图
3 讨论
EGC患者的癌细胞仅浸润至胃黏膜和黏膜下层,因此剥离胃部癌变的黏膜病灶即可达到治疗目的,无需行胃部切除。随着微创内镜手术的不断发展,内镜黏膜切除术(endoscopic mucosal resection,EMR)和ESD已广泛应用于EGC的临床治疗。EMR是一种较为传统的内镜治疗方法,极易造成癌细胞残留,增加术后复发风险[5]。而ESD可用高频电刀和辅助设施将EGC的病灶整块剥离,更有利于患者术后恢复,改善预后[6]。
本研究采用列线图模型对EGC患者ESD术后复发的独立预测因素进行筛选与排序,结果显示,阳性淋巴结数≥3个的预测能力较强,其次是Hp感染阳性。阳性淋巴结的出现表明胃癌已经转移,其数量越多表明转移情况越严重,淋巴系统中遗留潜在癌细胞的可能性越大,胃癌复发的风险越高。此外,存在阳性淋巴结的患者还需进行淋巴结清扫术,其清扫范围与阳性淋巴结数呈正相关,对机体损伤较大,影响患者术后恢复,易增加胃癌复发风险[7]。金灿等[8]认为,阳性淋巴结是EGC患者ESD术后复发的独立危险因素,且肿瘤直径也与复发密切相关,肿瘤越大,浸润越深,更易发生转移。李韶华等[9]认为,浸润较深和切缘阳性可增加EGC患者ESD术后复发的风险。本研究结果与以上研究有部分不同,推测造成这种差异的原因是以上两项研究中均存在未能完全切除胃癌病灶的患者,而本研究患者病灶均完全切除,因此其研究对象病灶切除情况与本研究稍有差别。此外,上述两项研究的预后不良率(27.52%、15.83%)均高于本研究(11.36%),也说明ESD完全切除的患者预后更好。有研究显示,Hp感染阳性是胃癌的独立危险因素[10],也是胃癌患者术后复发的预测因素[11]。本研究显示,Hp感染阳性是EGC患者术后复发的预测因素,推测其导致复发的原因可能为:①Hp感染可损伤胃黏膜细胞DNA,使其发生基因突变,从而形成癌细胞[12];②Hp感染相关的慢性炎症可促进胃内活性氧的产生,诱导胃黏膜的氧化应激反应,而ROS信号可通过诱导基因突变和激活致癌途径促进肿瘤的发生[13-14];③Hp感染可通过引发Hedgehog、Notch及Wnt/β-catenin等信号通路异常促进癌细胞的增殖,抑制癌细胞的凋亡,从而增加胃癌细胞的侵袭和迁移能力,最终导致复发[15-16];④Hp感染可促使与肿瘤坏死因子相关的凋亡诱导配体发生凋亡,增加胃癌复发风险[17]。
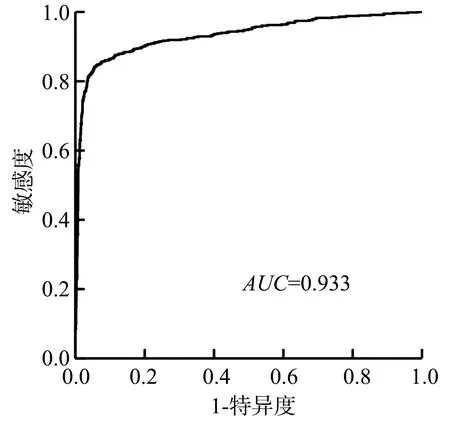
图3 列线图模型预测EGC患者ESD术后复发的ROC曲线
本研究亦存在不足之处:①样本量较小,且为单中心研究;②随访时间有限,未能对患者进行长期随访;③未纳入所有潜在相关因素,筛选出的预测因子可能存在遗漏。因此,未来还需在多地区、多中心纳入样本,扩大样本量,延长随访时间,尽可能对更多的相关因素进行分析,以进一步确定EGC患者ESD术后复发的影响因素。
综上所述,阳性淋巴结数≥3个和Hp感染阳性是EGC患者ESD术后复发的独立危险因素,基于两者构建的列线图具有较强的预测能力,可有效协助临床制定EGC患者的个体化治疗方案,改善患者预后情况。

