松材线虫侵染对马尾松茎干内生细菌群落结构的影响1)
芦伟 谈家金
(南京林业大学,南京,210037)
松材线虫病是一种由松材线虫引起的林业病害,属国际重要检疫对象,对世界各国松树健康造成巨大威胁,目前松材线虫病的致病机理尚不明确,病害的防治也一直是个世界难题[1-2]。松树内生细菌在松树生长发育、抗病性以及抗逆性等方面起着重要的作用[3-4]。研究表明,松材线虫所处环境中的松树内生细菌可能参与病害的发病过程。谈家金等[5]在马尾松内生细菌与松材线虫病关系的初步研究中发现松树茎部内生细菌与松材线虫病的发生有着非常密切的关系。欧阳革成等[6]通过对植物内生菌与松材线虫病关系的研究,提出植物内生菌是导致松材线虫病的内因,而松材线虫是激发因子之一。曾凡勇等[7]通过传统分离培养的方法对松材线虫侵染后的松树内生真菌进行研究,发现松材线虫的侵染会引起内生真菌的响应。Hallmann et al.[8]研究表明植物寄生线虫能提高内生菌的进入位点,最终导致内生菌的总量增加。谢利群等[9]利用传统分离培养的方法研究松材线虫病病程中树体内线虫和细菌种群数量的动态变化,结果表明黑松(Pinusthunbergii)在接种松材线虫后,随着病情的发展,细菌不但数量迅速增加,而且种类也增多。Proença et al.[10]的研究表明海岸松(Pinuspinaster)感染松材线虫后,随着病情的发展,松树茎干内生细菌的多样性增加,内生细菌的群落结构发生了显著的变化,这可能会导致树木健康状况的进一步下降。马阳等[11]在研究松材线虫侵染对寄主松树细菌群落结构和功能的影响中发现,松材线虫侵染后的病死树针叶、根部与土壤中细菌群落多样性、丰富度和均匀性指数均高于健康树,但感病树和健康树所有研究部位细菌群落的任一指数均未呈现出显著性差异。
植物体内菌群作为植物微生态系统的天然组成部分,能与植物体长期共存,对病虫害的响应具有快速、灵敏和专一性等特点。体内菌群在松树中广泛存在,且对松材线虫病等外界环境刺激能够做出相应响应[12]。为了进一步深入了解受松材线虫侵染后,松树内生细菌群落结构的变化以及松材线虫—松树—松树内生细菌之间的关系,本文采用16S rRNA基因的V5~V7区扩增子测序研究受松材线虫侵染后马尾松内生细菌群落结构的动态变化,为进一步研究松材线虫病与松树内生细菌的关系提供理论依据。
1 材料与方法
1.1 松材线虫接种体的制备
将灰葡萄孢菌(Botrytiscinerea)接种到PDA培养基上,放置在培养箱内,待菌丝长满整个培养基,然后将松材线虫虫株AMA3接种到灰葡萄孢菌上,放置于培养箱培养。将培养好的松材线虫采用贝尔曼漏斗法分离,将线虫液收集于15 mL离心管中,无菌水洗涤1次,调整线虫悬浮液至所需浓度。
1.2 马尾松样品的采集及预处理
2年生的健康马尾松苗定植后,采用人工皮接法接种松材线虫。用无菌解剖刀在松苗的茎干上割开树皮,深及木质部,掀开树皮塞入大小合适的棉球,用微量进液器注入线虫悬浮液,并用封口膜将其包裹好。处理组线虫接种量为5 000条/株,对照组接等量无菌水。接种后每天定时观察树苗的生长状况,松苗发病程度采取以下病情分级标准:0级,正常;1级,1/2以下叶褪绿、1/4以下叶发黄;2级,1/2以上叶褪绿、1/4~3/4叶发黄;3级,3/4以上叶发黄、1/2以下叶变红;4级,1/2以上叶变红、植株濒死或死亡[13]。
处理组在接种松材线虫前和接种后1、3、7 d和刚开始表现发病症状时进行取样,取样部位为茎干且包括接种点,质量大约1 g。对照组接无菌水,与上重复。样品的采集用无菌剪刀处理,一共9组样品,每组样品包含3个重复。采集后的样品置于冰上,带回实验室,用无菌水洗涤样本30 s,接着在体积分数70%的乙醇中浸泡2 min,再用体积分数2.5% NaClO(含0.1% Tween80)浸泡5 min后转移至体积分数70%乙醇浸泡30 s,最后使用无菌水洗涤植物组织3次即视为对植物组织表面进行无菌化处理,表面无菌化的植物组织进行液氮速冻,然后保存于冰箱-80 ℃备用[14-16]。
1.3 样品DNA提取与PCR扩增
根据FastDNA®SPIN Kit for Soil试剂盒的说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。用799F(5’-AACMGGATTAGATACCCKG-3’)和1392R(5’-ACGGGCGGTGTGTRC-3’)引物进行PCR扩增,一轮扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。用799F(5’-AACMGGATTAGATACCCKG-3’)和1193R(5’-ACGTCATCCCCACCTTCC-3’)引物对V5~V7可变区进行PCR扩增,二轮扩增程序为:95 ℃预变性3 min,13个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。扩增体系为4 μL 5×FastPfu Buffer,2 μL 2.5 mmol/L dNTPs,0.8 μL Forward Primer(5 μmol/L),0.8 μL Reverse Primer(5 μmol/L),0.4 μL FastPfu Polymerase,0.2 μL BSA,10 ng Template DNA,补ddH2O至20 μL。
1.4 Illumina Miseq测序与序列数据处理
PCR结束后,使用2%琼脂糖凝胶回收PCR产物,使用AxyPrepDNA凝胶回收试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建文库,利用Illumina公司的Miseq PE300平台进行测序。原始测序序列使用Trimmomatic软件质控,FLASH软件拼接,通过以上步骤最终得到有效数据。获得有效数据之后,使用UPARSE软件(version7.1http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对silva138/16s_bacterial数据库,设置比对阈值为70%,去除叶绿体与线粒体序列,最后按最小样本序列数抽平。测序在上海美吉生物医药科技有限公司完成,生信分析在美吉生物云平台cloud.majorbio.com中运行,原始数据上传至NCBI数据库中,项目登录号为PRJNA673085。
2 结果与分析
2.1 马尾松茎干内生细菌序列数
对接种前后的马尾松进行取样共得到27个样本,所有样本共得到472 356条优化序列,优化序列的平均长度为387 bp,所有优化序列被分配到30个门、75个纲、171个目、290个科、513个属、723个种、956个OTUs。通过在OTU水平作稀释曲线,可得出样本的测序深度情况。由图1可知随着测序量的不断増加,所有样本曲线趋于水平,说明各个样品的测序基本达到饱和状态,具有令人满意的置信水平。
2.2 松材线虫侵染后马尾松茎干内生细菌丰富度与多样性
从表1的丰富度指数得出,接种松材线虫后第1、3、7天,马尾松茎干内生细菌丰富度为处理组低于对照组,但差异不显著,而第18天即马尾松刚表现发病症状时,处理组显著高于对照组。处理组马尾松接种松材线虫后,内生细菌的丰富度出现波动,在第18天显著升高。从表1的多样性指数得出,接种松材线虫后第1、3、18天,马尾松茎干内生细菌多样性为处理组高于对照组,但差异不显著,而第7天处理组低于对照组,同样无显著性差异。处理组马尾松接种松材线虫后,内生细菌多样性升高,但无显著性差异。
2.3 松材线虫侵染后马尾松茎干内生细菌群落门属水平结构
在门水平上将所有样本中丰度占比均小于1%的物种合并为其他,属水平上将所有样本中丰度占比均小于5%的物种合并为其他,对组内重复样本求均值计算生成群落相对丰度表[17-19]。如表2所示,从门分类水平看,马尾松茎干内生细菌组成种类主要包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。处理组马尾松接种松材线虫后与接种前马尾松相比内生细菌组成种类没有发生变化。丰度方面,变形菌门变化趋势为先升高再降低,在第3天丰度达到最高值95%。放线菌门变化趋势为先降低再升高,在第3天丰度降到最低。厚壁菌门丰度呈升高趋势,但变化幅度不大。拟杆菌门丰度基本没有变化。对照组马尾松接无菌水后与接种前马尾松相比内生细菌组成种类同样没有发生变化,变形菌门、放线菌门丰度在较小范围内波动。厚壁菌门、拟杆菌门丰度基本没有变化。
如表3所示,从属分类水平看,处理组马尾松接种松材线虫后内生细菌组成种类及丰度变化较大,接种前马尾松中的优势属罗尔斯通氏菌属(Ralstonia)、红球菌属(Rhodococcus)在松材线虫侵染后丰度大幅度降低,肠杆菌科未分类属(unclassified_f_Enterobacteriaceae)在松材线虫侵染后丰度升高,第3天丰度达到最高29%,科萨克氏菌属(Kosakonia)在松材线虫侵染后丰度升高,但呈波动性变化,伯克氏菌属(Burkholderia)第18天丰度达到最高28%,其它菌属的丰度变化没有明显规律。对照组马尾松接无菌水后内生细菌组成种类及丰度无规律性变化。
Heatmap图可将高丰度和低丰度的物种分块聚集,通过颜色梯度及相似程度来反映多个样本在各分类水平上群落组成的相似性和差异性[20-21]。图2为马尾松茎干内生细菌群落属水平Heatmap图和样本聚类树分析,选取了丰度前50的菌属进行研究。红球菌属、罗尔斯通氏菌属的丰度在处理组中降低,对照组中基本没有变化。科萨克氏菌属、伯克氏菌属、固氮螺菌属(Azospirillum)的丰度在处理组中升高,对照组中基本没有变化。草螺菌属(Herbaspirillum)、假单胞菌属(Pseudomonas)、新鞘脂菌属(Novosphingobium)的丰度在处理组中先升高再降低,对照组中升高。克氏杆菌属(Klebsiella)、丛毛单胞菌属(Comamonas)的丰度在两组中均先升高再降低。样本聚类分析表明EG0、EG1、CK1的内生细菌优势属组成更为相似,CK3、CK7、CK18的内生细菌优势属组成更为相似,并且与EG3、EG7、EG18的内生细菌优势属组成存在差异。
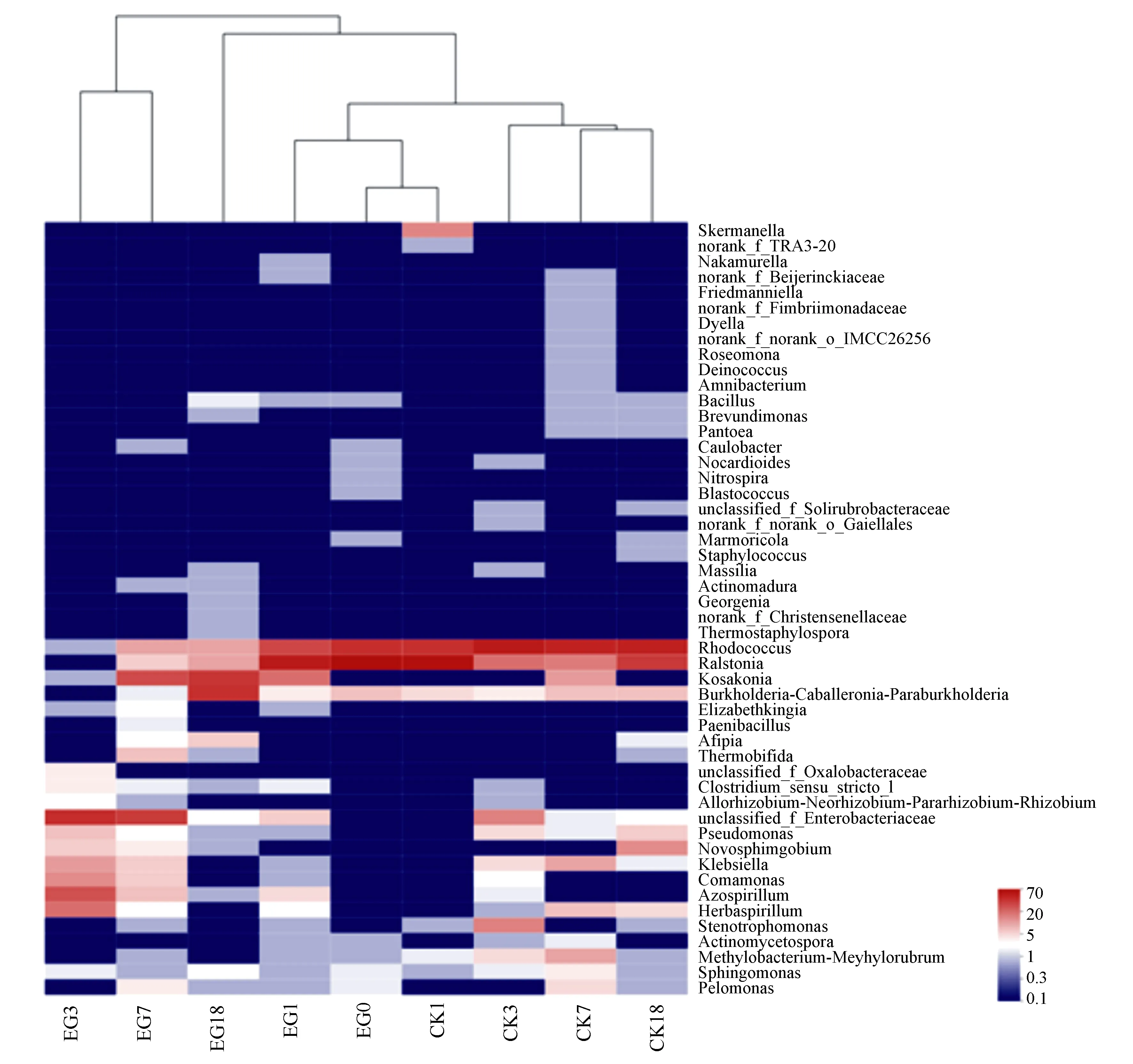
图2 马尾松茎干内生细菌属水平群落
2.4 松材线虫侵染后马尾松茎干内生细菌群落OTU水平结构
PCoA分析是一种非约束性的数据降维分析方法,可用来研究样本群落组成的相似性或差异性[22]。图3为OTU水平的PCoA分析,距离算法采用Abund_jaccard,PERMANOVA分析用于组间差异显著性检验。结果表明,处理组EG1、EG3、EG7、EG18、EG0之间形成了不同的内生细菌群落结构,PERMANOVA分析进一步证明了它们之间的显著性(P=0.006),而对照组中除了CK7,其余分组样本均没有与EG0形成不同的内生细菌群落结构。这说明马尾松受松材线虫侵染后,茎干内生细菌群落结构发生了显著变化(表4)。
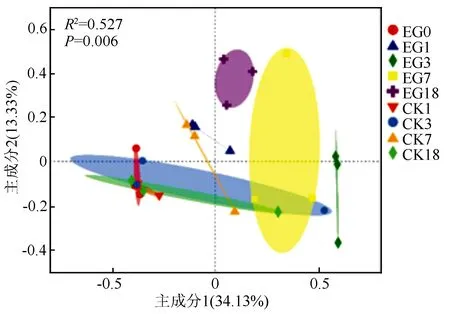
不同颜色或形状的点代表不同分组的样本。

表4 样本序列数据统计
3 结论与讨论
许多研究已经表明植物被病原菌感染后会影响寄主的微生物群落[23-24],所以松材线虫侵染亦可能对寄主的内生细菌群落结构产生影响。松树发生松材线虫病一般经过侵染期、潜育期、发病期和死亡期。刘军民等用水培法试验表明,接种24 h后,松材线虫立即自接种点向接种枝深处移动,2~3 d后,观察到侵入的松材线虫逐渐向主枝扩散[25]。陈玉惠等用离体枝接种松材线虫,2 d后,观察到线虫自接种点向上下扩散,并有少量线虫进入主枝,8~10 d后,移入主枝的线虫量增加,并见少量线虫进入非接种侧枝[26]。病原线虫群体的增长是在病树停止分泌松脂和出现外部症状后开始,当松树外部出现症状,在病树中能分离到大量线虫[27]。本研究在松材线虫侵染后的第1、3、7、18天进行取样,对人工接种松材线虫的2年生马尾松的茎干内生细菌群落进行动态分析。
本文通过Alpha多样性分析研究松材线虫侵染后的马尾松茎干内生细菌丰富度与多样性。丰富度指数表明,处理组马尾松茎干内生细菌丰富度上下波动,第18天显著升高。多样性指数表明,处理组马尾松茎干内生细菌多样性升高,但接种松材线虫前后无显著性差异。Proença et al.[10]的研究将海岸松感染松材线虫后按感病症状划分成6个阶段,松树茎部内生菌的丰富度指数与多样性指数在不同症状阶段的树木呈现出不同的指数,在病害的早期阶段多样性较低,后期阶段多样性更高。本研究虽然没有按感病症状划分阶段进行取样,但与Proença et al.[10]的研究结果基本吻合。内生细菌多样性的增加,这可能是由于病害导致植物抵御微生物入侵的能力丧失,或失去对内生菌生长的控制能力[28]。
群落结构组成分析中,所有样本主要检测出4个菌门,变形菌门、放线菌门、厚壁菌门、拟杆菌门。马尾松接种松材线虫后,茎干内生细菌组成种类没有发生变化,但变形菌门丰度升高。有研究表明,变形菌门是植物组织中常见的植物病原菌和寄生生物,能够引起多种植物病害[29],该菌门在松材线虫病的作用还需关注。另外,实验还发现厚壁菌门丰度亦升高,但幅度不大,有文献指出厌氧环境是厚壁菌门偏好的生长环境[30],这可能与松材线虫侵染导致茎干内部环境的改变有关。
属水平,马尾松接种松材线虫后,科萨克氏菌属、伯克氏菌属、固氮螺菌属、草螺菌属、假单胞菌属、新鞘脂菌属等丰度升高。其中伯克氏菌属、假单胞菌属在水体、土壤和植物中广泛存在,它们丰度的升高可能会引起某些植物病害[31-32],还有研究指出,荧光假单胞菌是松材线虫体表携带的一种致病菌,其和线虫共同导致松材线虫病的发生[9,33]。肠杆菌科未分类属丰度在第3、7天升高,可能与松材线虫的数量增加有关,Proença et al.[34]认为由于线虫的数量增加,在此阶段被线虫携带或能够粘附到线虫上的细菌大量存在,这些细菌主要包括肠杆菌科与黄色单胞菌科(Xanthomonadaceae)。植物被病原体侵染后,植物抗病性降低,大量外部细菌菌群更易侵染植物,导致其内生细菌种类增多,这可能是其它菌属丰度升高的原因。另外,罗尔斯通氏菌属、红球菌属丰度降低,可能与细菌之间的竞争有关,李阳在松树体内菌群对松材线虫侵染响应的研究中推测松材线虫的侵入打破马尾松体内细菌菌群的平衡,致病菌与马尾松体内菌经过复杂的拮抗与反拮抗作用,最终致病菌占优势大量繁殖,而有益菌减少或消失[12]。试验中发现,对照组中马尾松茎干内生细菌群落结构亦发生变化,这可能因为马尾松在接无菌水时会造成伤口,使大量外部细菌进入,从而导致内生细菌群落结构发生变化。
Heatmap图与群落结构组成分析的结果相一致,通过样本聚类树分析可知,样本EG0、EG1、CK1聚类到一起,表明健康马尾松在接种松材线虫或无菌水后1 d,茎干内生细菌优势属组成变化不大,可能因为松材线虫刚进入到马尾松体内,松材线虫在接种点初期几乎不移动或移动较慢[35],所以内生细菌优势属组成没有发生明显变化。样本CK3、CK7、CK18聚类到一起,表明接无菌水后的第3、7、18天,马尾松茎干内生细菌优势属组成变化不大。样本EG3、EG7、EG18分别单独聚类,表明受松材线虫侵染后,马尾松茎干内生细菌优势属组成会发生明显改变,而且这种变化与接无菌水后导致的变化不同。OTU水平的PCoA分析结果进一步表明,受松材线虫侵染后,马尾松茎干内生细菌群落结构发生了显著性变化。Proença et al.[34]的研究同样表明,海岸松感染松材线虫后,内生细菌的群落结构会发生显著性变化。本次研究的试验材料为2年生盆栽马尾松,处理组样本设置3个生物学重复,样本数量可能较少,导致试验误差的产生,所以有必要进一步以野生马尾松为试验材料,并增加生物学重复,开展更深入的研究。

