运输方式对马氏珠母贝(Pinctada fucata)稚贝存活率、生长、消化及抗氧化性能的影响探究*
李娇妮 廖秀睿 李 曦 吕 布 杨守国, 3 臧 战 VASQUEZ Herbert Ely 王爱民 郑 兴 顾志峰
运输方式对马氏珠母贝()稚贝存活率、生长、消化及抗氧化性能的影响探究*
李娇妮1, 2廖秀睿1, 2李 曦1, 2吕 布1, 2杨守国1, 2, 3臧 战1, 2VASQUEZ Herbert Ely1, 2王爱民1, 2郑 兴1, 2①顾志峰1, 2①
(1. 海南大学海洋学院 海南海口 570228; 2. 海南大学 南海海洋资源利用国家重点实验室 海南海口 570228; 3. 海南省海洋与渔业科学院 海南海口 571126)
为优化马氏珠母贝苗种运输技术, 提高运输效率, 以马氏珠母贝()稚贝为研究对象, 分别以有水和无水两种运输方式汽运8 h条件下开展实验, 比较分析其在运输前后、运输后恢复阶段的生长、消化和抗氧化性能。结果显示: 有水运输后存活率达98%, 无水运输97%; 在恢复期第14 d, 有水运输和无水运输存活率分别达97%、96%; 有水运输皮质醇含量由(2 607.61±15.27) μg/L显著降低至(1 412.98±5.09) μg/L, 无水运输后显著降低至(2 287.36±10.18) μg/L; 在恢复期第7 d和14 d皮质醇含量均呈逐渐上升趋势; 有水和无水运输后和恢复期淀粉酶活性不断上升, 且有水运输酶活性高于无水运输(0.05), 最高值为(1.43±0.05) U/mg prot; 有水和无水运输后及恢复期超氧化物歧化酶酶活性在不断下降, 最低下降至(16.00±0.14) U/mg prot, 有水运输超氧化物歧化酶活性均高于无水运输(0.05); 有水运输碱性磷酸酶、谷草转氨酶和谷丙转氨酶活性均上升, 无水运输均下降; 在恢复阶段, 碱性磷酸酶活性在不断下降, 谷草转氨酶和谷丙转氨酶活性在不断上升。有水和无水运输会对马氏珠母贝稚贝产生不同的影响, 有水运输方式相对无水运输方式可使马氏珠母贝稚贝在后期阶段具有更好的存活效果和生长状态。
马氏珠母贝; 稚贝; 有水运输; 无水运输; 生长; 消化性能; 抗氧化能力
马氏珠母贝(), 又称合浦珠母贝, 属于软体动物门(Mollusca)、双壳纲(Bivalvia)、珍珠贝目(Pterioida)、珍珠贝科(Pteriidae)、珠母贝属(), 是我国培育海水珍珠的主要种类之一(Yamamoto, 2020; 魏雯璐等, 2021)。苗种运输是水产养殖活动中不可或缺的环节之一, 海区养殖、品种推广、商品交易、增殖放流等过程都有所涉及(邓正华等, 2020)。目前水产品的运输方法多样, 有水运输(Tacchi, 2015)、尼龙袋充氧运输(张成林等, 2016)、无水湿法运输(刘霆等, 2010; 张恒等, 2010)、麻醉运输(Cooke, 2004; 王文豪等, 2018)等都是常用的运输方法。从运输介质角度而言, 水产品运输可大致分为有水运输和无水运输方式。
运输过程是发生在一定较小空间范围内, 且过程会持续一段时间的活动, 因此会对生物体本身产生一定胁迫影响, 其中涉及胁迫因素较多, 如拥挤程度(密度)、水质变化、溶解氧、温度等(王文博等, 2004; 孙鹏等, 2014; 张勇, 2016)。运输活动对于水生生物体生理相关影响的研究目前主要集中在鱼类、棘皮动物等品种(Erikson, 1997; 孙鹏等, 2014), 而在双壳贝类中目前较少报道。在马氏珠母贝等双壳贝类生产活动中, 运输过程也是不容忽略的, 缺乏科学方法的指导及运输后的有效管理手段, 将导致苗种运输后的大量折损, 影响生产效益(Carneiro, 2002; Acerete, 2004)。
本文以马氏珠母贝稚贝为研究对象, 开展实际运输试验, 分别以有水运输和无水运输方式从广西北海汽运至海南文昌, 开展运输过程及恢复期对其存活、生长、消化和抗氧化性能的影响研究, 以期探究出运输过程及运输后恢复过程关键点所在, 为优化其苗种运输技术及运输后管理技术提供科学依据。
1 材料与方法
1.1 实验材料
本实验所用马氏珠母贝稚贝为课题组在广西北海育苗场繁育所得, 待其生长至稚贝阶段选择规格齐整的个体作为实验材料。所选实验稚贝体重为(6.56±0.01) mg, 壳长(4.09±0.23) mm, 壳高(3.16±0.23) mm,=6 000。
1.2 实验设计
运输胁迫处理为实际运输操作处理, 为8 h的运输时间, 汽车运输室内温度约为20 °C, 实验准备约3 000只稚贝进行有水运输, 将其放入五个网袋中, 水体体积为35 L, 水温控制为(20±2) °C, 运输过程持续充氧。约3 000只稚贝进行无水运输, 泡沫箱内温度控制为(15±3) °C, 中间用泡沫板隔着, 一边放冰块使其运输环境保持低温, 另一边底部用泡沫块垫着, 防止冰水直接接触稚贝, 在运输箱底部加入少量海水, 然后将放入网袋的稚贝放在泡沫垫上方, 再将多张用海水浸湿的报纸铺在网袋上, 作为保湿处理(图1), 用湿度测量仪测试湿度, 将湿度控制在80%RH左右。
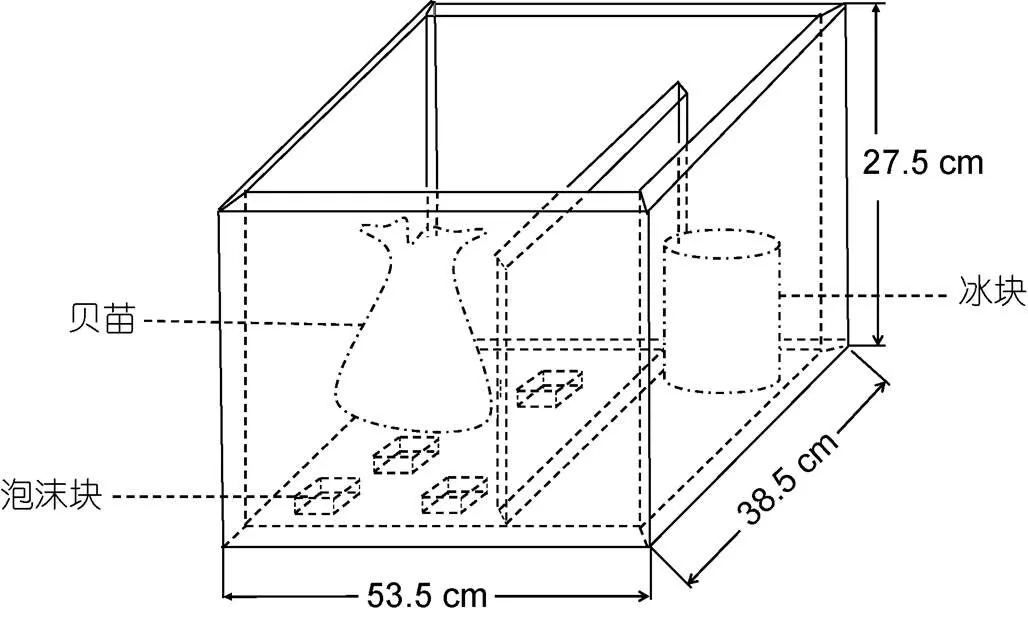
图1 无水运输结构装置模式图
相同运输条件下试验样品分为三个组别: (1) 运输前样品,作为对照组, 不同运输方式共用对照组样品; (2) 运输后样品, 为经过8 h运输后所得样品; (3) 恢复期样品, 为运输后放入养殖水体中恢复的样品, 分别在恢复第7 d及14 d进行取样分析。
运输前和运输后养殖条件和管理手段基本一致, 水温为(27.5±1.0) °C, 盐度31.5±0.5, 每天换2/3的水, 投喂湛江等边金藻()、牟氏角毛藻()、亚心形扁藻()的混合藻液。
1.3 样品的获得及处理
在运输试验前, 将部分马氏珠母贝稚贝作为对照组样品放入液氮中, 剩余稚贝分别采用有水运输和无水运输两种方式进行运输, 并在运输完成后分别随机取样放入液氮中, 并将剩余的稚贝放入养殖池中进行暂养回复, 在恢复第7 d、14 d取样液氮保存。取样及样品处理方法为: 取100只稚贝在冰面上解剖取其内脏团, 准确称取待测大珠母贝内脏团的重量, 按重量(g)︰体积(mL)=1︰9的比例加入9倍体积的生理盐水, 冰水浴的条件下机械摇匀, 2 500 r/min, 离心10 min, 取上清液用于酶活性测定, 每个样品重复测定3次。
1.4 检测指标及方法
(1) 形态指标: 在数码显微镜下进行测量, 主要为壳长(HL)、壳高(SH), 见图2。
(2) 质量指标: 为体重(mg), 通过万分天平进行测量。
(3) 存活率(%)=100%×21, 式中,1、2分别为随机抽取总数和存活的个数。
(4) 生理指标: 采用南京建成生物科技有限公司的生化试剂盒进行淀粉酶(α-AMS)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)和皮质醇(COR)的含量的检测, 操作方法严格按照说明书所示的方法进行。
1.5 数据处理及统计分析
实验数据以平均值±标准差(Mean±SD)表示。使用DPS统计软件进行差异显著性分析, 当0.05时认为存在显著性差异。
2 结果
2.1 运输方式对马氏珠母贝稚贝生长状态的影响
不同运输方式对马氏珠母贝稚贝后期恢复阶段体重增加速度、壳长和壳高有显著影响(0.05); 对存活率无显著性影响(0.05, 表1)。有水运输后第7 d和第14 d的体重分别为(8.68±0.02)、(17.87±0.01) mg, 显著高于无水运输[(7.25±0.03)、(10.53±0.02) mg]; 有水运输后第14 d的壳高和壳长分别为(5.66±0.29)、(6.31±0.25) mm, 显著高于无水运输[(4.81±0.26)、(5.52±0.23) mm]。
2.2 运输方式对马氏珠母贝皮质醇含量的影响
不同运输模式对皮质醇的含量有显著影响(0.05, 图3), 有水运输8 h后, 皮质醇含量由(2 607.61±15.27) μg/L降低至(1 412.98±5.09) μg/L, 无水运输后也显著降低至(2 287.36±10.18) μg/L。
运输结束后的恢复阶段, 不同运输方式的皮质醇含量恢复程度之间存在显著差异(0.05), 有水运输皮质醇含量逐步升高, 在恢复期的第7 d和第14 d分别升高至(1 481.34±10.18)、(2 296.96 ±25.27) μg/L。无水运输后皮质醇含量先降低后升高, 在第7 d和第14 d分别降低和升高至(1 736.82±5.09)、(2 544.04±4.15) μg/L。
表1 不同运输方式对马氏珠母贝稚贝生长的影响
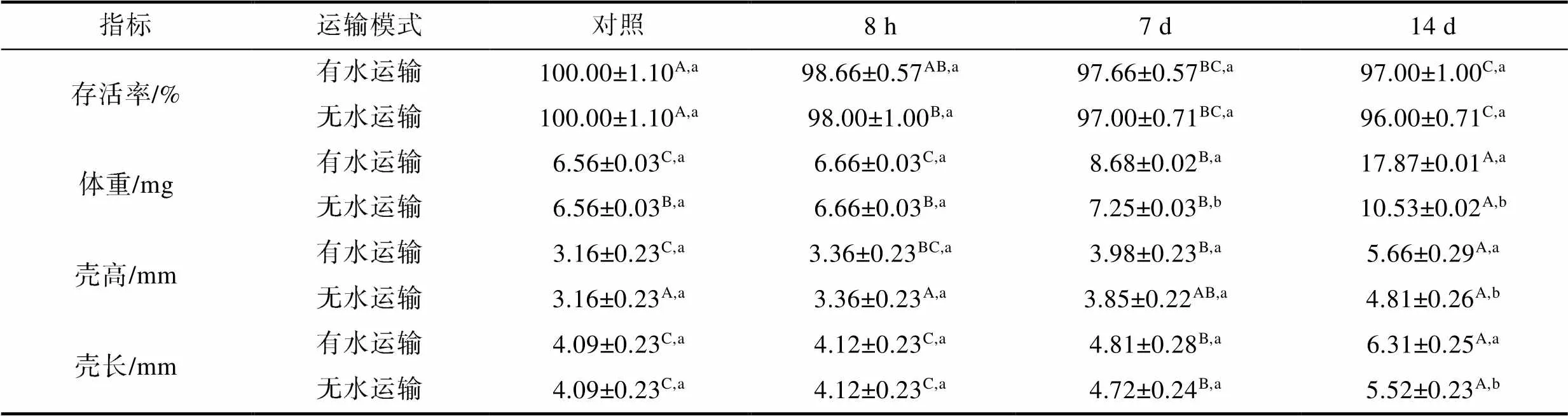
Tab.1 Effects of different transportation modes on growth of P. fucata juvenile
注: 不同大写字母代表相同运输方式下不同组别之间存在显著性差异(<0.05); 不同小写字母代表相同组别的不同运输方式之间存在显著差异(<0.05)。下同
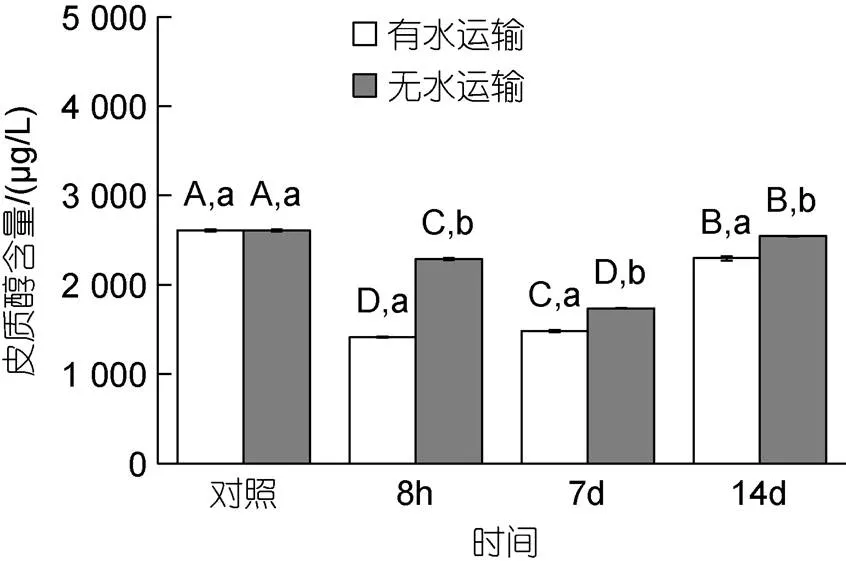
图3 不同的运输方式对马氏珠母贝稚贝皮质醇含量的影响
2.3 运输方式对马氏珠母贝稚贝部分消化酶的影响
不同运输方式对淀粉酶活性表达具有显著影响(0.05, 图4)。有水运输8 h后, 淀粉酶活性由(0.27±0.05) U/mg prot显著升高至(0.91±0.05) U/mg prot, 无水运输则无显著变化[(0.35±0.09) U/mg prot]。

图4 不同运输方式对马氏珠母贝稚贝淀粉酶活性的影响
运输结束后放入养殖室中的恢复阶段, 不同运输方式的淀粉酶活性恢复程度之间存在显著差异(0.05)。有水运输淀粉酶活性逐步升高, 在恢复期第14 d显著增高至(1.43±0.05) U/mg prot, 无水运输在恢复期第7 d和14 d分别显著升高至(0.68±0.03)、(1.33±0.07) U/mg prot。
2.4 运输方式对马氏珠母贝稚贝部分抗氧化性能的影响
不同运输方式对马氏珠母贝稚贝超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)活性产生显著影响(0.05, 图5)。有水运输8 h后SOD活性呈显著下降趋势(0.05), 活性分别由(101.56±1.33) U/mg prot显著下降至(67.5±5.41) U/mg prot。AKP呈上升的趋势, 由(149.21±9.92) U/g prot上升至(153.39±10.02) U/g prot。GOT和GPT活性呈显著上升趋势(0.05), 活性分别由(60.50±0.79)、(53.65±0.74) U/g prot显著上升至(76.32±0.64)、(59.63±0.13) U/g prot。无水运输8 h后, SOD、AKP、GOT和GPT活性都呈显著下降的趋势(0.05), 分别显著下降至(32.03±0.51) U/mg prot、(63.91±8.40)、(32.35±1.40)、(14.04±2.58) U/g prot。
运输结束后的恢复阶段, 不同运输方式SOD、AKP、GOT、GPT酶活性恢复程度之间存在显著差异(0.05), 两种运输后的恢复水平类似。有水运输SOD和AKP在恢复期第7 d和第14 d呈显著下降的趋势(0.05), SOD活性分别降低至(65.81±6.15)、(16.00±0.14) U/mg prot, AKP活性分别下降至(104.92±4.45) U/g prot。无水运输后SOD活性呈先上升后下降的趋势(0.05), 在恢复期第7 d上升至(65.81±6.15) U/mg prot, 在第14 d下降至(16.00±0.14) U/mg prot。AKP活性呈先下降后上升的趋势(0.05), 第7 d下降至(104.92±4.45) U/g prot在第14 d上升至(90.54±2.06) U/g prot。有水运输后GOT和GPT活性都呈先下降后上升的趋势(<0.05), 在第7 d分别下降至(43.81±1.19)、(26.51±0.09) U/g prot, 在第14 d上升至(115.32±4.32)、(40.56±0.65) U/g prot。无水运输后GOT和GPT活性都呈上升的趋势(<0.05), GOT在第7 d和第14 d分别上升至(45.17±3.82)、(108.61±0.81) U/g prot, GPT在第7 d和第14 d分别上升至(28.65±1.55)、(45.90±1.38) U/g prot。
3 讨论
3.1 运输方式对马氏珠母贝稚贝生长的影响
运输方式有很多种, 本文在同一环境下分别进行有水运输和无水运输试验。运输胁迫会一定程度上影响贝类的生理状态, 造成体内多项生理生化指标的变化(Acerete, 2004; 马壮等, 2020)。合适、科学的运输方式不会引起运输动物的大量死亡, 如0.1 g规格大小的大黄鱼()幼鱼在运输密度20尾/L, 盐度为25的有水运输条件下其存活率可达99.23% (张伟等, 2014)。本实验研究结果表明马氏珠母贝稚贝在有水运输后存活率可达98%, 无水运输存活率为97%; 有水运输在恢复阶段第14 d的存活率达97%, 稍高于无水运输, 与邓正华等(2020)关于合浦珠母贝幼苗48 h内不同运输条件下所得研究结果较为一致。马氏珠母贝苗种运输工作中, 有水运输在氧气充足且水分充足的条件下马氏珠母贝稚贝生命力更强, 相对无水运输在低温休眠状态下的运输方式具有更好的存活效果和状态恢复效果。
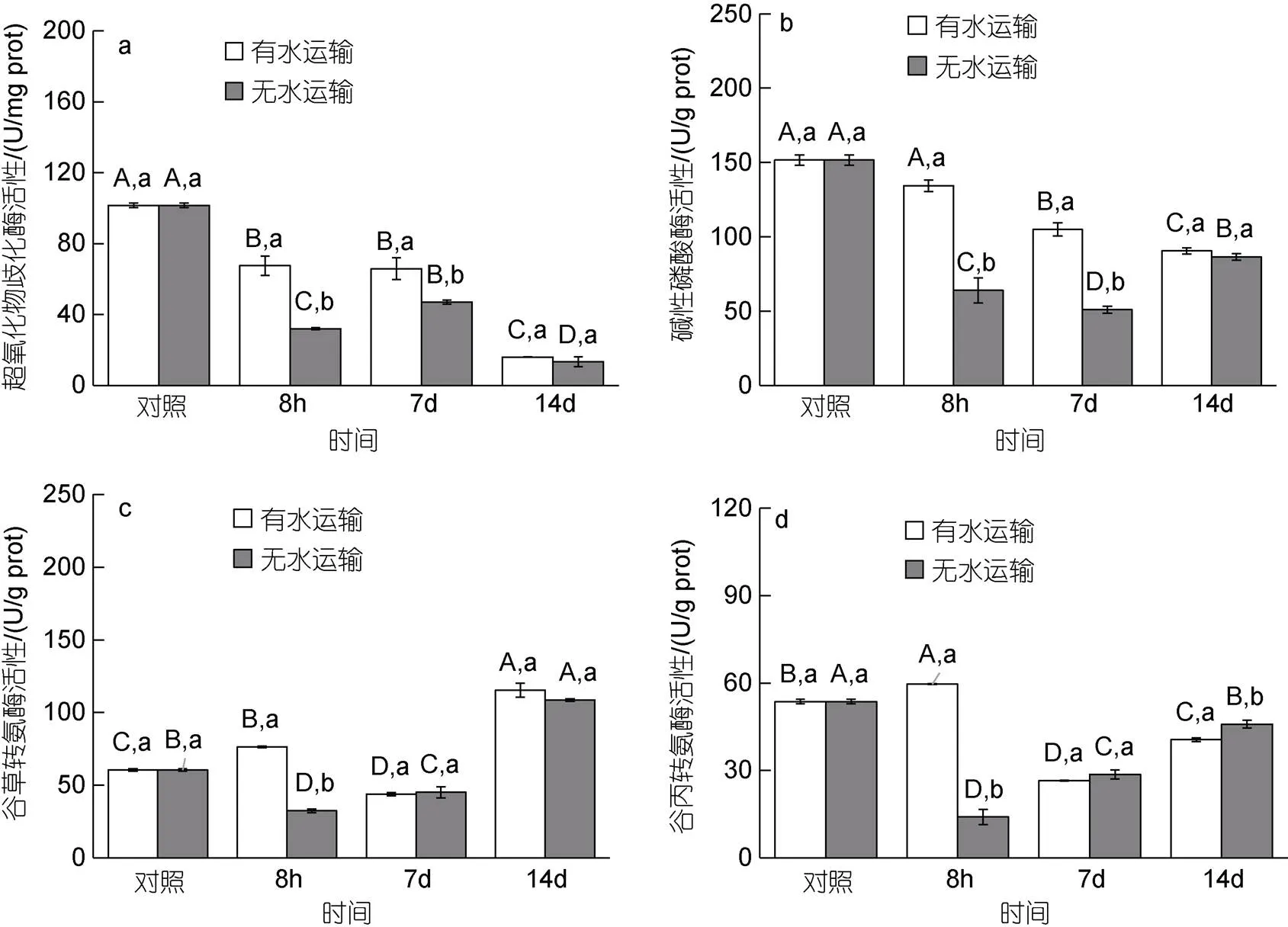
图5 不同运输方式下对马氏珠母贝稚贝超氧化物歧化酶(a)、碱性磷酸酶(b)、谷草转氨酶(c)、谷丙转氨酶(d)活性的影响
3.2 运输方式对马氏珠母贝稚贝皮质醇含量的影响
皮质醇含量的变化是体现应激程度的重要生理学指标之一, 一般情况下水产动物经运输胁迫后皮质醇含量会升高, 并造成生理系统紊乱、代谢系统失调等系列反应(Iversen, 2005; Sulikowski, 2005; Höglund, 2020)。但本实验研究结果发现马氏珠母贝稚贝8 h运输后皮质醇含量呈先降低后再升高趋势, 与上述研究结果较不一致, 其原因可能在于实验条件及实验对象生理状态差异, 且本文运输过程中有水运输水温控制在18 °C左右, 无水运输箱内环境温度在13 °C左右, 试验动物相对一直处于温度较低环境, 而低温环境在一定程度上可对机体形成一定麻痹作用, 从而降低应激程度、也会抑制相关生物酶活力(Babiak, 2001; 闫秀明等, 2011)。
3.3 运输方式对马氏珠母贝稚贝消化性能的影响
消化酶的主要功能是消化和分解生物从外界摄取的食物, 为个体提供生长、发育、繁殖等活动等所需的能量, 其活性大小能够反映水产生物消化生理的基本特征(陈吉圣等, 2021)。本实验研究结果发现马氏珠母贝稚贝8 h运输后, 其淀粉酶呈上升的趋势, 且在恢复期不断上升, 有水运输后其淀粉酶活性较强于无水运输, 这可能是由于机体在后期生长过程中需要更多能量去抵抗外界的干扰、满足基础生理需求所致。本文涉及的恢复期持续时间相对较长, 可更全面地反映运输后马氏珠母贝稚贝后期的生理修复情况, 结果表明本实验条件下马氏珠母贝稚贝在有水运输过程中其消化系统受到的应激刺激相对较小, 与实验条件下的无水运输环境相比其机体消化性能在后期相对更好。
3.4 运输方式对马氏珠母贝稚贝抗氧化性能的影响
抗氧化系统是清除体内过量的活性氧, 保护机体不受氧化损伤, 可分为非酶促和酶促系统(Mathew, 2007; 于振兴等, 2021)。在贝类抗氧化系统性能评价中, SOD、AKP、GOT和GPT等是最常见的评价指标(Samsonova, 2003; 李大鹏等, 2008; Liang, 2020)。SOD活性可反映生物体的氧化损伤程度, 活性下降代表着清除能力的下降(段鸣鸣等, 2014), AKP、GOT和GPT活性则可反应机体的抗氧化水平及免疫健康状态(Muta, 1996; Li, 2004; 王香丽等, 2015)。运输活动一般都会对运输动物的抗氧化酶活力造成一定影响, 本文结果表明马氏珠母贝稚贝运输活动后SOD活性发生降低, 与大菱鲆()、脊尾白虾()等运输相关的研究结果较为一致(马壮等, 2020; 邓高威等, 2021), 其原因可能是运输胁迫使机体体内积累大量自由基而造成的机体损伤, 致使其抗氧化能力下降(陈成勋等, 2011)。AKP、GOT和GPT在本研究中呈先上升后下降再上升的趋势, 表明马氏珠母贝稚贝在运输过程中会因相关因素的胁迫而产生一定程度的应激反应, 而AKP、GOT和GPT酶活性的提高可降低机体过氧化应激, 在一定程度上减缓机体的氧化损伤程度(赛娜等, 2011; 尤宏争等, 2018)。马氏珠母贝稚贝在水体的保护之下, 活动的空间较大, 贝苗之间不会接触过多。而无水运输过程中, 贝苗的活动范围较小, 贝苗与贝苗之间会产生碰撞摩擦, 可能使其产生更强烈的应激。抗氧化酶活性的变化结果表明马氏珠母贝稚贝在有水运输后的抗氧化性能较优于无水运输, 健康状况更佳。
4 结论
有水运输和无水运输在一定条件下对马氏珠母贝稚贝生长、消化性能、抗氧化性能可产生显著影响, 且运输后需要一定时间进行机体机能的修复。在8 h运输时间内有水运输效果及后期生理恢复情况相对较佳, 生长更好。运输后的马氏珠母贝机体需要一定时间恢复至正常状态, 再将其移入海中开展养成或进行其他处理时至少需要7 d的修复时间, 使其机体性能得到修复及加强, 继而适应或抵抗其他不良环境因素。
于振兴, 任宪云, 邵慧鑫, 等, 2021. 低温胁迫对日本对虾抗氧化系统和细胞凋亡的影响[J]. 渔业科学进展, 42: DOI: 10.19663/j.issn2095-9869.20210108001.
马壮, 田涛, 吴忠鑫, 等, 2020. 运输胁迫对大菱鲆生理免疫影响的初步探究[J]. 安徽农学通报, 26(4): 74-83.
王文博, 汪建国, 李爱华, 等, 2004. 拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J]. 中国水产科学, 11(5): 408-412.
王文豪, 董宏标, 孙永旭, 等, 2018. MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果[J]. 南方水产科学, 14(6): 52-58.
王香丽, 麦康森, 徐玮, 等, 2015. 蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响[J]. 中国海洋大学学报, 45(9): 49-53.
尤宏争, 石洪玥, 贾磊, 等, 2018. 短途运输胁迫对珍珠龙胆石斑鱼血清酶活力及葡萄糖含量的影响[J]. 经济动物学报, 22(2): 72-77, 84.
邓正华, 陈明强, 李有宁, 等, 2020. 不同运输条件对合浦珠母贝稚贝存活比较[J]. 上海海洋大学学报, 29(1): 36-44.
邓高威, 段健诚, 王玉, 等, 2021. 干露胁迫对脊尾白虾存活率及氧化应激反应的影响[J]. 水产科学, 40(2): 244-249.
刘霆, 杨兴, 李道友, 等, 2010. 商品鲟鱼低温无水运输技术[J]. 贵州农业科学, 38(10): 149-150.
闫秀明, 张小雪, 2011. 超低温冷冻对黄鳝精子中几种酶活性的影响[J]. 水生生物学报, 35(5): 882-886.
孙鹏, 柴学军, 尹飞, 等, 2014. 运输胁迫下日本黄姑鱼肝脏抗氧化系统的响应[J]. 海洋渔业, 36(5): 469-474.
李大鹏, 刘松岩, 谢从新, 等, 2008. 水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J]. 水生生物学报, 32(3): 327-332.
张成林, 管崇武, 张宇雷, 2016. 鲜活水产品主要运输方式及发展建议[J]. 中国水产(11): 106-108.
张伟, 王有基, 李伟明, 等, 2014. 运输密度和盐度对大黄鱼幼鱼皮质醇、糖元及乳酸含量的影响[J]. 水产学报, 38(7): 973-980.
张恒, 李文谦, 程君晖, 等, 2010. 食用酒精对淡水鱼无水保活保鲜品质的影响[J]. 江苏农业科学(2): 297-300.
张勇, 2016. 空气暴露及运输胁迫对美洲鲥亲鱼生理生化指标及基因表达的影响[D]. 南京: 南京农业大学: 84.
陈吉圣, 席世改, 秦传新, 等, 2021. 光照强度对紫海胆浮游幼体生长及消化酶活性的影响[J]. 渔业科学进展, 42(3): 125-131.
陈成勋, 邢克智, 孙学亮, 2011. 急性拥挤胁迫对半滑舌鳎血液指标的影响[J]. 华北农学报, 26(1): 229-233.
段鸣鸣, 王春芳, 谢从新, 2014. 维生素D3对黄颡鱼幼鱼抗氧化能力及免疫功能的影响[J]. 淡水渔业, 44(3): 80-84.
赛娜, 宋凯, 2011. 运输胁迫对牙鲆血液生化指标的影响[J]. 黑龙江畜牧兽医(13): 151-152.
魏雯璐, 刘琪, 张丞澍, 等, 2021. 不同温度下马氏珠母贝干露耐受能力及其免疫相关基因表达的变化[J]. 广东海洋大学学报, 41(2): 69-75.
ACERETE L, BALASCH J C, ESPINOSA E,, 2004. Physiological responses in Eurasian perch (, L.) subjected to stress by transport and handling [J]. Aquaculture, 237(1/4): 167-178.
BABIAK I, GLOGOWSKI J, GORYCZKO K,, 2001. Effect of extender composition and equilibration time on fertilization ability and enzymatic activity of rainbow trout cryopreserved spermatozoa [J]. Theriogenology, 56(1): 177-192.
CARNEIRO P C F, URBINATI E C, 2002. Transport stress in matrinxã,(Teleostei: Characidae), at different densities [J]. Aquaculture International, 10(3): 221-229.
COOKE S J, SUSKI C D, OSTRAND K G,, 2004. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass () [J]. Aquaculture, 239(1/4): 509-529.
ERIKSON U, SIGHOLT T, SELAND A, 1997. Handling stress and water quality during live transportation and slaughter of Atlantic salmon () [J]. Aquaculture, 149(3/4): 243-252.
HÖGLUND E, KORZAN W, ÅTLAND Å,, 2020. Neuroendocrine indicators of allostatic load reveal the impact of environmental acidification in fish [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 229: 108679.
IVERSEN M, FINSTAD B, MCKINLEY R S,, 2005. Stress responses in Atlantic salmon (L.) smolts during commercial well boat transports, and effects on survival after transfer to sea [J]. Aquaculture, 243(1/4): 373-382.
LI J, CAI Y, NARAYANAN K R,, 2004. On the bit-error rate of product accumulate codes in optical fiber communications [J]. Journal of Lightwave Technology, 22(2): 640-646.
LIANG W, WU R Y, YANG T Z,, 2020. Effect of pathogenic bacteria on a novel C-type lectin, hemocyte and superoxide dismutase/alkaline phosphatase activity in[J]. Fish & Shellfish Immunology, 102: 185-194.
MATHEW S, KUMAR K A, ANANDAN R,, 2007. Changes in tissue defence system in white spot syndrome virus (WSSV) infected[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 145(3): 315-320.
MUTA T, IWANAGA S, 1996. The role of hemolymph coagulation in innate immunity [J]. Current Opinion in Immunology, 8(1): 41-47.
SAMSONOVA M V, MIN'KOVA N O, LAPTEVA T I,, 2003. Aspartate and alanine aminotransferases in early development of the keta [J]. Russian Journal of Developmental Biology, 34(1): 14-18.
SULIKOWSKI J A, FAIRCHILD E A, KENNELS N,, 2005. The effects of tagging and transport on stress in juvenile winter flounder,: implications for successful stock enhancement [J]. Journal of the World Aquaculture Society, 36(1): 148-156.
TACCHI L, LOWREY L, MUSHARRAFIEH R,, 2015. Effects of transportation stress and addition of salt to transport water on the skin mucosal homeostasis of rainbow trout () [J]. Aquaculture, 435: 120-127.
YAMAMOTO S, TSUTSUI T, SAGUCHI T,, 2020. Effect of different microalgal diets on the growth performance of Japanese pearl oysterbroodstock [J]. Aquaculture Research, 51(11): 4809-4813.
THE EFFECT OF TRANSPORTATION MODE ON SURVIVAL, GROWTH, DIGESTION AND ANTIOXIDANT CAPACITY OFJUVENILES
LI Jiao-Ni1, 2, LIAO Xiu-Rui1, 2, LI Xi1, 2, LYU Bu1, 2, YANG Shou-Guo1, 2, 3, ZANG Zhan1, 2, VASQUEZ Herbert Ely1, 2, WANG Ai-Min1, 2, ZHENG Xing1, 2, GU Zhi-Feng1, 2
(1. Ocean College, Hainan University, Haikou 570228, China; 2. State Key Laboratory of Marine Resource Utilization in South China Sea, Hainan University, Haikou 570228, China; 3. Hainan Academy of Ocean and Fisheries Sciences, Haikou 571126, China)
To optimize the transportation technology and efficiency ofjuveniles, the survival, growth, digestion, and antioxidant capacity were studied after 8-h automobile transportation with or without water and in 7~14-day recovery. Results show that after the transportation with and without water, the survival rate was 98% and 97%, and remained high after 14-day recovery at 97% and 96%, respectively. After transportation, the cortisol decreased significantly from (2 607.61±15.27) to (1 412.98±5.09) μg/L in with-water case, while decreased to (2 287.36±10.18) μg/L in without-water case. In the recovery stage, the cortisol trended to increase gradually; and the amylase activity was increased continuously, being much higher with water [max. (1.43±0.05) U/mg prot]] than that without water. The superoxide dismutase (SOD) activity decreased continuously [min. (16.00±0.14) U/mg prot], of which with-water case was higher than without water (<0.05). The activity of alkaline phosphatase (AKP), glutamic oxaloacetic transaminase (GOT), and glutamic pyruvic transaminase (GPT) were increased in with-water case, while decreased in without-water case. In the recovering stage after transportation, AKP activity was decreased continuously, while GPT and GOT increased. Therefore, effects of transportation mode (with/without water) on growth performance ofjuveniles were different. In general, the survival and growth ofjuvenile by with-water transportation were better than those with no water.
; juveniles; transported with water; transported without water; growth; digestive performance; oxidation resistance
*海南省自然科学青年基金, 320QN207号; 国家自然科学基金项目, 31772847号; 海南大学科研启动基金, KYQD(ZR)20061号。李娇妮, 硕士研究生, E-mail: 956249939@qq.com
郑 兴, 博士, 讲师, E-mail: zhengxing_edu@163.com; 顾志峰, 教授, E-mail: guzhifeng@hainanu.edu.cn
2021-08-30, c
2021-09-29
S981.3
10.11693/hyhz20210800191

