海州常山叶片实时荧光定量PCR 的内参基因选择
华雅洁,岳远征,杨秀莲*,何 卿
(1.南京林业大学,南方现代林业协同创新中心,江苏 南京 210037;2.江苏省环境科学研究院,江苏省环境工程重点实验室,江苏 南京 210036)
海州常山(Clerodendrum trichotomumThunb.),又名臭梧桐,为马鞭草科(Verbenaceae)赪桐属(ClerodendrumL.),灌木或小乔木,广泛分布于我国华北、华东、中南、西南等各省区[1]。海州常山夏季花朵洁白美丽,花期较长,秋冬亮蓝色的果实悬挂于枝头,是秋冬季节别具特色的观果植物,有较好的观赏性,且海州常山根系强壮,自然条件下在干旱瘠薄的砂石、石灰岩山地和贫瘠的山地野生分布,栽培管理简单,具有强的耐盐碱、抗旱、耐瘠薄、耐阴、抗有害气体等能力,可作为荒地与盐碱地的生态修复树种[2]。总体来说,海州常山是集观赏与优良抗性为一体的极具开发潜力的木本花卉。
然而,现在对海州常山的研究主要集中于种质资源收集[3]、快繁体系培育[4]、植物生理抗逆性[5]、药物成分开发[6]等,对于海州常山分子生物学的研究十分匮乏,海州常山内参基因的筛选及表达尚未见有文献发表,连对马鞭草科植物可稳定使用的内参基因筛选也是知之甚少。本研究对海州常山进行盐胁迫、干旱胁迫和热害胁迫,运用实时荧光定量PCR,并通过 GeNorm、NormFinder、BestKeeper及ReFinder 软件综合分析,筛选出适合海州常山叶片非生物胁迫下使用的内参基因,为海州常山深入分析分子机制研究及优良的抗性基因开发奠定良好基础。
1 材料与方法
1.1 植物材料与胁迫处理
本实验使用了种植于南京林业大学白马研究教学基地(119.02° E,31.65° N)海州常山种质资源库中盐城种源的海州常山(盐城种源为收集于盐城地区的野生种,并于2015 年定植于南京林业大学白马研究教学基地海州常山种质资源库)。2018年采集盐城种源种子,种子种植于珍珠岩、蛭石、泥炭和沙子(1∶1∶1∶2)的混合物中,放置在光周期14 h、温度25/21℃(昼/夜)、光照强度180 mmol·m-2·s-1、相对湿度60%的生长箱(RDN-1 000-3,中国宁波东南仪器厂)中培养,待长出8 片以上真叶,取长势大致相同的1 年生实生苗进行非生物胁迫实验。
在进行实验前,将幼苗放入四分之一强度的Hoagland 培养基中适应2 周,适应过程中,海州常山幼苗未见不适应情况,经观察幼苗还在继续长叶生长,且长势良好。在进行盐胁迫时,将幼苗转入含100 mmol·L-1NaCl 的Hoagland 培养基中;在进行干旱胁迫时,将幼苗转入含100 mmol·L-1PEG6000 的Hoagland 培养基中;在进行热害胁迫时,将幼苗置于45 ℃/35 ℃(昼/夜)的生长室内进行高温处理。各胁迫均在处理0、2、6、12、24、48 和72 h 时采取3 个生物学重复植物叶片,叶片均采自于从上至下第 2 至第 4 对叶片,每次胁迫使用21 棵幼苗,采取过叶片的植物便不再作为实验材料再取叶片,采取后立即将叶片放入无菌无酶的离心管中并投入液氮中,放置在-80 ℃下的超低温冰箱中储存备用,直至 RNA 提取。所有实验处理及采样均在上文所述人工培养箱中完成,尽量减少其他无关变量对实验的影响。
1.2 RNA 提取及cDNA 合成
RNA 提取采用北京艾德莱生物有限公司的EASY spin Plus 试剂盒,用 1.5%的琼脂糖凝胶电泳验证 RNA 的完整性,使用Mettler 公司生产的核酸检测仪 UV5NANO 检测 RNA 质量及浓度。使用北京全式金公司的 EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒进行反转录,-20 ℃保存。
1.3 候选内参基因的选择与引物合成
根据文献查询植物中常用的内参基因,在海州常山转录组数据库中寻找同源基因,用 NCBI 中Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)功能进一步确认注释信息和比对结果,选定所需的基因。在海州常山转录组数据库中寻找各候选基因的保守序列,根据基因保守序列用 Primer Premier 5.0 设计引物,再用 Oligo7 进行分析,引物设计原则参考Ding 等的方法[7],所使用引物均在南京金斯瑞公司合成。将所设计的引物进行常规 PCR,并用 1.5%的琼脂糖凝胶电泳检测,按照 TaKaRa公司的 Agarose Gel Extraction Kit 凝胶回收盒对PCR 产物进行回收,连到大肠杆菌载体上并送南京金斯瑞公司测序。将测序得到的序列与所设计的序列用 DNAMAN 进行比对,确定内参候选基因。
1.4 qRT-PCR 反应条件
使用 TakaRa 公司的 Ex TaqTM染料进行 qRTPCR,荧光定量仪型号为赛默飞公司的 plied Biosystems StepOne PCR System,所有 qRTPCR 反应进行3 次生物重复和3 次技术重复,并与无模板阴性对照平行进行。qRT-PCR 反应组分体系及反应条件如下:反应体系共计10 μL,其中,cDNA 1 μL,ROX 0.2 μL,正向引 物 0.4 μL,反向引物 0.4 μL,SYBR 染料5 μL,ddH2O 4 μL。反应程序为:95 ℃ 0.5 min,1 个循环;95 ℃0.75 min,60 ℃ 0.5 min,共计40 个循环,95 ℃0.25 min,60 ℃ 1 min,95 ℃ 0.25 min,1 个循环。
1.5 内参基因特异性与扩增效率检验
以混合 cDNA 为模板,反应体系同上文,以 5为倍数稀释成 5 个梯度(1、1/5、1/25、1/125、1/625),作为建立标准曲线的模板,每个点重复3 次,同时以 ddH2O 作为阴性对照模板,来检测实验过程中的试剂或者人为污染。计算每对引物的扩增效率(E=(10-1/slope-1) × 100%)。选择溶解曲线呈现单峰,并且扩增效率在 90%~110%,阴性对照无峰的特异性引物作为最终的引物。
1.6 数据分析
内参基因稳定性分析,利用软件 GeNorm、NormFinder 和 BestKeeper,并用在线分析工具ReFinder(http://150.216.56.64/referencegene.php)综合分析 qRT-PCR 的数据,计算候选内参基因在不同实验条件下的表达稳定性。
NHX1基因(Na+/H+交换基因)被认为是增强植物非生物胁迫耐受性的关键基因,尤其是耐盐性[8],选择CtNHX1基因为验证基因(F:CACT AACAAATCCCCAACTCAT;R:CTCAAGCTCAA AGGAAAAGAAC),并用筛选出的合适的内参基因作为参照,使用不稳定的内参基因作为比较,验证候选内参基因表达的稳定性。
2 实验结果
2.1 RNA 提取、内参基因引物特异性与扩增效率分析
样品 RNA 的浓度使用 Mettler 公司生产的核酸检测仪 UV5NANO 测定,样本浓度均在 432~1 732 ng·mL-1之间,OD260/280值在 1.8~2.0 之间,OD260/230≥2.0,用 1.5%的琼脂糖凝胶电泳检验 RNA 完整性,显示至少存在2 条带,28 S 和18 S 清晰,且 28 S/18 S ≈ 2,说明 RNA 质量达到荧光实时定量分析的要求。
共计筛选出 17 个候选内参基因,对 17 个内参基因进行荧光实时定量,基因的扩增产物长度为112~246 bp,溶解曲线均为单一峰,扩增产物特异性高,符合筛选内参基因的要求。所有候选内参基因的E值(扩增效率)范围为 96.67%~99.68%,标准曲线的相关系数R2为 0.986~0.999,综上所述 17 对引物的扩增效率较高(表1)。
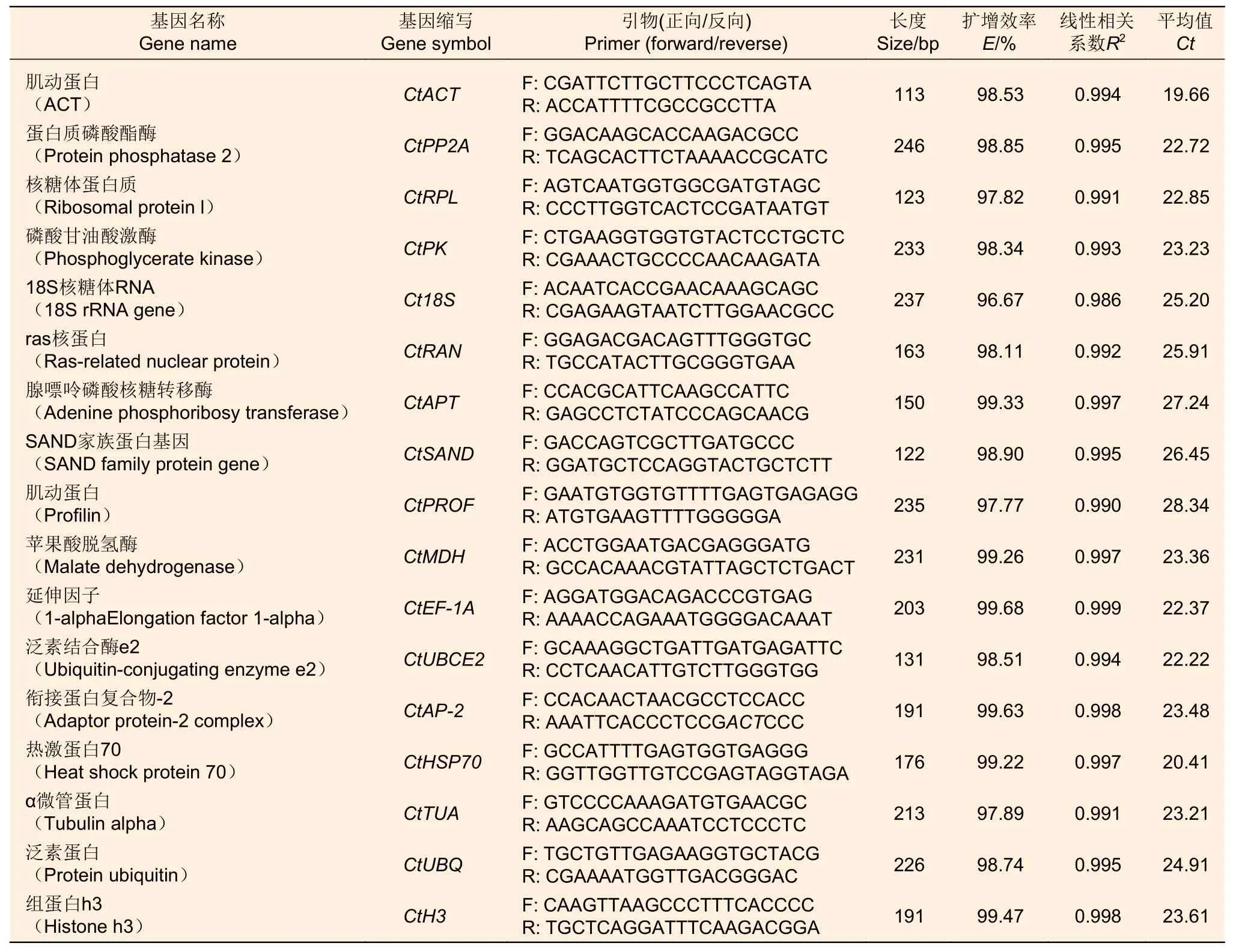
表1 17 个候选内参基因引物及扩增效率Table 1 17 candidate internal reference gene primers and amplification efficiency
2.2 候选内参基因表达分析
基因表达水平由周期阈值(Ct)决定,Ct值与基因表达量呈反比,从图1 中可看出:这些候选基因显示出不同的表达水平,17 个候选参考基因的Ct值分布均在15~35 个循环之间,具体数值见表1。ACT、UBCE2和HSP70的表达量较高,且在不同样本中表达变化范围相对较小,表达较稳定;SAND、PROF的表达量较低;APT、H3 和EF-1A在不同样本中表达变化范围相对较大,表达差异较大(图1)。
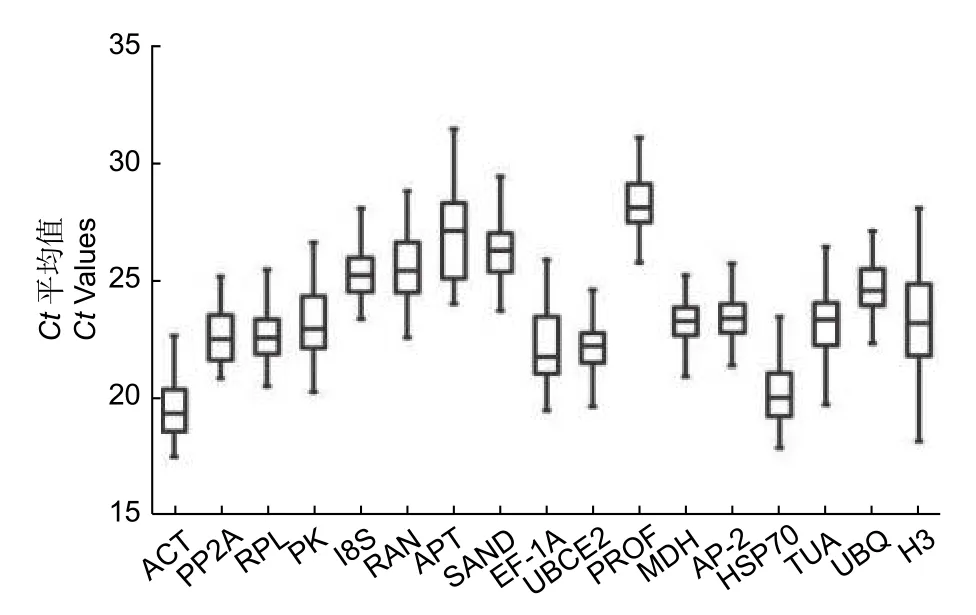
图1 17 个候选内参基因的Ct 值分布Fig.1 Distribution of Ct values of 17 candidate internal reference genes
2.3 胁迫下候选内参基因表达稳定性分析
2.3.1 GeNorm 分析 GeNorm 软件根据平均表达稳定指数(M)确定最稳定基因,M值的大小与基因稳定性呈反比,M值的阈值为1.5,超过1.5 则视为不能选为内参基因。此外,GeNorm 软件通过配对变异值(Vn/n+1)计算最优内参基因的校准数量,若Vn/n+1值小于0.15,则所需参考基因的数量为n,否则需引入的参考基因的数量为n+1[9]。
从表2 可看出:在盐害、干旱和热害胁迫中,M值均小于1.5,说明符合GeNorm 软件筛选内参基因的标准。盐害胁迫中,RPL和AP-2基因最稳定,稳定值为0.132;干旱胁迫中,ACT和AP-2表现最稳定,稳定值为0.401;热害胁迫下EF-1A和UBCE2最稳定,稳定值为0.247。综合所有胁迫数据看,基因RPL和AP-2最稳定,稳定值为0.767,且V2/3均小于0.15,说明选用2 个内参基因便可满足基因标准化的要求(图2)。
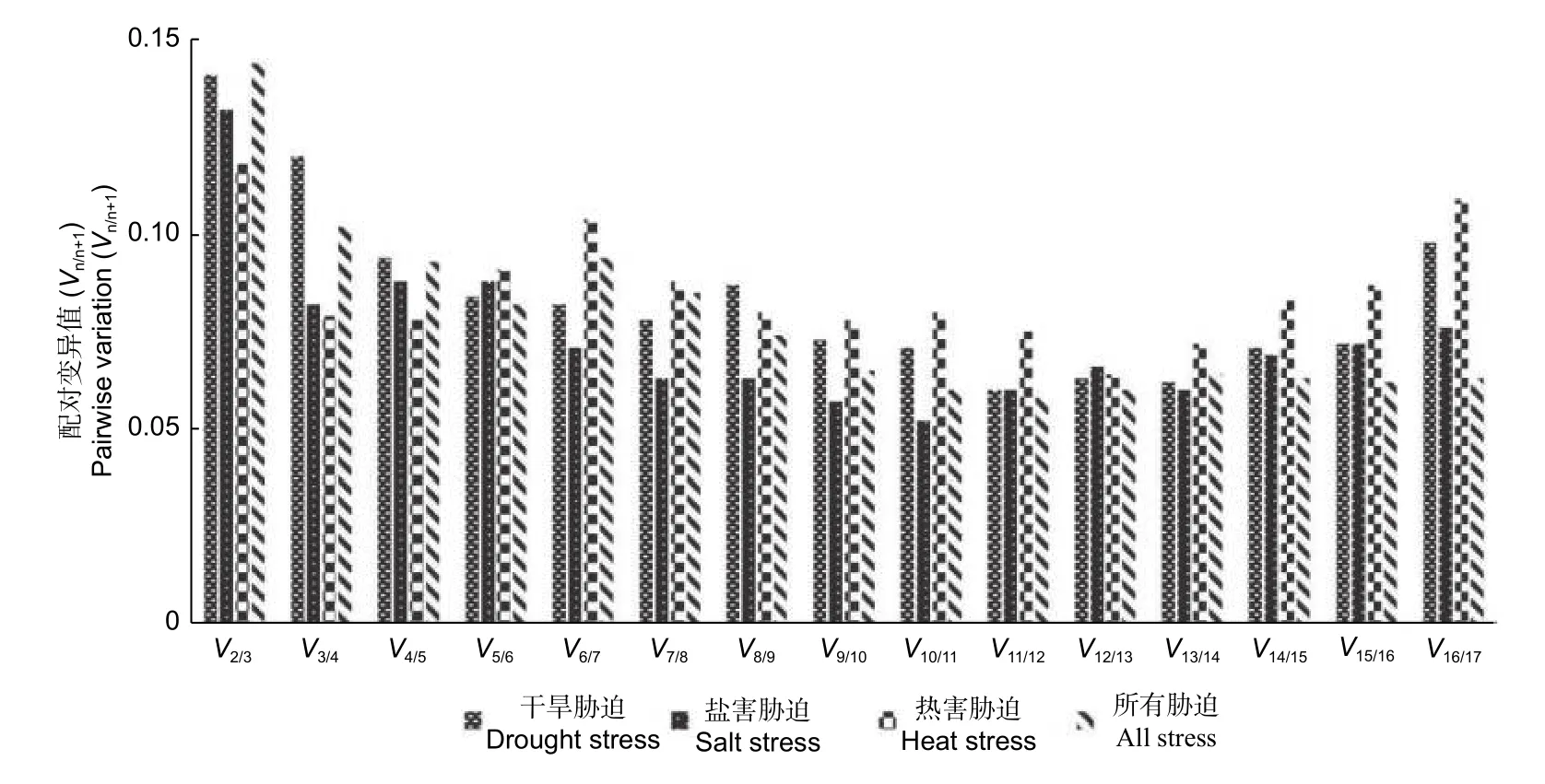
图2 GeNorm 软件分析的配对变异值(Vn/n + 1)Fig.2 Paired variation(Vn/n + 1) analyzed by GeNorm software
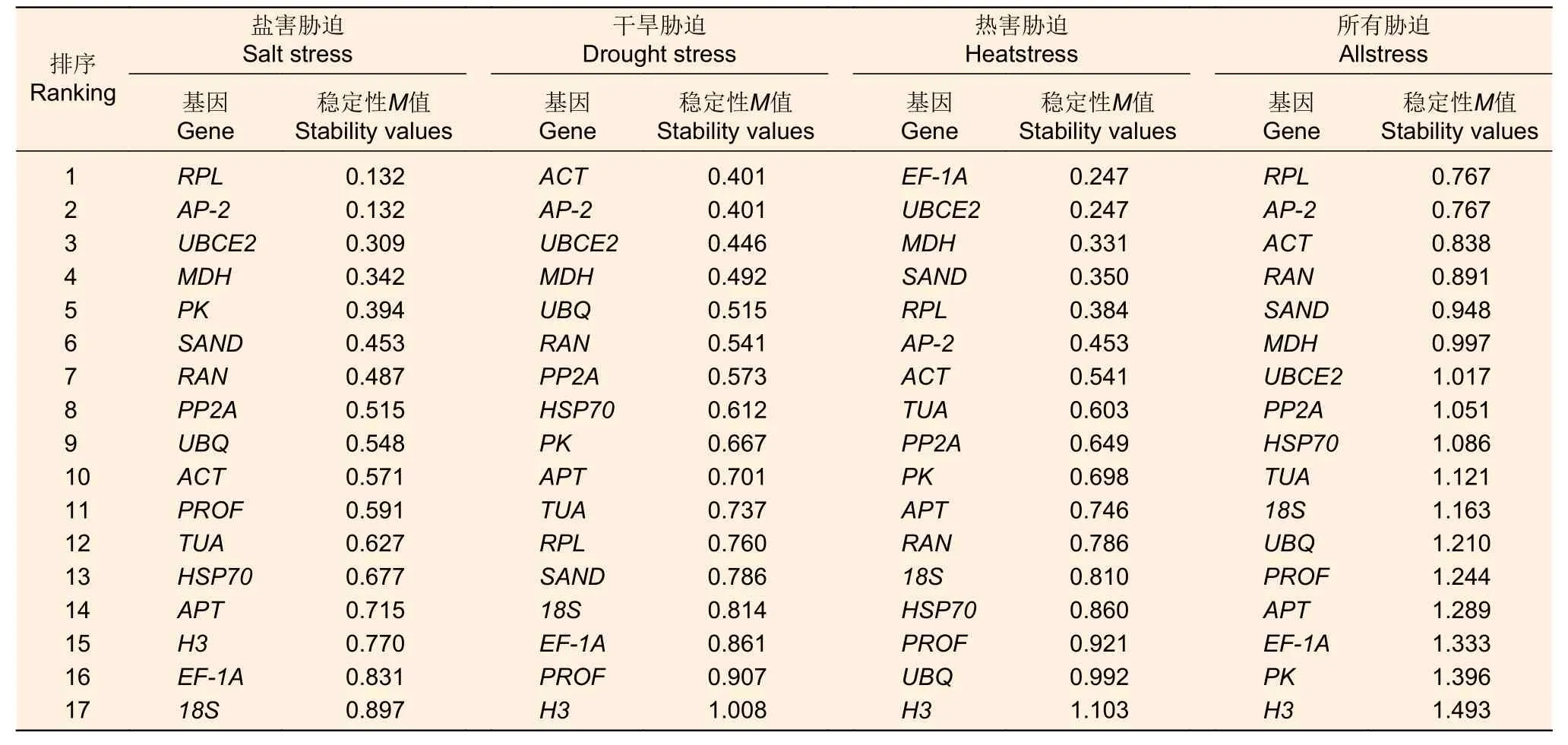
表2 GeNorm 软件分析结果Table 2 GeNorm software analysis results
2.3.2 NormFinder 分析 NormFinder 软件原理和GeNorm 相似[10],通过计算稳定值排序得出基因的稳定性,稳定值较大的基因,稳定性较差。一般来说,NormFinder 软件只计算一个最适的内参基因。在盐害胁迫中,基因RPL最稳定,稳定值为0.238,18S最不稳定,稳定值为1.283;干旱胁迫下,AP-2基因显示最稳定,稳定值为0.246,基因H3稳定性表现较差,稳定值为1.658;热害胁迫下,MDH基因最稳定,稳定值为0.155,H3表现出最不稳定的特性,稳定值为1.841;将所有胁迫实现综合来看,AP-2是最稳定的基因,稳定值为0.317,H3是最不稳定的基因,稳定值为2.252(表3)。总体来看,基因RPL、UBCE2、AP-2、MDH等基因在各个胁迫处理中,稳定性均排第一、第二位,相对稳定,H3基因稳定性总是排在较后的位置,稳定性较差,不适合作为海州常山内参基因使用。
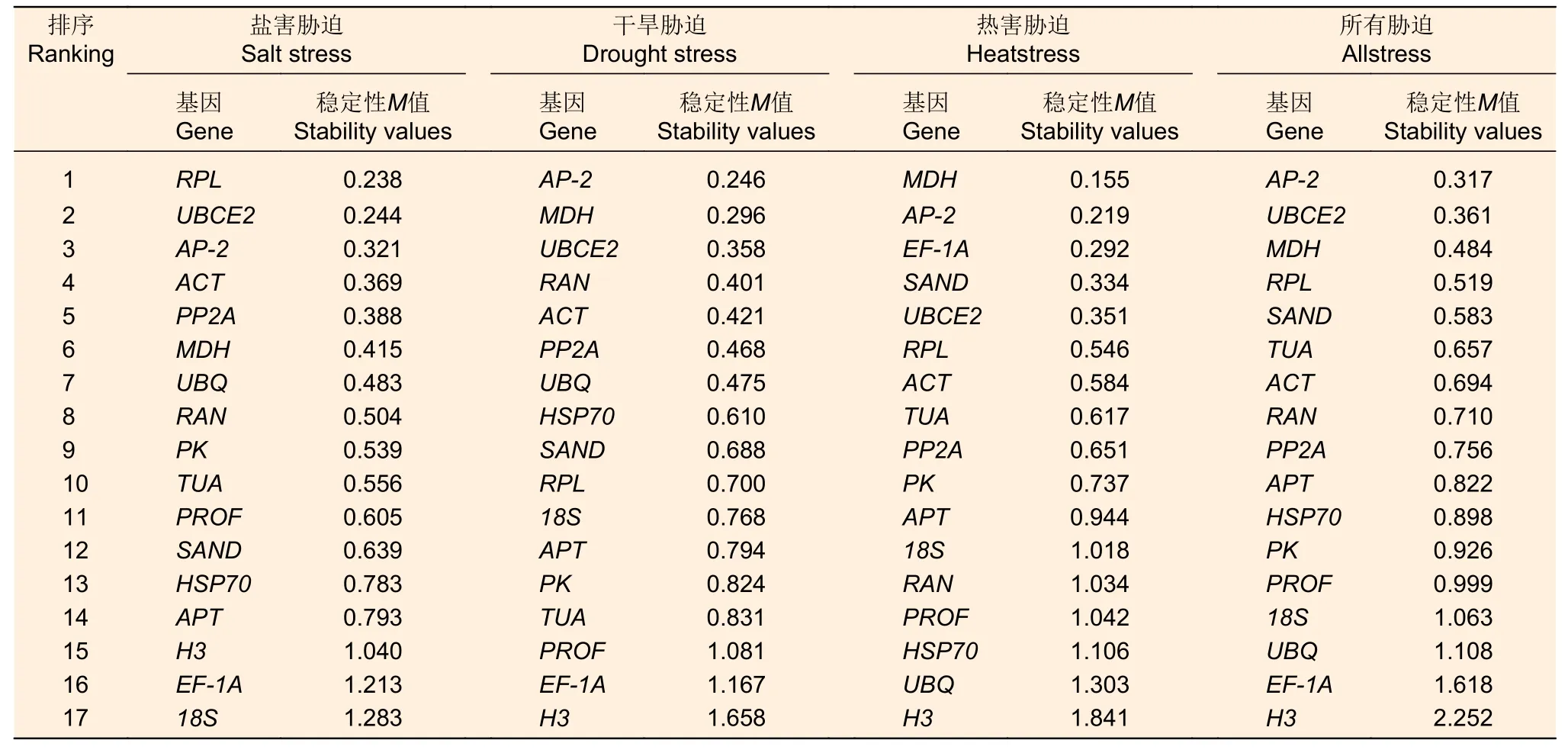
表3 NormFinder 软件分析结果Table 3 NormFinder software analysis results
2.3.3 BestKeeper 分析BestKeeper 软件通过比较Ct值产生的相关系数(r)、变异系数(CV)和标准差(SD)来决定最优的内参基因,SV和SD越小,则稳定性较好[11],当SD> 1 时,则该内参基因表达不稳定。与NormFinder 软件相同,BestKeeper 软件一次只能计算一个最适的内参基因。
在海州常山盐害胁迫处理中,基因ACT(SD=0.26,CV=为1.37)为最稳定的基因,干旱胁迫下最稳定的基因也是ACT(SD=0.36,CV=1.86),在热害胁迫下最稳的基因是AP-2(SD=0.36,CV=1.3);综合分析所有胁迫下数据发现,AP-2基因是最稳定的基因(SD=0.64,CV=2.73)(表4);相比较之下,基因H3在盐害胁迫、干旱胁迫、热害胁迫和所有胁迫数据处理中,SD和CV值都是最大的,最不稳定。
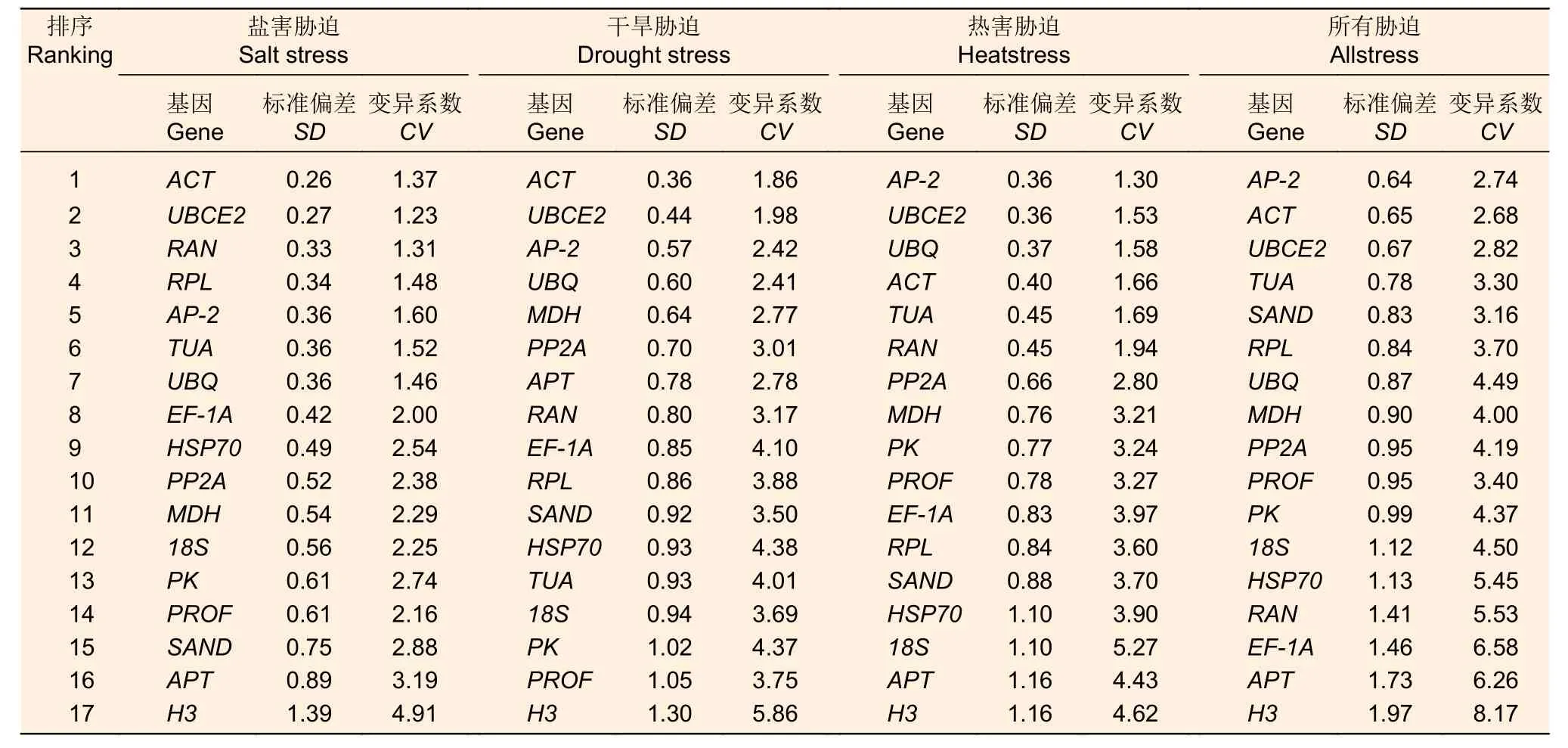
表4 Bestkeeper 软件分析结果Table 4 Bestkeeper software analysis results
2.3.4 ReFinder 分析 3 个软件分析的结果有相似也有不同,所以需要使用ReFinder 软件综合分析,对3 个软件得出的基因稳定性排名值进行几何平均值分析,几何平均值越小则说明候选内参基因的稳定性较高。运用ReFinder 软件综合分析得出(表5),盐害胁迫下,最稳定的基因是RPL和UBCE2,应选用这2 个基因作为内参基因;干旱胁迫下,AP-2和ACT基因是排名第1、2 位的基因,适合作为干旱胁迫下的内参基因;热害胁迫下,MDH和EF-1A是表达最稳定的基因。综合所有胁迫数据看,AP-2和UBCE2基因是排名最靠前的,而H3、EF-1A、PROF和18S基因都是排名较后的,不适合于作为海州常山胁迫的内参基因。
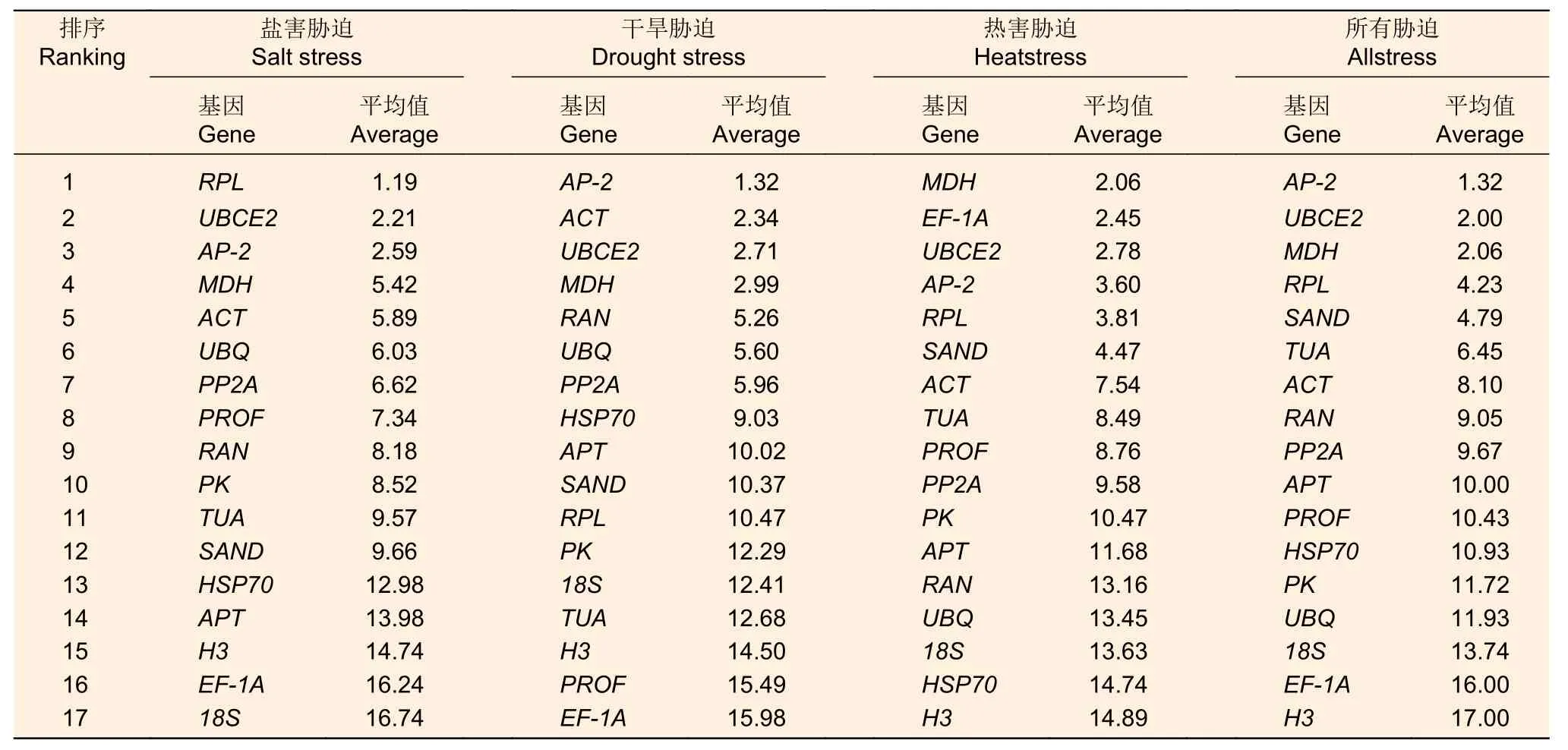
表5 ReFinder 软件综合分析结果Table 5 Results of the comprehensive ReFinder software analysis
2.3.5 筛选内参基因的鉴定 为了验证所筛选的参考基因,采用qRT-PCR 检测了不同非生物胁迫条件下CtNHX1基因表达(图3)。CtNHX1基因的表达使用最稳定的参考基因组合进行标准化,并与最不稳定的参考基因H3进行比较。干旱胁迫,CtNHX1的表达量在0~2 h 和12~24 h 上调,其他时间内基因表达量下降。盐胁迫,CtNHX1在0~48 h 内基因表达量上调,此后下调。热害胁迫,0~2 h,6~12 h,CtNHX1基因表达量上调,其余时间下调。当使用筛选出的稳定参考基因进行标准化时,基因表达水平显示出相似的趋势。然而,使用H3进行归一化会导致完全不同的结果,说明所筛选的内参基因可靠,可作为海州常山非生物胁迫下的内参基因使用。
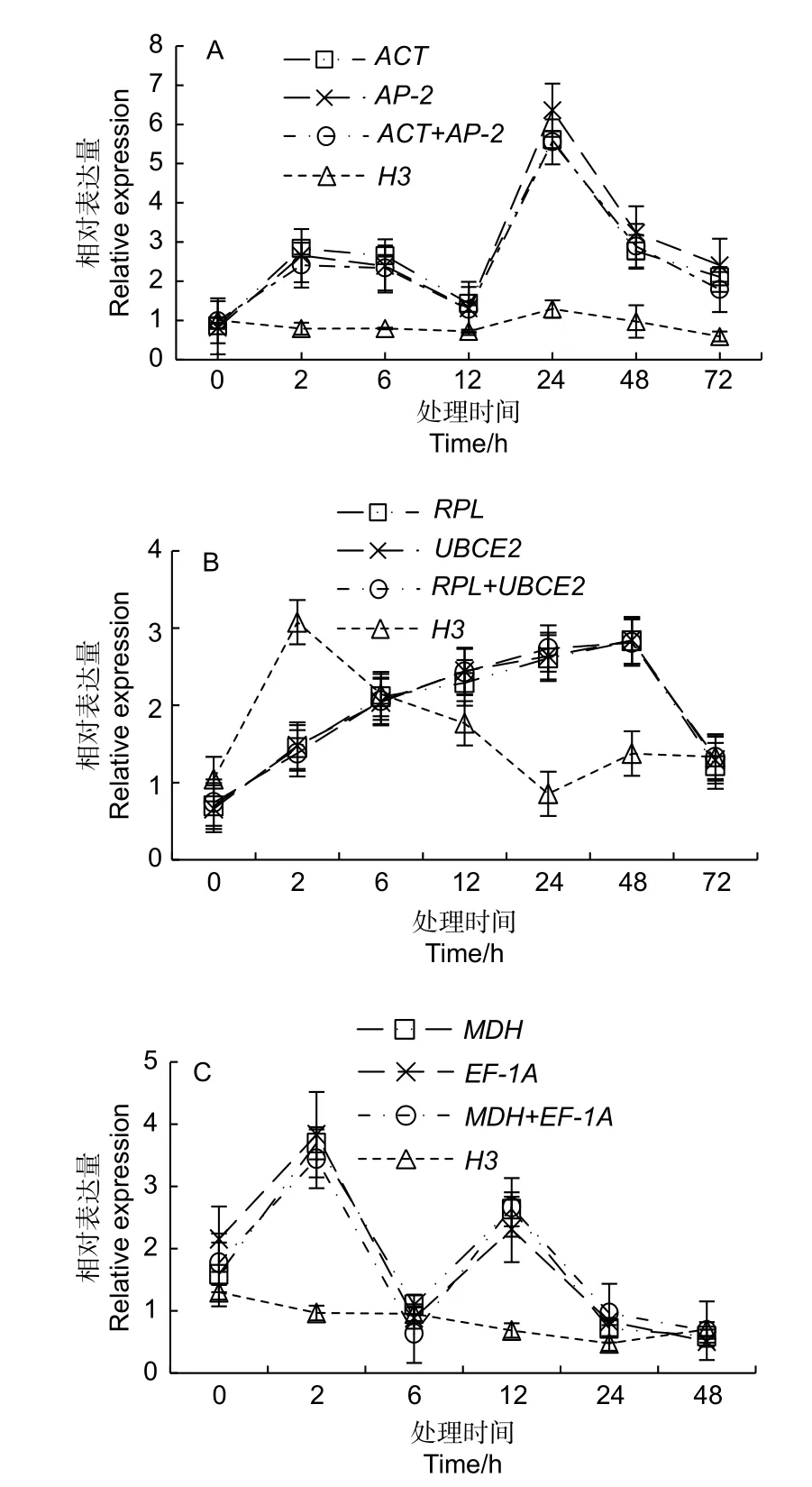
图3 用CtNHX1 验证在不同胁迫下筛选的内参基因稳定性Fig.3 The stability of the internal reference genes selected under different stresses was verified by CtNHX1.
3 讨论
实时荧光定量技术因灵敏度高、特异性强和可重复强,已成为检测核酸含量和分析基因相对表达水平的最重要技术之一;然而,不同物种所适合的内参基因也不同,因此,需要根据物种选择适合的内参基因。海州常山是一种重要的药用植物,具有极好的耐盐性、观赏性和开发前景,土壤盐渍化是一个世界性的问题,选择合适的沿海盐碱植物一直是恢复沿海生态的焦点[12],筛选海州常山内参基因帮助我们在分子水平上更好地理解植物的耐盐性及更好地开发利用植物的耐盐性。
由于不同计算软件的统计算法和分析程序导致基因稳定性排名有所差异,不同的软件给出了不同的结果,这是由于不同软件筛选稳定性考虑的算法侧重点不同造成的。总体来说虽有差异,但基因的稳定排名大致相同,以盐胁迫下的内参基因筛选为例,GeNorm 和NormFinder 软件分析RPL、UBCE2基因表达稳定,BestKeeper 软件却认为ACT基因表达最稳定,UBCE2基因稳定性排第二;ReFinder软件综合分析得出,RPL、UBCE2和AP-2基因是盐胁迫下稳定性排名前三基因。从分析结果看,各个分析软件的结果虽有不同,但仅仅是排名名次上有些差异,差异性不大且稳定性值相差也不大。
ACT和AP-2在干旱胁迫下最稳定表达,ACT在何首乌、红麻等多个物种中被证实稳定表达[13-14],在葡萄非生物胁迫下,基因AP-2也被鉴定为合适的参考基因[15]。热害胁迫下MDH和EF-1A是表达最稳定的基因,在樟树、黄秋葵中EF-1A被证明是最适合热应激的参考基因[16-17]。已经证实UBCE2和RPL基因在很多植物的非生物胁迫下是稳定表达的[18-20],这与海州常山叶片盐害胁迫下的结果相吻合。综合所有胁迫数据看,AP-2和UBCE2基因是排名最靠前的,这和在福建柏中的结果相似[21]。在本研究中,H3是最不稳定的参考基因之一,在海州常山叶片中不适合作为内参基因使用。
为了验证选择的参考基因的可靠性,通过利用筛选出的内参基因对CtNHX1表达水平进行归一化。当使用CtNHX1基因来鉴定所筛选内参基因的表达量时,CtNHX1基因在盐害处理下48 h 时基因表达量最高,这和在短角海蓬子SbNHX1进行高盐胁迫下的基因表达量相似[22];在干旱胁迫处理后2 h 时基因表达量上调而后下降,在24 h 时基因表达量达到最高,而后又显现下降趋势[23],这与海马齿SpNHX1基因表达量具有相似的规律。总体结果显示,使用本研究筛选出的内参基因及内参基因组合进行基因表达水平归一化时,目的基因表达量具有相似的表达规律,在各种非生物胁迫处理中表达是稳定的,而用不稳定的H3基因进行目的基因表达水平检测时,结果显示目的基因表达水平与本研究用筛选出的内参基因检测的目的基因表达水平规律明显不同,说明实验结果可靠。
4 结论
通过内参基因的稳定性和有效性评估与分析,发现AP-2、UBCE2在海州常山叶片非生物胁迫下稳定表达,下一步将继续利用海州常山转录组学,挖掘海州常山胁迫条件下优良的抗逆基因,研究相关基因的表达模式。这项工作为今后海州常山分子机制的研究提供基础,也为其他马鞭草物种分子水平的探究提供了内参基因选择的参考。

