针灸对克罗恩病大鼠低氧环境下结肠DNA甲基转移酶的影响
祁琴 王晓梅 吴焕淦 包春辉 马晓芃 赵琛 朱毅 刘慧荣 施茵 黄艳 刘雅楠





摘要 目的:觀察针灸对克罗恩病(CD)大鼠结肠组织DNA甲基转移酶的影响,初步探讨针灸对CD的表观遗传调控机制。方法:将SD大鼠随机分为空白组、模型组、隔药饼灸组、电针组和柳氮磺吡啶组。采用5% 2,4,6-三硝基苯磺酸灌肠的方法制备CD大鼠模型。隔药饼灸组和电针组均采用天枢(双侧)和气海穴进行干预,柳氮磺吡啶组采用柳氮磺吡啶肠溶片进行灌胃干预。治疗结束后,采用ELISA检测血清中C反应蛋白(CRP)、IL-6、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的含量;实时荧光定量PCR(RT-qPCR)检测结肠组织中缺氧诱导因子-1α(HIF-1α)的mRNA表达;Western Blotting检测结肠组织中DNMT1、DNMT3a、DNMT3b蛋白的表达。结果:与正常组比较,模型组血清中CRP、IL-6、IL-1β、TNF-α的蛋白含量均显著升高(P<0.01);与模型组比较,隔药饼灸组、电针组和柳氮磺吡啶组上述炎症介质的蛋白含量均显著降低(P<0.01)。与正常组比较,模型组结肠组织中HIF-1α mRNA和DNMT1、DNMT3a、DNMT3b蛋白表达均显著升高(P<0.01);与模型组比较,隔药饼灸组和柳氮磺吡啶组HIF-1α mRNA和DNMT1、DNMT3a、DNMT3b蛋白表达均显著降低(P<0.05或P<0.01),电针组HIF-1α mRNA和DNMT1蛋白表达均显著降低(P<0.05或P<0.01)。结论:隔药饼灸和电针均能抑制CD大鼠CRP、IL-6、IL-1β、TNF-α等炎症介质以及HIF-1α、DNA甲基转移酶DNMT1的表达,其中隔药饼灸还能抑制DNMT3a、DNMT3b表达,可能是针灸减轻CD肠道炎症的机制之一。
关键词 克罗恩病;针灸;DNA甲基转移酶;表观调控;缺氧诱导因子
Effects of Acupuncture and Moxibustion on Colonic DNA Methyltransferase Under Hypoxic Environment in Rats with Crohn′s Disease
QI Qin1,WANG Xiaomei1,WU Huangan1,2,BAO Chunhui1,MA Xiaopeng1,2,ZHAO Chen3,ZHU Yi1,LIU Huirong1,2,SHI Yin1,HUANG Yan1,LIU Yanan1
(1 Shanghai Research Institute of Acupuncture and Meridian,Shanghai 200030,China; 2 Yueyang Hospital of Integrated Traditional Chinese and Western Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai 200437,China; 3 School of Acupuncture-Moxibustion and Tuina,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract Objective:To observe the effects of acupuncture and moxibustion on DNA methyltransferase in the colon tissues of rats with Crohn′s disease (CD) and explore the mechanism of acupuncture and moxibustion in the epigenetic regulation of CD.Methods:SD rats were randomly divided into a normal group,a model group,an indirect moxibustion group,an electroacupuncture (EA) group,and a sulfasalazine group.The CD model was induced by enema with 5% 2,4,6-trinitrobenzene sulfonic acid in rats.The rats in the indirect moxibustion group and the EA group were treated correspondingly at bilateral “Tianshu” (ST 25) and “Qihai” (CV 6),and those in the sulfasalazine group received sulfasalazine enteric-coated tablets by gavage.ELISA was used to detect the protein content of CRP,IL-6,IL-1β,and TNF-α in the serum.RT-qPCR was used to detect the expression of HIF-1α mRNA in the colon tissues.Western Blotting was used to detect the protein expression of DNMT1,DNMT3a,and DNMT3b in the colon tissues.Results:Compared with the normal group,the model group showed increased protein content of CRP,IL-6,IL-1β,and TNF-α in the serum (P<0.01).Compared with the model group,the indirect moxibustion group,the EA group,and the sulfasalazine group showed decreased protein content of the above-mentioned inflammatory factors (P<0.01).Compared with the normal group,the model group displayed increased expression of HIF-1α mRNA and DNMT1,DNMT3a,and DNMT3b proteins in the colon tissues (P<0.01).Compared with the model group,the indirect moxibustion group and the sulfasalazine group exhibited decreased expression of HIF-1α mRNA and DNMT1,DNMT3a,and DNMT3b proteins (P<0.05 or P<0.01),and the EA group showed reduced expression of HIF-1α mRNA and DNMT1 protein (P<0.05 or P<0.01).Conclusion:The indirect moxibustion and EA can both inhibit the expression of inflammatory factors such as CRP,IL-6,IL-1β,TNF-α,as well as HIF-1α and DNMT1 in CD rats,and the indirect moxibustion can also inhibit the expression of DNMT3a and DNMT3b,which may be one of the mechanisms of acupuncture and moxibustion in reducing intestinal inflammation in CD.
Keywords Crohn′s disease; Acupuncture and moxibustion; DNA methyltransferase; Epigenetic regulation; Hypoxia-inducible factor
中图分类号:R245文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.03.005
克罗恩病(Crohn′s Disease,CD)属于炎症性肠病(Inflammatory Bowel Disease,IBD)的一种,常表现为消化道管壁全层性炎症,可并发肠狭窄、肠梗阻,多数患者终生反复发作。近年来,国内发病率逐年升高,至今仍缺乏理想的治疗方法,是一种难治性肠腑病症。研究表明,CD主要由遗传易感性、环境因素、肠道菌群紊乱等交互作用,引发机体先天免疫和获得性免疫失调而发病,但其具体发病机制尚未完全阐明[1]。
表观遗传机制在遗传易感性与环境之间的作用,既可引发CD,又可维持肠道黏膜炎症。DNA甲基化是表观遗传调控的重要组成部分,是造成基因沉默的重要因素之一[2]。晚近,发现DNA甲基化在CD炎症中的关键作用[3],CD患者外周血、结肠黏膜等全基因组DNA甲基化图谱不同于健康对照组,患者免疫功能与相关基因的DNA甲基化密切相关[4]。DNA甲基化模式由DNA甲基转移酶(DNA Methyltransferase,DNMT)负责建立和维持,在哺乳动物中参与DNA甲基化的DNMTs主要包括DNMT1、DNMT3a和DNMT3b[5-7]。本研究通过观察针灸对CD大鼠低氧环境下结肠组织3种发挥DNA甲基化催化作用的甲基转移酶表达的影响,初步探讨针灸对CD的表观遗传调控机制,以期为针灸治疗CD的临床应用提供实验资料和科学依据。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级雄性SD(Sprague-Dawley)大鼠,体质量为(140±20)g,由上海斯莱克实验动物有限责任公司提供,饲养于上海中医药大学实验动物中心[实验动物许可证号:SCXK(沪)2020-0009]。所有实验过程严格遵循上海中医药大学实验动物中心伦理委员会的相关规定,动物福利伦理委员会批准通过(伦理审批号:PZSHUTCM210305005)。
1.1.2 药物 2,4,6-三硝基苯磺酸(2,4,6-Trinitrobenzene Sulfonic Acid,TNBS)(Sigma,美国,货号:P2297);戊巴比妥钠(Sigma,美国,货号:P3761);柳氮磺吡啶肠溶片(上海中西三维药业有限公司,国药准字H31020450)。
1.1.3 试剂与仪器 无水乙醇(国药集团化学试剂有限公司,货号:10009228);电针仪(南京济生医疗科技有限公司,货号:HANS-200A);CRP ELISA试剂盒(上海酶联生物科技有限公司,货号:ml038253-C);IL-6 ELISA试剂盒(上海酶联生物科技有限公司,货号:ml102828-C);IL-1β ELISA试剂盒(上海酶联生物科技有限公司,货号:ml037361-C);TNF-α ELISA试剂盒(上海酶联生物科技有限公司,货号:ml002859-C);Trizol(TAKARA,日本,货号:9108-1);反转录试剂盒(TAKARA,日本,货号:RR420A);SYBR Master Mixture(TAKARA,日本,货号:RR037A);DNMT1抗体(Thermo Fisher Scientific,美国,货号:MA5-16169);DNMT3a抗体(CST,美国,货号:2160S);DNMT3b抗体(Abcam,英国,货号:ab227942);酶标仪(Thermo Fisher Scientific,美国,型号:Multiskan MK3);电泳槽(BIO-RAD,美国,型号:Mini-PROTEAN Tetra);电泳仪(BIO-RAD,美国,型号:164-5050);荧光定量PCR仪(Roche,瑞士,型号:LightCycler 96);凝胶成像系统(BIO-RAD,美国,型号:Doc XR+1708195)。
1.2 方法
1.2.1 分组与模型制备 大鼠按照随机数字表法将大鼠分为空白组、模型组、隔药饼灸组、电针组、柳氮磺吡啶组,每组8只。参照Morris法[8],采用2,4,6-三硝基苯磺酸(2,4,6-Trinitrobenzene Sulfonic Acid,TNBS)制备CD大鼠模型,将5%TNBS与50%乙醇按2∶1的比例混合均匀制备灌肠液,根据大鼠体质量给予3 mL/kg灌肠。每周灌肠1次,共4次。
1.2.2 干预方法 空白组和模型组不进行治疗。隔药饼灸组选取天枢(双侧)、气海穴进行干预,将制作好的药饼(以制附子、肉桂等药研末,用黄酒调和之后制成厚约0.3 cm,直径约0.5 cm的药饼)放置于相应穴位,上置重约90 mg的艾炷,每次每穴各灸2壮。电针组选取天枢(双侧)、气海穴进行电针治疗。一次性针灸针刺入穴位后,针柄与电针仪的正负极相连,疏密波,频率2/100 Hz,电流2 mA,留针20 min。柳氮磺吡啶组采用柳氮磺吡啶肠溶片研末制备灌胃溶液,按成人(70 kg体质量,4 g/d)与大鼠(200 g体质量)1∶0.018比例的剂量进行灌胃。上述治疗均1次/d,连续7 d。标本采集与处理所有干预结束之后,腹腔注射戊巴比妥钠(2%,40~50 mg/kg),待大鼠麻醉后,打开腹腔,经腹主动脉取血8~10 mL,静置1 h后离心收集血清,保存于-80 ℃冰箱中用于ELISA的检测。取肛门向上6~8 cm的結肠,保存于-80 ℃冰箱中用于实时荧光定量PCR(RT-qPCR)和Western Blotting的检测。
1.2.3 检测指标与方法
1.2.3.1 ELISA法检测大鼠血清C反应蛋白(CRP)、白细胞介素-6(IL-6)、IL-1β和肿瘤坏死因子-α(TNF-α)的蛋白含量 设置8个浓度梯度的标准孔;在96孔板中加入标准品或准备好的待测样品100 μL,37 ℃恒温孵育30 min;甩去液体,加入洗涤液重复洗板3次;每孔加入50 μL生物素标记的抗体,空白孔除外,37 ℃恒温孵育30 min;甩去液体,加入洗涤液重复洗板3次;每孔加入100 μL酶标抗体,37 ℃恒温孵育10 min;甩去液体,加入洗涤液重复洗板3次;每孔加入100 μL底物混合液,37 ℃恒温避光孵育15 min;每孔加入100 μL终止液,在450 nm波长处测各孔的OD值。
1.2.3.2 RT-qPCR法检测大鼠结肠组织缺氧诱导因子-1α(Hypoxia-inducible Factor-1α,HIF-1α) mRNA的表达量 称取100 mg左右的冷冻结肠组织,加入1 mL Trizol,提取RNA;将下列反应物依次加入到200 μL Eppendorf管中:4 μL 5×PrimeScript RT Master Mix、x μL(2 μg)总RNA、(16-x)μL RNase free dH2O(总反应物体积为20 μL)逆转录cDNA;制备总反应体积为25 μL的反应体系:12.5 μL SYBR Green Mix(2×)、1 μL上游引物、1 μL下游引物、cDNA模板2 μL、8.5 μL dH2O,轻柔混匀后进行RT-qPCR扩增反应,条件如下:95 ℃预变性30 s,(95 ℃ 5 s,60 ℃ 30 s)×40个循环。采用Fold change(2-△△Ct)法进行数据分析。引物设计见表1。
1.2.3.3 Western Blotting检测大鼠结肠组织中DNMT1、DNMT3a、DNMT3b蛋白的表达 称取100 mg左右结肠组织,加入1 000 μL RIPA裂解液、10 μL PMSF蛋白酶抑制剂、20 μL磷酸酶抑制剂后匀浆,离心之后取上清。BCA试剂盒测定大鼠结肠组织的总蛋白浓度。各孔取30 μg蛋白上样,在10%聚丙烯酰胺凝胶电泳进行蛋白分离,上层浓缩胶电压80 V,30 min,下层分离胶120 V;将分离后的蛋白电转移至聚偏二氟乙烯(PVDF)膜中,电压为125 V,转膜时间根据蛋白分子量大小确定;将PVDF膜置于5%脱脂牛奶溶液中室温封闭1 h,TBST溶液洗膜10 min,重复3次,一抗溶液4 ℃摇床孵育过夜;洗膜10 min,重复3次。二抗溶液摇床上室温孵育1 h。洗膜10 min,重复3次。按ECL(Ehanced Chemiluminescence)试剂盒说明进行显影,采用ImageJ图像分析软件进行条带分析,计算灰度值(目的蛋白/内参)。
1.3 统计学方法 采用SPSS 21.0统计软件进行数据分析。对服从正态分布且方差齐的数据,组间比较采用单因素方差分析(One-way ANOVA)中的LSD法;方差不齐性,组间比较采用Games-Howell,结果均采用均数±标准差(±s)表示。对不服从正态分布的数据,组间比较采用非参数检验,采用M(P25,P75)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 针灸对CD大鼠血清CRP、IL-6、IL-1β、TNF-α含量的影响
与空白组比较,模型组CRP、IL-6、IL-1β、TNF-α的含量均显著升高,差异有统计学意义(P<0.01)。隔药饼灸组、电针组和柳氮磺吡啶组CRP、IL-6、IL-1β、TNF-α的含量显著低于模型组,差异均有统计学意义(P<0.01)。见表2,图1。
2.2 针灸对CD大鼠结肠组织HIF-1αmRNA表达的影响
模型组HIF-1α mRNA表达量显著高于空白组,差异有统计学意义(P<0.01)。隔药饼灸组、电针组和柳氮磺吡啶组HIF-1α mRNA表达量均显著低于模型组,差异均有统计学意义(分别P<0.01,P<0.01,P<0.05)。见表3,图2。
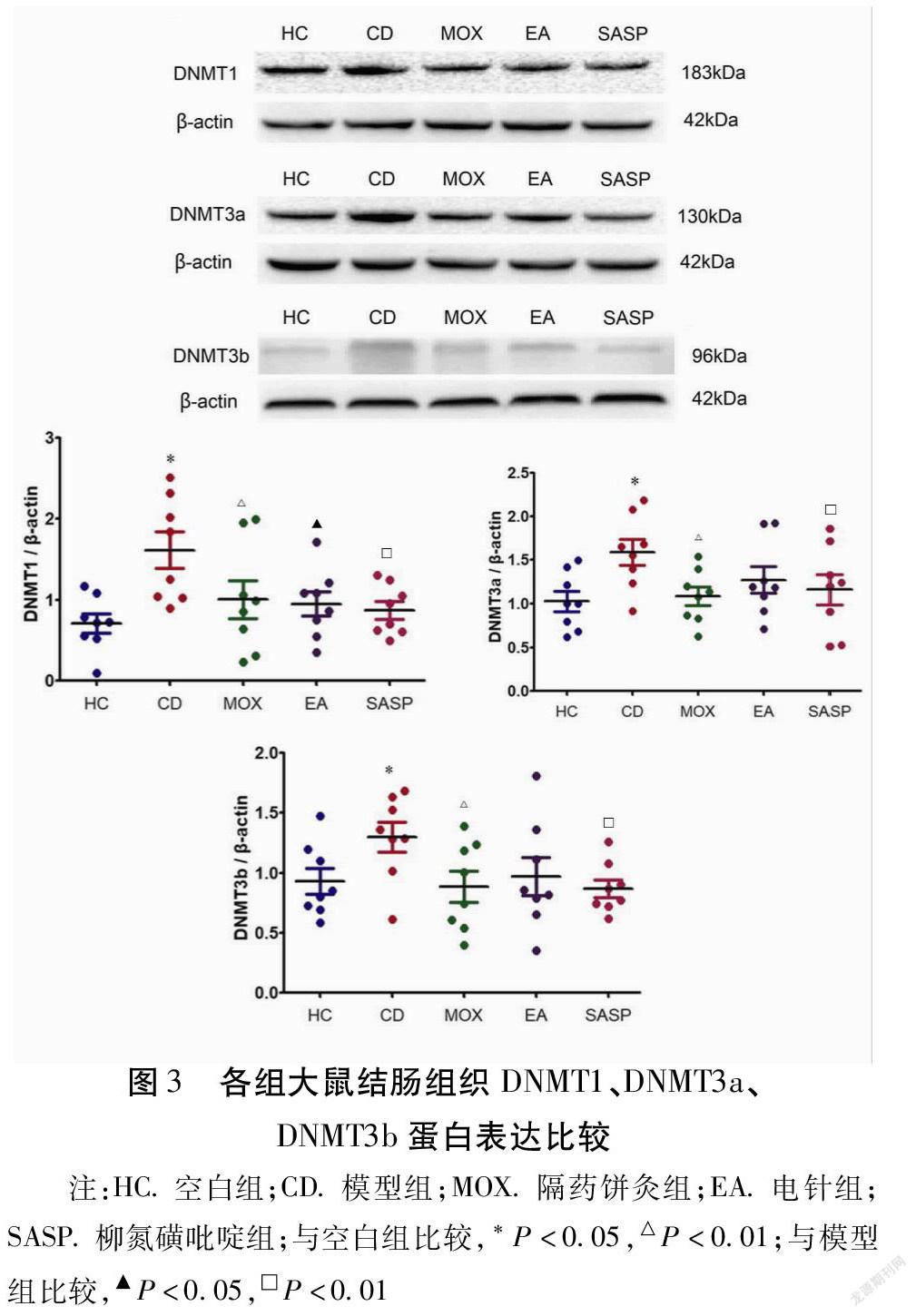
2.3 针灸对CD大鼠结肠组织DNMT1、DNMT3a、DNMT3b蛋白表达的影响
与空白组比较,模型组DNMT1、DNMT3a、DNMT3b蛋白的表达显著升高,差异有统计学意义(分别P<0.01,P<0.01,P<0.05)。与模型组比较,隔药饼灸组DNMT1、DNMT3a、DNMT3b蛋白的表达显著降低,差异有统计学意义(均P<0.05);柳氮磺吡啶组DNMT1、DNMT3a、DNMT3b蛋白的表达也显著降低,差异有统计学意义(分别P<0.01,P<0.05,P<0.05)。电针组仅DNMT1蛋白的表达显著低于模型组(P<0.05)。见表4,图3。
3 讨论
甲基转移酶的参与是DNA甲基化发生过程中的一个关键因素,DNMT1在胚胎和成体细胞中均有表达,负责完成复制后新合成链的甲基化来维持DNA的甲基化水平,但不能起始甲基化。而DNMT3a和DNMT3b主要在胚胎和胚胎干细胞中具有较高的活性,对早期发育建立DNA甲基化模式是必不可少的。目前,普遍认为甲基化的维持需要DNMT3a和DNMT3b的参与[9]。已有大量研究表明,DNMTs在结肠癌、肺癌等多种肿瘤中高表达[10-13],其机制可能与影响癌基因和抑癌基因的表达有关。DNA甲基化能够影响细胞因子等相关基因的表达,导致T细胞极化发生改变,从而导致免疫性疾病的发生。有研究发现DNMT1过表达能引起巨噬细胞中CD68的过表达,从而介导促炎反应;DNMT3a可与T细胞受体结合,通过IL-4和IFN-γ启动子区域的甲基化影响T细胞的极化,同时DNMT3a使TNF-α启动子区域内的CpG岛出现高甲基化,在先天性和适应性免疫应答中发挥重要作用[14]。目前,DNMTs在CD中的作用报道较少,但已有研究发现DNA甲基化在CD炎症中的关键作用[15]。在CD患者中经常观察到叶酸、维生素B12等甲基供体分子的缺乏、DNA甲基化改变和黏附侵袭性大肠杆菌的高患病率[16-18]。有研究报道CD肠黏膜中α-防御素5、TNF-α表达异常,DNA甲基化状态改变,DNA甲基化水平與CD患者外周血CRP的含量呈正相关[19],是发生炎症反应的关键环节。上述研究均提示DNA甲基化在CD炎症中发挥重要作用。
CD炎癥组织由于血管受损和代谢需求增加而长期处于缺氧状态,HIF-1α是一种能够应答低氧环境,调控多种基因转录的核调节因子,是肠道在低氧和炎症环境下重要的中介因子,有大量研究已证实CD炎症组织由于血管受损和代谢需求增加而长期处于缺氧状态[20]。TNF-α能够通过增加活性氧的产生激活和增强HIF-1α的DNA活性,从而上调HIF-1α蛋白的表达,而TNF-α能够诱导IL-1β和IL-6的产生,同时HIF-1α能给显著增加TNF-α的产生和分泌,二者相互促进参与众多疾病的发生发展。有研究发现HIF-1α在CD结肠黏膜中表达显著增加[21]。本研究发现CD大鼠结肠组织中HIF-1α mRNA表达显著高于正常组,与以往研究一致。另外我们还发现模型组血清中CRP、IL-6、IL-1β和TNF-α的蛋白含量显著升高,表明CD大鼠体内存在较强烈的炎症反应。在TNBS诱导的CD大鼠模型中,针灸能降低CD大鼠肠黏膜异常增高TNF-α及其受体,抑制肠上皮细胞凋亡,达到减轻肠道炎症反应的目的[22]。本研究发现隔药饼灸组和电针组血清中CRP、IL-6、IL-1β和TNF-α的蛋白含量显著低于CD模型大鼠,表明隔药饼灸和电针均能够显著抑制CD大鼠体内炎症反应。
课题组前期临床研究发现针灸能够减轻CD大鼠结肠炎症,修复受损的肠黏膜[23],并能纠正轻、中度CD患者结肠黏膜组织形态学改变,能够影响结肠黏膜组织异常的基因表达谱[24],但是针灸对CD大鼠DNA甲基化的调节作用尚不清楚。本研究通过对CD大鼠低氧状态下结肠组织中3种DNA甲基转移酶表达的观察发现,在CD模型大鼠结肠组织中DNMT1、DNMT3a和DNMT3b蛋白的表达量均显著升高,而经过隔药饼灸治疗后DNMT1、DNMT3a和DNMT3b蛋白的表达均显著降低,经过电针治疗后DNMT1蛋白的表达均显著降低,DNMT3a和DNMT3b蛋白含量有一定程度降低,但是差异无统计学意义,这可能与隔药饼灸和电针的作用机制不同有关。总之,本研究表明隔药饼灸和电针均能调节DNA甲基转移酶表达,而DNA甲基转移酶在DNA甲基化中起催化作用,上述结果提示CD模型大鼠中可能存在DNA甲基化异常。CD是一种病因复杂的异质性疾病,其全基因组甲基化图谱可为该病的发病机制提供新思路,DNA甲基化可为CD的诊断、治疗提供研究靶点,故在观察到针灸对DNA甲基转移酶具有调节作用的基础上,未来可以进一步研究针灸对克罗恩病全基因组DNA甲基化图谱等的影响。另外,目前对CD中DNA甲基化调控炎症介质和炎性信号通路的相关机制尚不完全清楚,随着对DNA甲基化调控在CD研究中的不断深入,这不仅有利于从基因调控方面揭示针灸对CD的作用机制,也会为临床诊治提供更加可靠的科学依据和治疗策略。
参考文献
[1]Packey CD,Sartor RB.Interplay of commensal and pathogenic bacteria,genetic mutations,and immunoregulatory defects in the pathogenesis of inflammatory bowel diseases[J].J Intern Med,2008,263(6):597-606.
[2]Tirado-Magallanes R,Rebbani K,Lim R,et al.Whole genome DNA methylation:beyond genes silencing[J].Oncotarget,2017,8(3):5629-5637.
[3]Somineni HK,Venkateswaran S,Kilaru V,et al.Blood-derived DNA methylation signatures of Crohn′s Disease and severity of intestinal inflammation[J].Gastroenterology,2019,156(8):2254-2265.e3.
[4]Harris RA,Nagy-Szakal D,Pedersen N,et al.Genome-wide peripheral blood leukocyte DNA methylation microarrays identified a single association with inflammatory bowel diseases[J].Inflamm Bowel Dis,2012,18(12):2334-2341.
[5]Cui D,Xu X.DNA Methyltransferases,DNA Methylation,and Age-Associated Cognitive Function[J].Int J Mol Sci,2018,19(5):1315.
[6]Chen Z,Zhang Y.Role of Mammalian DNA Methyltransferases in Development[J].Annu Rev Biochem,2020,89:135-158.
[7]Lyko F.The DNA methyltransferase family:a versatile toolkit for epigenetic regulation[J].Nat Rev Genet,2018,19(2):81-92.
[8]Morris GP,Beck PL,Herridge MS,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96(3):795-803.
[9]Jones PA,Liang G.Rethinking how DNA methylation patterns are maintained[J].Nat Rev Genet,2009,10(11):805-811.
[10]Sanaei M,Kavoosi F.Effect of 5-Aza-2′-Deoxycytidine in Comparison to Valproic Acid and Trichostatin A on Histone Deacetylase 1,DNA Methyltransferase 1,and CIP/KIP Family(p21,p27,and p57) Genes Expression,Cell Growth Inhibition,and Apoptosis Induction in Colon Cancer SW480 Cell Line[J].Adv Biomed Res,2019,8:52.
[11]Lai Q,Xu YH,Chen Q,et al.The loss-of-function of DNA methyltransferase 1 by siRNA impairs the growth of non-small cell lung cancer with alleviated side effects via reactivation of RASSF1A and APC in vitro and vivo[J].Oncotarget,2017,8(35):59301-59311.
[12]Takano H,Shibata T,Nakamura M,et al.Effect of DNMT3A polymorphisms on CpG island hypermethylation in gastric mucosa[J].BMC Med Genet,2020,21(1):205.
[13]Abdelfatah E,Kerner Z,Nanda N,et al.Epigenetic therapy in gastrointestinal cancer:the right combination[J].Therap Adv Gastroenterol,2016,9(4):560-579.
[14]Jones B,Chen J.Inhibition of IFN-gamma transcription by site-specific methylation during T helper cell development[J].EMBO J,2006,25(11):2443-2452.
[15]Harris RA,Nagy-Szakal D,Pedersen N,et al.Genome-wide peripheral blood leukocyte DNA methylation microarrays identified a single association with inflammatory bowel diseases[J].Inflamm Bowel Dis,2012,18(12):2334-2341.
[16]Pan Y,Liu Y,Guo H,et al.Associations between Folate and Vitamin B12 Levels and Inflammatory Bowel Disease:A Meta-Analysis[J].Nutrients,2017,9(4):382.
[17]Klaassen M,Imhann F,Collij V,et al.Anti-inflammatory Gut Microbial Pathways Are Decreased During Crohn′s Disease Exacerbations[J].J Crohns Colitis,2019,13(11):1439-1449.
[18]Somineni HK,Venkateswaran S,Kilaru V,et al.Blood-Derived DNA Methylation Signatures of Crohn′s Disease and Severity of Intestinal Inflammation[J].Gastroenterology,2019,156(8):2254-2265.e3.
[19]Cerrillo E,Moret I,Iborra M,et al.Alpha-defensins(α-Defs) in Crohn′s disease:decrease of ileal α-Def 5 via permanent methylation and increase in plasma α-Def 1-3 concentrations offering biomarker utility[J].Clin Exp Immunol,2018,192(1):120-128.
[20]Van Welden S,Selfridge AC,Hindryckx P.Intestinal hypoxia and hypoxia-induced signalling as therapeutic targets for IBD[J].Nat Rev Gastroenterol Hepatol,2017,14(10):596-611.
[21]許春梅,董卫国,余保平,等.低氧诱导因子-1α和炎症诱导酶在炎症性肠病中的表达及意义[J].临床消化病杂志,2005,17(3):103-105.
[22]Bao CH,Wu LY,Wu HG,et al.Moxibustion inhibits apoptosis and tumor necrosis factor-alpha/tumor necrosis factor receptor 1 in the colonic epithelium of Crohn′s disease model rats[J].Dig Dis Sci,2012,57(9):2286-2295.
[23]祁琴,吴璐一,吴焕淦,等.艾灸对克罗恩病大鼠肠道神经元及神经肽蛋白表达的影响(英文)[J].World Journal of Acupuncture-Moxibustion,2017,27(3):40-48,62.
[24]翁志军,汪迪,郑寒丹,等.针灸对克罗恩病患者结肠黏膜基因表达谱的影响[J].上海针灸杂志,2021,40(3):269-278.
(2022-01-06收稿 本文编辑:吴珊)

