慢性炎症在X 射线诱发恒河猴卵巢组织持续损伤中的潜在作用
周莹,杜湧瑞,Mary B.Zelinski,王建梅
(1.天津医科大学第二医院计划生育科,天津 300211;2.美国俄勒冈健康与科学大学生殖科学部,俄勒冈 97006)
放射治疗作为癌症治疗的主要手段之一,其性腺毒性,特别是对年轻女性患者卵巢功能的损伤,严重影响该人群治疗后生殖健康和生活质量[1]。研发体内卵巢保护剂以预防放射治疗后早发性卵巢功能不全(premature ovarian insufficiency,POI)或卵巢早衰(premature ovarian failure,POF)逐渐成为研究热点。目前的实验研究中多为对啮齿动物的研究,且主要关注辐射暴露对卵巢功能的早期影响[2-4],而在非卵巢组织中的研究显示,辐射暴露后会激活机体免疫系统,尤其是激活的巨噬细胞,可释放促炎细胞因子和趋化因子,诱发级联炎症,持续性损伤组织细胞[5-6],而卵巢辐射暴露后炎症是否持续存在以及其对卵巢的影响目前尚不明确。本研究以经X 射线直接照射的非人灵长类动物恒河猴卵巢组织及其血液标本为研究对象,观察其免疫细胞标志物及血清炎性因子表达情况,探讨灵长类动物卵巢X 射线暴露后是否存在慢性炎症以及其对卵巢功能的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 14 只月经周期规律的健康雌性SPF 级恒河猴,年龄8~14 岁,体重6.2~7.5 kg。清洁级饲养,室温22℃,自由食水。恒河猴饲养严格按照NIH《实验动物护理和使用指南》进行,所有实验方案均经过动物保护和使用委员会批准。随机分为3 组:假照射(Sham)组(n=8)、卵巢照射(ovarian x-irradiation,OXI)组(n=3)和X 射线照射+FTY-720(免疫抑制剂)(FTY-720)组(n=3)。
1.1.2 主要试剂和仪器 赋形剂(以下简写为PET):30% PEG-2000(CAS474922-26-4,美国Cayman Chemical 公 司)、60% 无 水 乙 醇(Ethanol)、10%Tween-20(CAS9005-64-5,美国圣克鲁斯生物技术公司)。FTY-720(CAS162359-55-9,美国Cayman Chemical 公司)。4%多聚甲醛固定液-PBS,单核细胞趋化蛋白(MCP)-1 单克隆抗体(MA5-17040),MCP-1(88-7399-86)、白细胞介素(IL)-6(BMS213HS)ELISA 试剂盒均购自美国Invitrogen 公司。CD68 单克隆抗体(sc-20060)购自美国圣克鲁斯生物技术公司。CD-11b 单克隆抗体(ab133357)、辣根酶标记抗鼠IgG(ab6728)、辣根酶标记抗兔IgG(ab6721)、正常山羊血清(ab7481)均购自英国Abcam 公司。VECTASTAIN Elite ABC 试剂盒购自Vector Labs 公司。苏木素染液(KGA223)、DAB 显色液(KGP1045-20)均购自凯基生物科技有限公司。微渗透压泵购自美国Durect 公司。Phillips 324kVp 直线加速器购自德国飞利浦公司。
1.2 方法
1.2.1 微渗透压泵的植入 每只恒河猴的一侧卵巢已被切取用以提供卵巢结构及卵泡动力学基线信息,另一侧卵巢通过手术将一端带有21 g 针头的导管移入腹腔,并将针头插入到卵巢中心,接口处进行缝合并固定于卵巢韧带,导管另一端与恒河猴胸腔皮下植入的微渗透压泵相连,Sham 组和OXI 组泵的储液器内为溶剂PET,FTY-720 组中为PET+0.2 mmol/L FTY-720,均以10 μL/h 的速度持续泵注。
1.2.2 卵巢体外X 射线直接照射 卵巢内泵注1 周后,静脉麻醉恒河猴,仰卧位固定,逐层打开腹腔,取出微渗透压泵、导管后,止血钳钳夹卵巢韧带并保留卵巢血管蒂,将卵巢移出腹腔,置于腹侧外表面并用温热无菌生理盐水纱布覆盖,然后对OXI 组和FYT-720 组卵巢进行13 min 的X 射线照射,总剂量为15 Gy,身体其余部位用铅板覆盖,Sham 组卵巢不照射,仅于体外暴露相同时间,操作结束后将卵巢复位并缝合。
1.2.3 取材 照射结束第3 个月和第9 个月,采集每只恒河猴外周血,血清分离后于-80℃冻存;照射结束后第(316±7)天,于Sham 组恒河猴卵巢早卵泡期(月经周期第2~4 天)取材卵巢组织,并立即置于4%多聚甲醛-PBS 溶液中,4℃固定,常规脱水透明制作蜡块后,进行5 μm 厚度连续切片。
1.2.4 免疫组织化学法检测卵巢组织MCP-1、CD11b 和CD68 的表达 选取切好的卵巢组织切片,65℃烤片2 h 后,常规脱蜡脱水,微波炉修复抗原,灭活内源性过氧化物酶,血清封闭;滴加稀释一抗(MCP-1 抗体:1/5 000;CD68 抗体:1/200;CD11b抗体:1/4 000),阴性对照为PBS 溶液,4℃过夜,按照二抗说明书滴加二抗,PBS 洗净后行DAB 显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。使用Olympus BX40 倒置显微镜和Olympus DP72 成像系统在相同光照条件下进行拍摄并观察染色结果。CD11b、CD68 阳性细胞的胞浆或胞膜呈棕黄色或棕褐色颗粒状。在盲法分析中,由2 位研究者在每个标本的随机5 个视野内评估卵巢切片CD11b、CD68 阳性细胞的数量,最后取均值用于统计。
1.2.5 ELISA 法检测恒河猴血清中MCP-1、IL-6 表达水平 预先将ELISA 试剂盒置于室温30 min,取出冻存于-80℃的血清样本冰上融化后,严格按照ELISA 试剂盒说明书测定恒河猴血清MCP-1 和IL-6 细胞因子的水平。
1.3 统计学处理 采用GraphPad Prism 7.0 软件进行数据分析。本研究数据均为计量资料,采用±s表示,方差齐性检验和正态性检验后,符合方差齐的多组数据比较采用one-way ANOVA,进一步两两比较采用Tukey′s 检验;方差不齐多组比较采用Kruskal-Wallis 检验,若差异显著,进一步两两比较采用Dunn′s 检验;两样本比较采用t 检验,P<0.05差异有统计学意义。
2 结果
2.1 恒河猴卵巢MCP-1 的表达 与Sham 组相比,OXI 组MCP-1 阳性染色明显,而FTY-720 组MCP-1阳性染色明显弱于OXI 组,其与Sham 组染色相似(图1)。

图1 MCP-1 在恒河猴卵巢中的表达(免疫组化,200×)Fig 1 Expression of MCP-1 protein in ovary of rhesus monkeys(immunohistochemistry staining,200×)
2.2 恒河猴卵巢CD11b、CD68 的表达 One-way ANOVA 结果显示,Sham 组、OXI 组和FTY-720 组CD11b 阳性细胞数量[(147.3±73.29)、(469.9±327.5)、(165.1±89.54)cells/mm2]差异显著(F=4.896,P=0.030 1),进一步两两比较结果示,OXI 组高于Sham组和FTY-720 组(均P<0.05),而FTY-720 组与Sham 组差异不具统计学意义(P<0.05)。可能由于恒河猴生物个体间差异较大,OXI 组CD68 阳性细胞计数(1 412.0、423.6、393.5 cells/mm2)不符合正态分布,采用Kruskal-Wallis 检验,结果显示,3 组间CD68 阳性细胞数量差异无统计学意义(H=4.419,P=0.113 0),但OXI 组中的3 只恒河猴的卵巢组织CD68 阳性细胞数量均高于Sham 组平均值[(280.1±142.6)cells/mm2]和 FTY -720 组(259.3、328.7、270.8 cells/mm2),而FTY-720 组CD68 阳性细胞数量接近Sham 组水平(图2)。
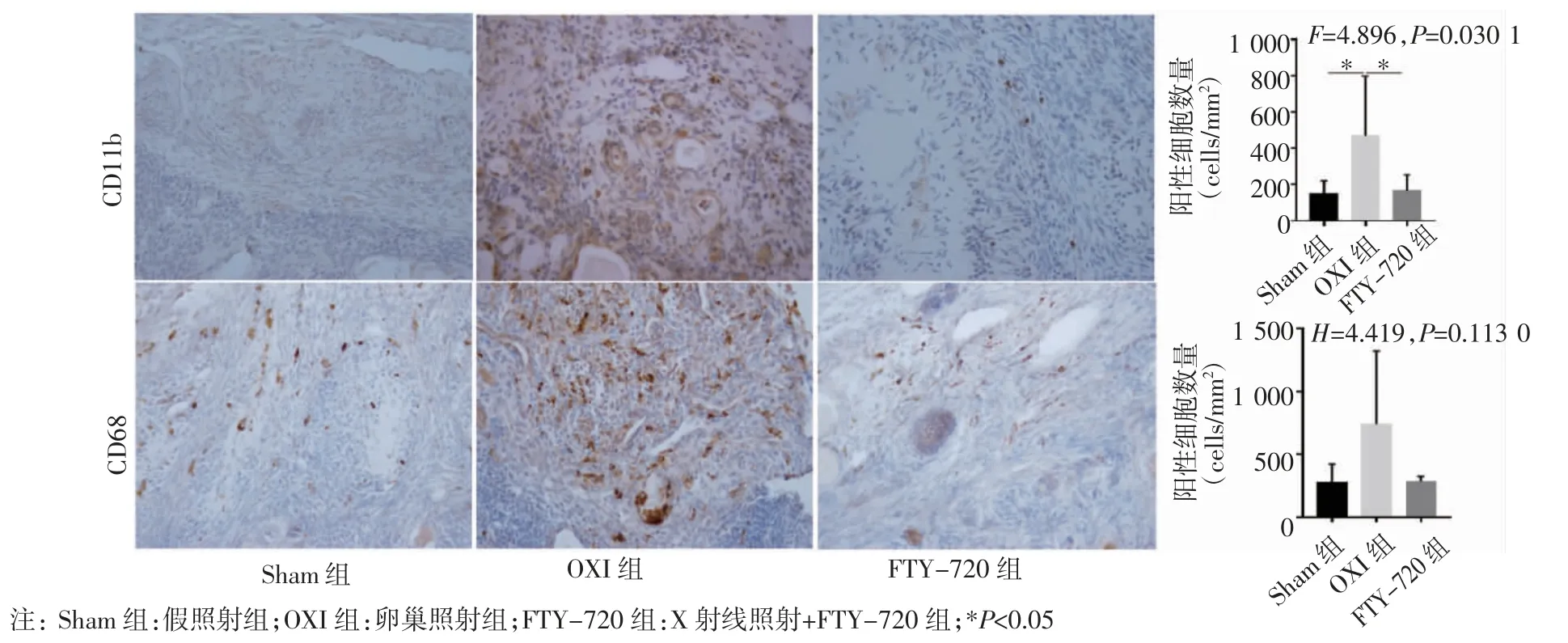
图2 CD11b、CD68 在恒河猴卵巢中的表达及其阳性细胞计数的比较(免疫组化,200×)Fig 2 Expression and positive cells counts of CD11b,CD68 protein in ovary of rhesus macaques(immunohistochemistry staining,200×)
2.3 ELISA 法检测各组血清MCP-1 和IL-6 水平 照射后3 个月,Sham 组、OXI 组及FTY-720 组恒河猴血清MCP-1 浓度分别为(396±122)、(299±47)和(256±21)pg/mL,差异无统计学意义(F=2.640,P=0.150 5);照射后9 个月,3 组间血清MCP-1 浓度差异显著(F=9.328,P=0.014 4)。进一步Tukey′s 检验结果显示,OXI 组血清MCP-1 浓度[(502±105)pg/mL]明显高于Sham 组[(296±43)pg/mL],差异具有统计学意义(P=0.031 4);FTY-720 组血清MCP-1 浓度[(265±56)pg/mL]明显低于OXI 组(P=0.017 2),其与Sham 组血清MCP-1 浓度差异无统计学意义(P<0.05)。仅OXI 组血清MCP-1 浓度照射前后差异有统计学意义(t=3.056,P=0.018 9)。IL-6 仅在OXI组中被检测到,3 个月时为(4±1)pg/mL,9 个月时为(9±6)pg/mL,两个检测点的浓度差异无统计学意义(t=1.424,P<0.05),见图3。
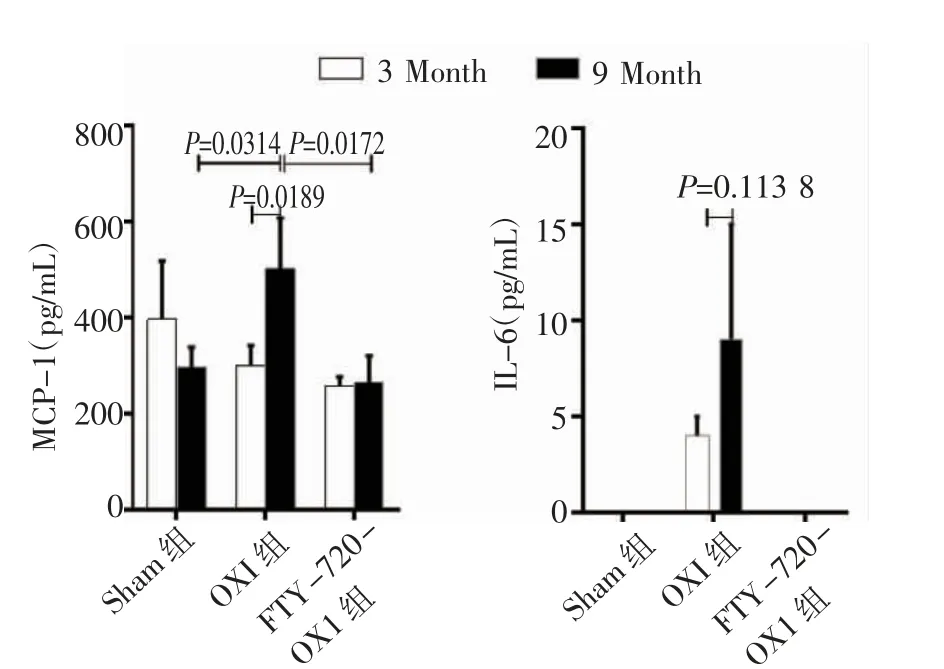
图3 恒河猴血清MCP-1 和IL-6 的水平Fig 3 The serum level of MCP-1 and IL-6 in rhesus monkey
3 讨论
放射治疗是恶性肿瘤的治疗主要手段之一,但是放射治疗会加速卵泡丢失,从而导致卵巢激素分泌减少,卵泡闭锁,最终耗竭卵泡储备池,导致绝经提前及不孕[7]。一项儿童期癌症幸存者治疗后健康风险评估研究表明,盆腹腔放射治疗是女性卵巢功能衰竭和过早绝经的重要危险因素之一[8]。同样,接受放射治疗的青少年和年轻成人癌症幸存者发生POF 的风险也明显增加[9],这一性腺毒性作用成为癌症治疗的常见晚期效应,对幸存者的生活质量有着严重影响。
放射性损伤研究发现,放射线暴露可激活机体免疫系统,活化的巨噬细胞等免疫细胞释放大量促炎细胞因子和趋化因子,且该现象会持续存在。Christersdotti 等[5]研究发现,在放射治疗结束156 周后,受照射的人动脉组织中趋化因子2(CCL2/MCP-1)和CCL5 的表达量和巨噬细胞(CD68+)数量均明显高于未受照射的动脉组织,研究人员利用啮齿动物模型也重现了这一病理现象。最新研究还发现,单次辐射暴露2 个月后,雄性哥廷根小型猪循环系统功能受损,肝脏、肾脏组织出现纤维化等慢性炎性损伤改变[6],以上研究均提示放射治疗诱发的慢性炎症可对机体产生持续性损伤。而目前大多数研究主要集中于放射治疗对卵巢的早期影响,在啮齿动物模型研究中发现放射治疗可导致卵巢急性炎性损伤,且在放射治疗前给与白藜芦醇、N-乙酰半胱氨酸、香芹酚或百里香酚等抗炎抗氧化物质干预后,可抑制放射治疗诱发的急性炎症并减轻卵巢损伤[2-4],但是可能由于啮齿动物卵巢和人类卵巢对放射线敏感性不同,在临床治疗过程中,接受放射治疗的年轻女性卵巢功能衰竭并非立即发生,而是一个逐渐加速的过程[10]。综上所述,笔者认为,放射治疗诱发的卵巢炎性反应可持续作用于卵巢组织,是卵巢辐射暴露后卵泡持续丢失的主要原因之一。
本研究结果显示,恒河猴卵巢组织在接受直接照射9 个月后,OXI 组卵巢组织MCP-1 表达强于Sham 组和炎性抑制组(FTY-720 组),提示卵巢组织处于炎性状态,可能已启动单核细胞的聚集和浸润。同时笔者对卵巢组织进行了CD11b、CD68 阳性巨噬细胞计数,OXI 组卵巢组织CD11b、CD68 阳性巨噬细胞数量均高于Sham 组和FTY-720 组,可能由于灵长类动物的个体差异以及样本量有限的原因,组间差异不具有统计学意义。此外,本研究还对恒河猴机体炎性状态进行了评估,发现X 射线照射9 个月后,OXI 组恒河猴血清趋化因子MCP-1 及促炎细胞因子IL-6 显著高于Sham 组,且照射结束后,血清MCP-1 及IL-6 水平呈现逐渐升高趋势,均提示放射线激活免疫系统后可导致机体处于长期慢性炎症状态,而FTY-720 组恒河猴血清MCP-1 及IL-6 水平均与Sham 组相似,证实了放射治疗结束后卵泡持续丢失可能与炎症反应有关。
本研究选择的炎性指标MCP-1,是单核细胞趋化的关键因子,可将循环中的单核细胞趋化募集到组织分化为单核细胞来源的巨噬细胞,并将巨噬细胞活化为可产生促炎细胞因子和趋化因子的M1 型巨噬细胞,进一步促进炎性介质的分泌和释放,最终影响卵巢细胞增殖、激素分泌和排卵,导致卵巢功能下降或丧失,目前已有多篇文献报道了其与卵巢功能障碍的相关性[11]。CD68 是成熟巨噬细胞表面标志物,主要表达于卵巢血管结缔组织,少量表达于黄体颗粒细胞膜层区域。CD11b 是M1 型巨噬细胞的一种标志物,在炎症中表达增加,发挥促炎作用[12],主要在卵巢排卵后的卵泡膜层、间质及黄体中表达[13]。本研究选择在恒河猴卵巢早卵泡期取材,避免了卵巢生理性原因引起的巨噬细胞数量及表型的改变。IL-6 是细胞因子网络中的重要成员,在炎症中处于中心地位,可由单核细胞、中性粒细胞、巨噬细胞等多种细胞产生[14],具有多种生物学效应,在免疫应答和炎症中发挥重要作用,其分泌增加可导致卵巢性腺激素分泌紊乱、黄体功能障碍、影响胚胎着床及其发育,已成为POF 相关研究观察指标之一[15-16]。
综上所述,X 射线照射卵巢后所引起的持续性炎症,可能是卵巢功能损伤的又一原因。而X 射线照射前卵巢内注入FTY-720 可保护卵巢功能,其机制可能与抑制卵巢单核细胞募集,减少M1 型巨噬细胞及促炎因子IL-6,趋化因子MCP-1 分泌有关。本研究使用的动物模型为灵长类动物恒河猴,其卵巢结构、卵泡募集、发育机制与人类最为接近,有利于研究成果的临床转化。FTY-720 有望成为一种安全、高效的体内卵巢保护剂,可以改善女性肿瘤患者放射治疗后的生活质量。但是由于经费和时间的原因,本研究未能在信号通路上深入探讨FTY-720卵巢保护的具体机制,以及其对卵母细胞质量的影响,需要后期做进一步的深入研究。
致谢:感谢美国OHSU 大学(Oregon Health&Science University)Mary B.Zelinski 教授对本研究的指导和无私帮助。

