基于网络药理学和生物信息学的姜黄素抑制肾透明细胞癌增殖的机制研究
段万里,翟宇瑶,潘思源,杨海燕,程永毅,孙 羿,邓 骞
(1.西安交通大学第三附属医院,陕西省人民医院泌尿外科,陕西西安 710068;2.陕西省感染与免疫重点实验室,陕西西安 710068;3.西安市第四医院药剂科,陕西西安 710004)
肾细胞癌(renal cell carcinoma,RCC)发病率占成人恶性肿瘤的2%~3%,在泌尿系统疾病中仅次于前列腺癌和膀胱癌,但却是致死率最高的泌尿系恶性肿瘤[1]。约70%的RCC为肾透明细胞癌(renal clear cell carcinoma,RCCC)。在大多数国家和地区肾癌的发病率呈持续增长态势[2]。转移性肾癌(metastatic RCC,mRCC)的临床预后极差,其中位生存期为13个月,约50%患者生存期<1年,5年生存率为10%[3]。因此,晚期mRCC的治疗已成为临床最大的挑战。
姜黄素是从姜黄、郁金等姜科姜黄属中药根茎中提取的一种毒性低、药源广泛、价格低廉的黄色酚类色素,在临床治疗中具有广泛应用前景和价值。姜黄素对多种肿瘤有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤转移、抑制血管生成等作用[4-6]。尽管国内外学者在肾癌领域对姜黄素的作用开展了一些研究,但中药治疗疾病是多靶点多通路的作用机制,需要应用大数据挖掘现有的姜黄素和肾透明细胞癌有关的靶点通路。
本研究旨在利用网络药理学结合生物信息学探索姜黄素抑制肾透明细胞癌生物学行为的潜在分子机制,为姜黄素的临床应用及肾癌疾病基础与临床研究提供一定的理论依据。
1 资料与方法
1.1 细胞株及试剂
2种人肾癌细胞株(786-O细胞、ACHN细胞)购自中国科学院细胞库(上海)。姜黄素购自Sigma-Aldrich(美国密苏里州圣路易斯),并溶于二甲基亚砜(dimethyl sulphoxide,DMSO)中以制备其储备溶液。活性氧抑制剂N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)购自Sigma-Aldrich。活性氧荧光探针(2′,7′-dichlorodihydrofluoresceindiacetate,DCFH-DA)购自Invitrogen(美国加利福尼亚州卡尔斯巴德)。
1.2 一般资料
从癌症基因图谱(the Cancer Genome Atlas,TCGA)数据库中选取肾细胞癌患者的mRNA数据,同时下载与患者相关的临床数据。本文所有下载数据均截止于2021年4月15日。
1.3 数据库及软件
PharmMapp数据库(http://www.lilab-ecust.cn/pharmmapper/)、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、疾病靶点数据库网站(Gene-Card)、疾 病 靶 点 标 准 化 数 据 库(Uniprot,https://www.uniprot.org/)、蛋白-蛋白相互作用网络平台String V 11.0(https://string-db.org/)、生物信息注释数据库(David,https://david.ncifcrf.gov/)、TCGA数据库(https://portal.gdc.cancer.gov/)及R软件。
1.4 筛选姜黄素潜在影响RCCC患者总体生存期的差异基因
通过PubChem数据库获得姜黄素的3D化学结构图并保存为“SDF”格式。将姜黄素的SDF格式文件上传至PharmMapper服务器,利用反向对接服务器PharmMapper将姜黄素进行模拟分子-靶蛋白对接,靶点范围设置“Human Protein Targets Only(v2010,2241)”,其余参数保持默认设置。结果按照Normalized Fit Score>0.5进行筛选。利用疾病靶点标准化数据库Uniprot,获取上述靶点的标准基因名。GeneCards数据库以疾病名称“renal clear cell carcinoma”检索肾透明细胞癌的靶标。R软件应用“VennDiagram”包绘制肾透明细胞癌靶点和姜黄素靶点交集的Venn图,提取姜黄素和肾透明细胞癌共有靶基因在TCGA数据库中表达数据,R语言软件应用edgeR和DEGseq包分析和筛选出在肾细胞癌组织样本和正常组织样本中的差异表达基因(differentially expression genes,DEGs),并绘制火山图。R软件采用Survival包通过单因素Cox回归分析对在肾癌组织中差异表达的DEGs进行筛选,筛选出影响患者总体生存期的DEGs。将筛选得到的影响患者总体生存期的DEGs上传至STRING平台,选择“multiple proteins”模式,蛋白种属设为“Home sapiens”,建立药物靶蛋白-疾病靶蛋白相互作用网络(protein-protein interaction,PPI),得到PPI相互作用关系网络,分析蛋白质相互作用关系。
1.5 GO功能富集分析及KEGG通路富集分析
R软件应用“colorspace”“stringi”“DOSE”“clusterProfiler”“pathview”进行GO富集分析和KEGG富集分析。
1.6 细胞活力测定
CCK-8(Dojindo Laboratories,Japan)测定用于评估姜黄素对786-O、ACHN细胞增殖和活力的影响。将细胞以每孔1×104个的密度接种到96孔板上,并用姜黄素或NAC处理。处理后,使用酶标仪(Bio-Rad,USA)测定450 nm处的吸光度值。
1.7 细胞内活性氧水平测定
通过活性氧检测试剂盒(DCFH-DA)测量细胞内活性氧物种的水平。将10 mmol/L DCFH-DA溶解在甲醇中,然后用Hank的平衡盐溶液稀释以生产10μmol/L的DCFH-DA。处理24 h后,将细胞与DCFH-DA孵育30 min。立即用FACS CantoⅡ(BD Biosciences,San Jose,CA,USA)通过流式细胞仪在485 nm激发波长和528 nm发射波长处测量荧光,然后用Flow Jo 8.7软件(Tree Star,Ashland,OR,USA)进行分析。
1.8 MDA(丙二醛)测定
测定MDA作为脂质过氧化指数。将细胞接种到60 mm2的培养皿中(3×106个细胞/孔)24 h,然后用姜黄素(0、40或80μmol/L)处理24 h,刮下细胞并离心30 min。然后根据制造商的说明,使用市售试剂盒(南京建成生物工程研究所)对MDA进行定量。然后,将250μL样品转移至96孔板,并通过Multiskan™FC微孔板分配器(Thermo Fisher Scientific,Waltham,MA USA)以480/530 nm的激发/发射读取荧光强度。
1.9 统计学处理
采用Wilcox检验分析和筛选差异基因,差异倍数(fold change,FC)用log2处理,筛选标准为:∣logFC∣>1,P<0.05。单因素Cox回归模型筛选影响预后基因的条件为P<0.05。PPI筛选条件为最低相互作用阈值取最高等“highest confidence(≥0.4)”,其余参数默认。GO功能富集分析及KEGG通路富集分析筛选条件为P<0.05,q<0.05。体外实验结果应用SPSS 22.0软件分析,连续变量首先检验其正态性,如服从正态分布,则选择独立样本t检验,结果以±s表示。如不服从正态分布,则选择两个独立样本的非参数检验,结果以中位数(百分位P25~P75)[Q2(Q1~Q3)]表示。多组计量资料分析采用方差分析,所有实验均独立重复3次,结果取平均值,以P<0.05为差异有统计学意义。
2 结 果
2.1 转录组表达数据和临床数据
从TCGA数据库下载了539个肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)肿瘤样品和72个邻近正常组织的转录组数据。同时从TCGA数据库中获得了537 KIRC病例的临床数据。
2.2 姜黄素和肾细胞癌共同靶点的筛选
根据PharmMapper服务器中姜黄素与人类蛋白药效团模型匹配的Normal Fit Score>0.5筛选后并经Uniprot转化后共获得姜黄素靶点114个,Gene-Cards数据库得到肾细胞癌的靶标共8 710个。R软件应用“VennDiagram”包绘制miR-613靶点和肾细胞癌靶点交集的Venn图,得到109个共有靶点。
2.3 筛选影响患者总体生存期的差异基因
提取姜黄素和肾透明细胞癌上述109个共有靶点在TCGA数据库中的基因表达数据,以∣logFC∣>0.5且P<0.05为条件筛选出58个在肾细胞癌组织样本和正常组织样本中的表达差异有统计学意义的共靶点基因(P<0.05),其中30个下调,28个上调(图1)。
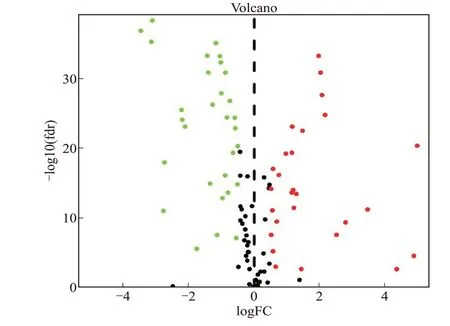
图1 肾透明细胞癌、姜黄素共有靶点基因在TCGA中表达差异Fig.1 Differential expressions of common target genes of RCCC and curcumin in TCGA
2.4 单因素COX筛选可能影响预后的差异基因
将上述58个差异基因经过R软件survival包单因素Cox回归模型筛选后(P<0.05),共有37个差异基因可能影响患者的总体生存期(图2)。
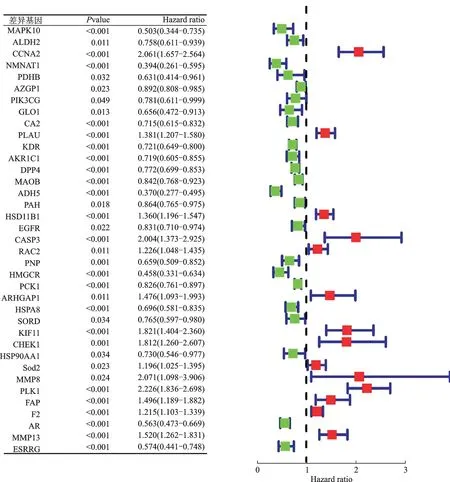
图2 单因素Cox分析与肾透明细胞癌预后相关的差异表达基因Fig.2 Univariate Cox analysis of DEGs related to the prognosis of RCCC
2.5 姜黄素靶点与肾细胞癌靶点标准化及网络构建
将上述影响预后的37个差异共有的靶蛋白基因名上传至STRING平台,根据最高级筛选条件“highest confidence(≥0.4)”,得到联系紧密的PPI网络图(图3)。R软件脚本计算基因链接结点,发现CASP3、EGFR、CHEK1、HSP90AA 1、AR等为主要核心蛋白(图4)。
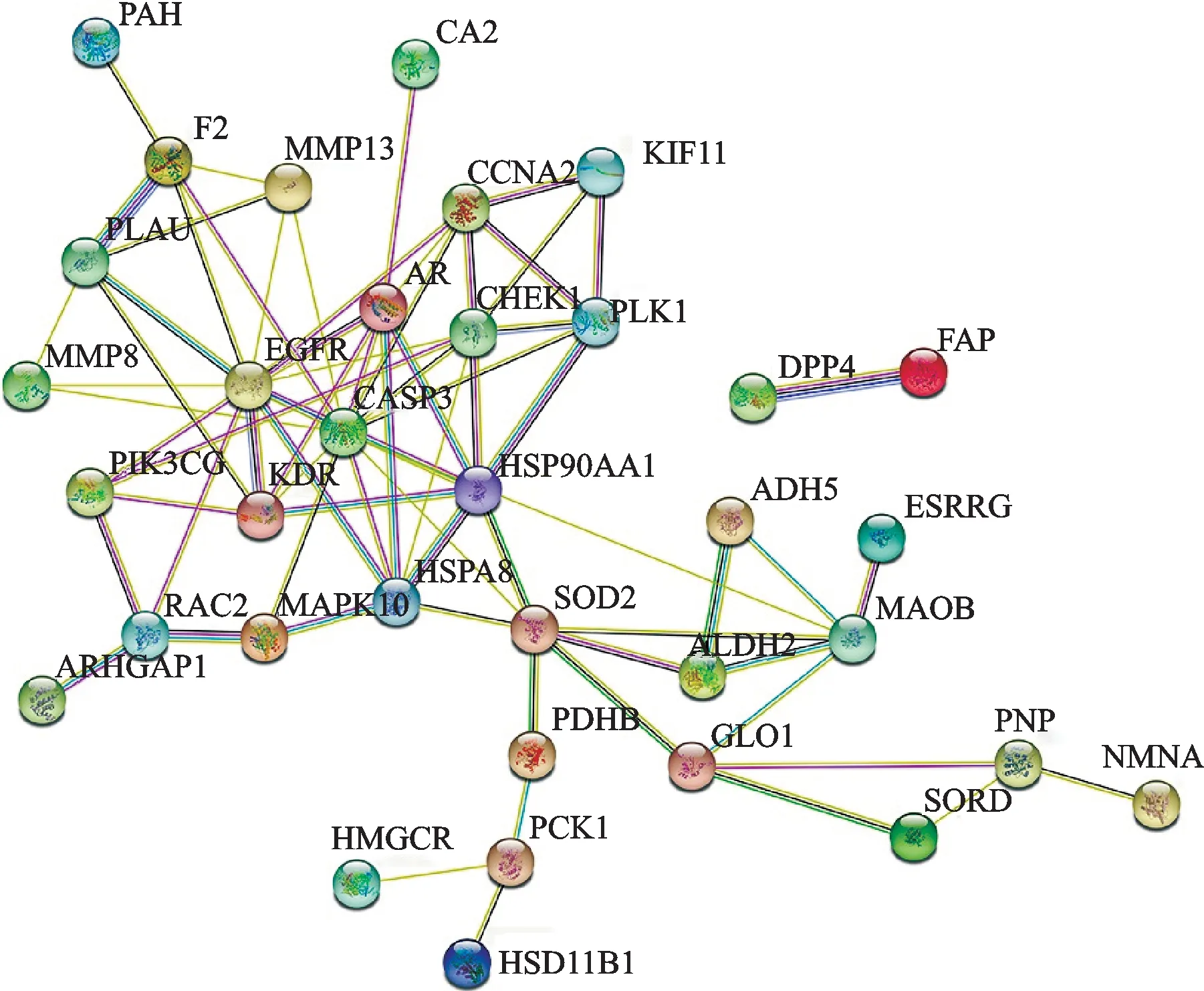
图3 STRING平台共有靶点PPI网络Fig.3 The common targets’PPI network on STRING platform
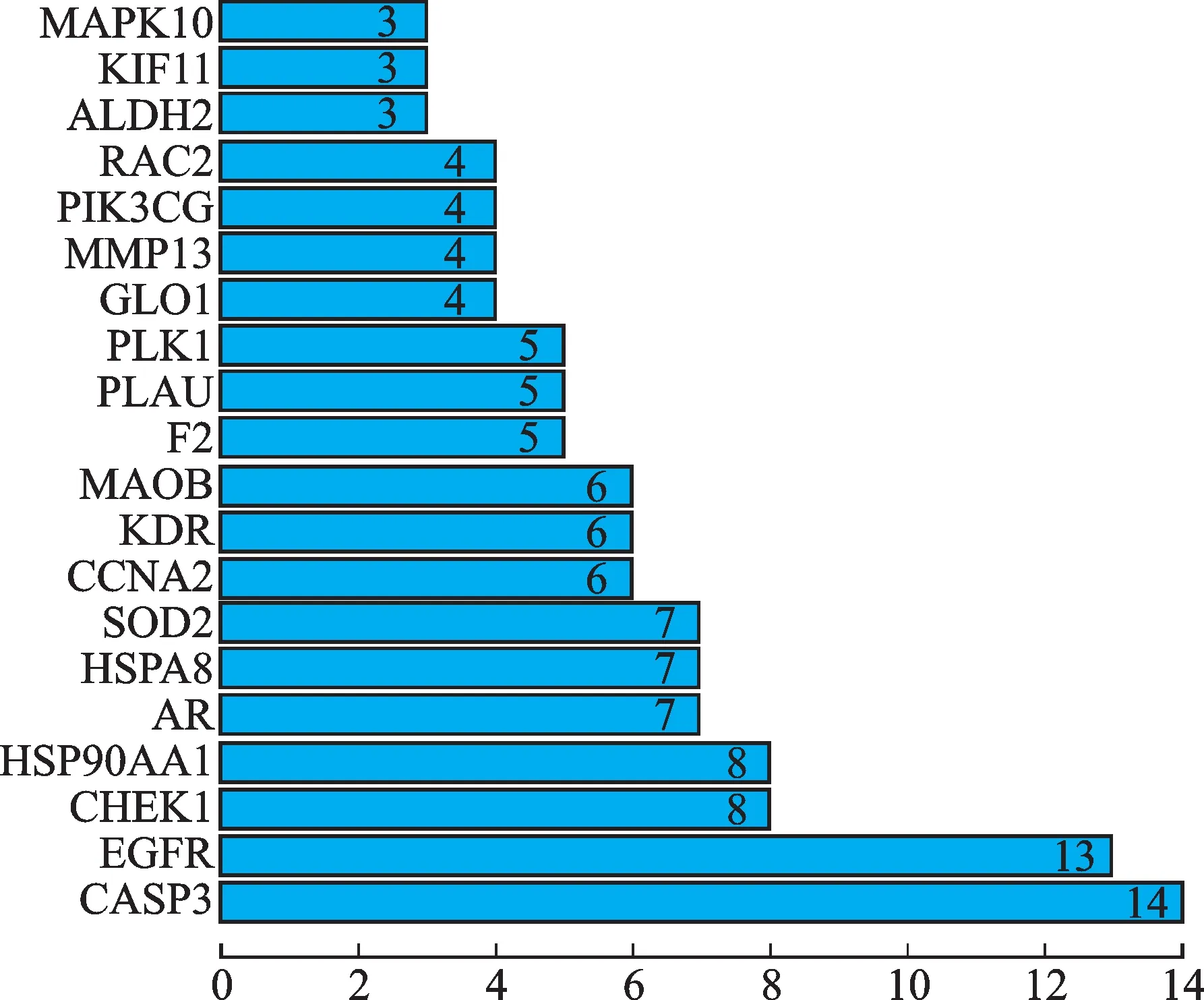
图4 PPI网络蛋白连接节点计数Fig.4 Connection node counts of PPInetwork proteins
2.6 GO功能富集分析及KEGG通路富集分析
GO富集分析确定213个条目,GO生物学过程分析发现DEGs主要集中在活性氧代谢过程、对类固醇激素的反应、纤维蛋白溶解、细胞外基质拆卸等方面。在细胞组成部分,DEG参与黏着斑、细胞-底物连接、囊泡内腔、侵袭性伪足等方面。在分子功能部分,DEG参与氧化还原酶活性、丝氨酸型内肽酶活性。结果表明,DEGs主要参与活性氧的调节,细胞周围基质调节、对类固醇激素的反应(图5)。KEGG富集分析确定了24个条目,结果显示,这些DEGs参与丙酮酸代谢、糖酵解/糖异生、Fox O信号通路、大肠癌、酪氨酸代谢、IL-17信号通路、细胞凋亡等信号通路(图6)。
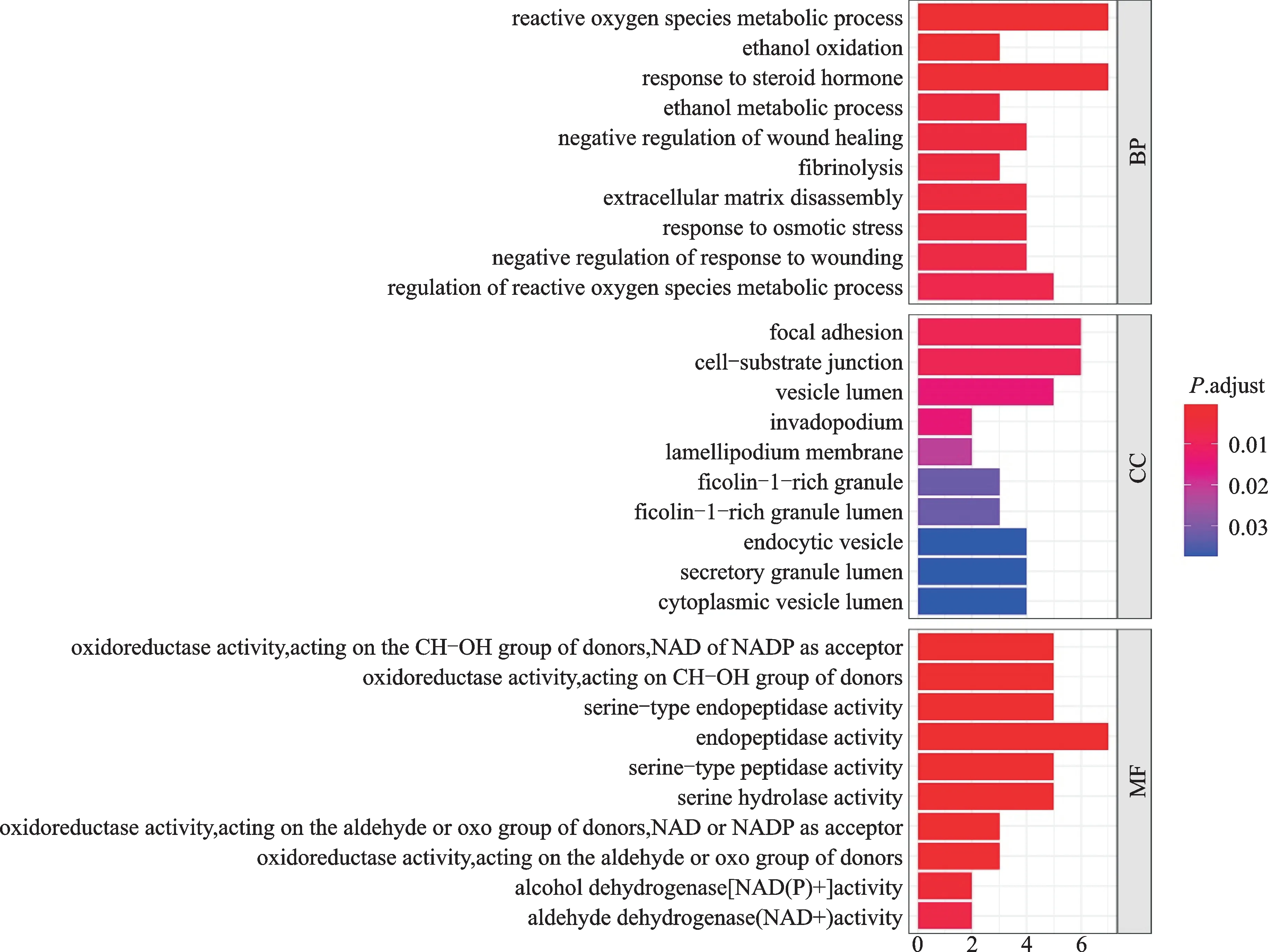
图5 姜黄素调控肾透明细胞癌的GO分析Fig.5 The GO analysis of curcumin regulating the RCCC
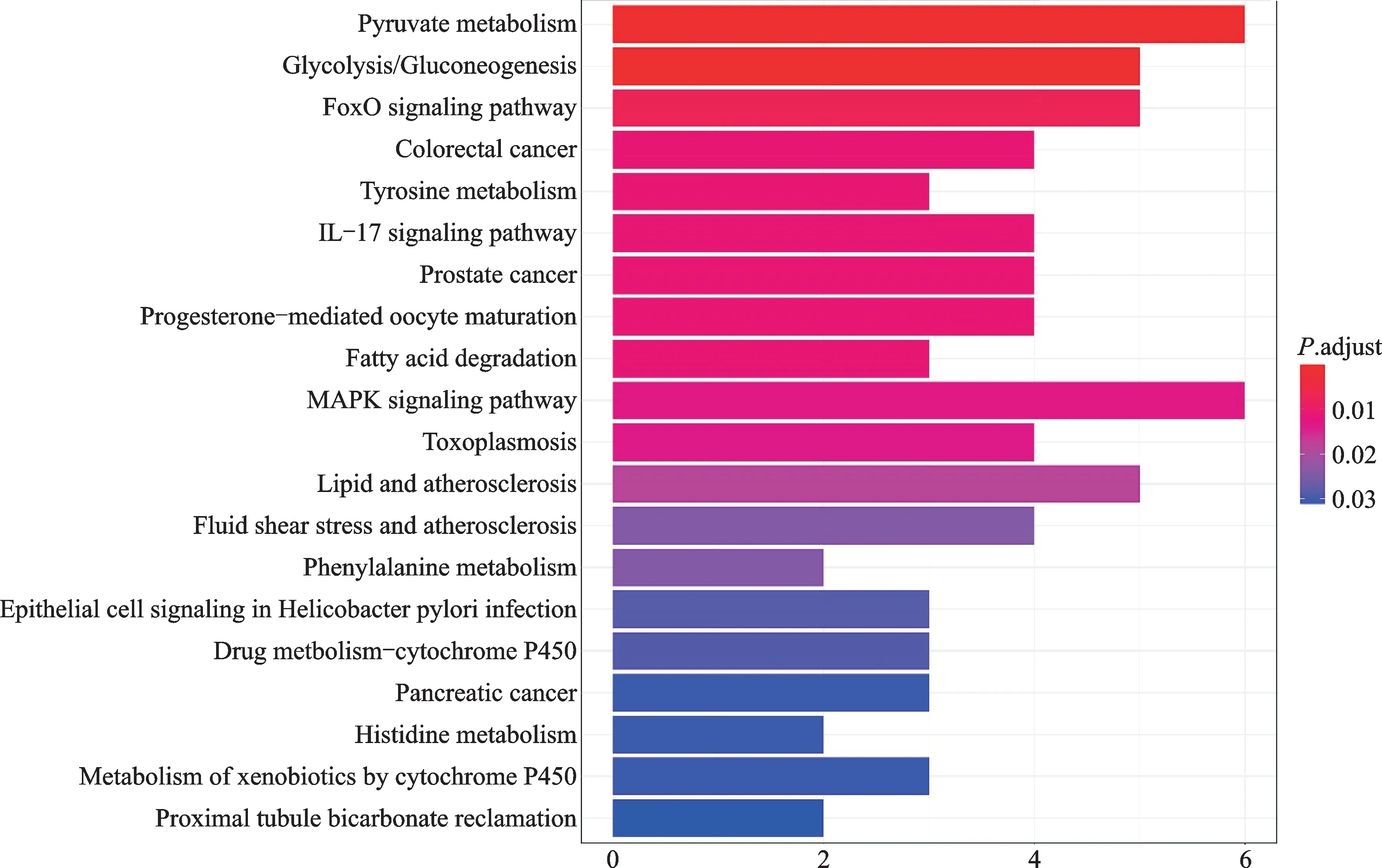
图6 姜黄素调控肾透明细胞癌的KEGG分析Fig.6 The KEGG analysis of curcumin regulating RCCC
2.7 姜黄素抑制肾癌细胞的增殖
786-O、ACHN细胞用不同浓度的姜黄素(0~80μmol/L)处理12、24、48 h。使用CCK-8测定法定量细胞增殖能力(图7A、图7B)。本研究观察到姜黄素对786-O、ACHN细胞的剂量依赖性抑制作用,同时确定了暴露于姜黄素的786-O、ACHN细胞在不同时间段的活力。姜黄素以时间和剂量依赖性方式降低了786-O、ACHN的活力(图7C、图7D)。
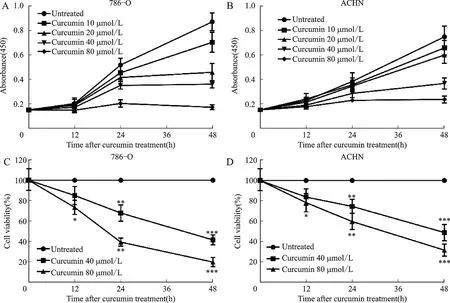
图7 姜黄素抑制786-O、ACHN细胞增殖并降低细胞活力Fig.7 Curcumin inhibited the proliferation and reduced cell viability of 786-O and ACHN cells
2.8 姜黄素通过氧化应激抑制肾癌细胞增殖
通过网络药理学分析,推测姜黄素可能通过氧化应激途径抑制肾癌细胞增殖。本研究检测了在与姜黄素孵育后的786-O和ACHN细胞中细胞内活性氧的水平和MDA水平。40μmol/L姜黄素组786-O细胞胞内活性氧水平高于对照组,差异有统计学意义(P<0.05),80μmol/L姜黄素组细胞内活性氧水平显著高于对照组(P<0.001)。在ACHN细胞中观察到相似的结果(图8A)。MDA测定显示,与对照相比,40μmol/L姜黄素组的MDA水平升高(P<0.05),80μmol/L姜黄素组的MDA水平显著升高(P<0.001),这些结果在786-O细胞和ACHN细胞中均观察到(图8B)。在姜黄素孵育之前用NAC(一种氧化应激抑制剂)处理细胞,CCK 8法显示,当用NAC处理时,786-O和ACHN细胞的细胞活力较未使用NAC明显恢复,差异有统计学意义(图8C)。结果表明,姜黄素抑制细胞增殖可能与促进RCC细胞内活性氧积累导致细胞死亡有关。
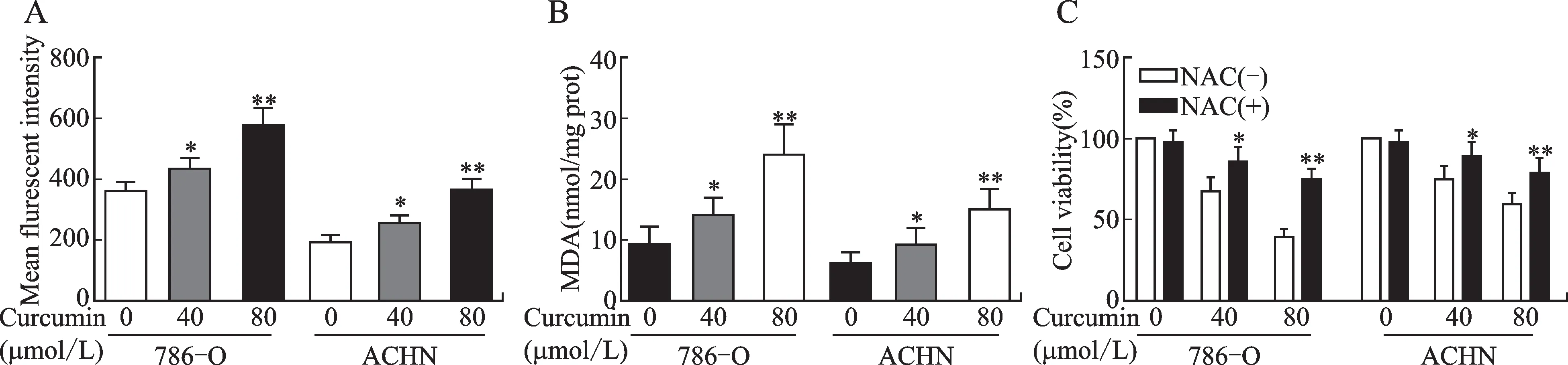
图8 姜黄素对肾细胞癌细胞的作用可能与氧化应激途径有关Fig.8 The effect of curcumin on RCCC might be related to the oxidative stress pathway
3 讨 论
本研究通过网络药理学及生物信息学确定了37个在肾透明细胞癌差异表达并影响预后的姜黄素靶蛋白。PPI显示CASP3、EGFR、CHEK1、HSP90AA 1、AR等为主要核心靶点。半胱天冬酶-3(caspase-3,CASP3)是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分[7]。WOO等[8]研究发现,姜黄素处理Caki细胞会导致CASP3活化,诱导细胞凋亡。表皮生长因子受体(epidermal growth factor receptor,EGFR)是抗癌治疗的重要靶标。姜黄素是最有希望的显示出抗EGFR活性的天然化合物之一[9]。MARCELINA等[10]证实姜黄素除了直接抑制EGFR活性外,还可以通过插入脂质双层导致其硬化,姜黄素对膜的这种作用减缓了受体的扩散,很可能通过影响受体的二聚化抑制EGFR的活化。检查点激酶1(checkpoint kinase 1,CHEK1)是一种丝氨酸/苏氨酸特异性蛋白激酶,在人体中由CHEK 1基因编码。Chk1协调DNA损伤反应(DDR)和细胞周期检查点反应,Chk1的激活导致细胞周期检查点、细胞周期的启动。SAHU等[11]研究发现,ATM/Chk1在姜黄素介导胰腺癌的G2/M细胞周期停滞和细胞凋亡中起关键作用。HSP90AA 1基因编码的热休克蛋白90α(Hsp90α)是分子伴侣Hsp90的应激诱导亚型。Hsp90α的失调与不同类型癌症的发生和发展密切相关[12]。姜黄素处理可显著抑制了Hsp90α的表达[13]。DALIN等[14]研究证实,雄激素受体(AR)诱导的HIF2α/VEGF信号驱动RCC进展,并在体外和体内多种模型中证实二甲基姜黄素(ASC-J9,特异性AR降解增强剂)足以抑制AR诱导的HIF2α/VEGF信号传导和RCC进展。
GO富集结果表明,姜黄素通过靶向肾透明细胞的差异表达蛋白参与活性氧的调节,细胞周围基质调节、对类固醇激素的反应。先前研究发现姜黄素的药理作用与其抗氧化作用相关[15],但是近年来很多研究发现具有抗氧化作用的多酚类药物在一定条件下具有促氧化作用。这可能与姜黄素浓度相关。有研究表明,姜黄素诱导的MMP去极化导致ROS产生减少,但添加Cu2+可完全恢复细胞内ROS,Cu2+可结合并改变姜黄素的理化性质,从而显著增强其抗增殖作用[16]。通过促氧化剂升高癌细胞内的活性氧(reactive oxygen species,ROS)是治疗癌症的策略之一。JUNG等[17]研究表明,姜黄素通过ROS介导的DR5上调增强了肿瘤坏死因子相关的凋亡诱导配体诱导的肾癌细胞凋亡。MORTEZAEE等[18]研究发现,姜黄素激活细胞内的氧化还原反应,诱导活性氧(ROS)的产生,从而导致肿瘤细胞膜上凋亡受体的上调,诱导细胞凋亡。本研究发现,姜黄素组的ROS及MDA含量显著高于对照组。而姜黄素孵育之前用NAC处理肾癌细胞后,其细胞活力较未使用NAC明显恢复。即姜黄素可能通过促氧化作用对肾癌细胞产生抗增殖作用,对细胞周围基质调节可能是姜黄素抑制肾癌细胞侵袭的机制。
KEGG富集分析结果主要涉及丙酮酸代谢、糖酵解/糖异生、FoxO信号通路、大肠癌、酪氨酸代谢、IL-17信号通路、细胞凋亡等信号通路。研究发现,姜黄素激活细胞内的氧化还原反应,诱导ROS的产生,从而导致肿瘤细胞膜上凋亡受体的上调,姜黄素还可以上调p53的表达和活性,从而抑制肿瘤细胞增殖并增加细胞凋亡[18]。此外,姜黄素对NF-κB和COX-2的活性具有强效抑制作用[19-20],它们参与Bcl-2等抗凋亡基因的过表达。ZHANG等[21]研究发现,姜黄素通过对PI3K/AKT信号通路的负调节发挥抗癌作用,并且可能代表一种有前途的治疗RCC的新药。
本研究借助网络生物学数据和网络药理学,分析姜黄素作用于肾透明细胞癌的潜在分子机制,结合相关文献表明姜黄素抑制肾癌细胞增殖的作用机制是多靶点多通路的,并初步证实姜黄素可能通过促氧化作用对肾癌细胞产生抗增殖作用。本研究为进一步探究姜黄素治疗肾透明细胞癌机制提供实验研究依据和思路,后续需进一步研究和验证。

