四氧化三钴的制备及在过氧化氢电化学传感器中的应用
许利剑 张 玲 唐思佳 唐曾民
湖南工业大学 生命科学与化学学院 湖南 株洲 412007
0 引言
过氧化氢(H2O2)具有很强的氧化性,常作为漂白剂广泛应用于食品包装、医疗健康、化工等行业。另外,H2O2也是生物组织细胞中生物氧化酶的代谢产物之一。正常的H2O2浓度水平是维持细胞正常生理活动的关键;但H2O2浓度过高,会使细胞中毒,可能引起中枢神经系统疾病、心血管疾病、糖尿病,甚至癌症[1]。因此,对H2O2进行灵敏、快速检测具有重要意义[2]。目前,检测H2O2的方法有滴定法[3]、荧光法[5]、比色法[5]、电化学法[6]。其中,电化学法是一种非常有效的方法,具有操作简单、检测成本低的特点[7-10]。根据电极修饰材料,H2O2电化学传感器可分为酶和非酶H2O2电化学传感器[11]。经辣根过氧化氢酶修饰的H2O2电化学传感器具有高的选择性和精密度,但易受环境影响(如温度、溶液pH等),出现不稳定[12]。而非酶H2O2电化学传感器具有不易受温度、离子浓度、溶液pH以及有毒化学物质的影响,以及制备简单、重现性佳的优点。
一些贵金属及其含有贵金属的活性材料广泛用于非酶H2O2电化学传感器,如铂、钯、金、银等。贵金属是电化学还原H2O2的主要催化剂,催化效率高、稳定性好[13],但贵金属昂贵和稀缺阻碍了其应用[14]。因此,过渡金属氧化物成为构建H2O2电化学传感器的候选材料[15]。作为一种过渡金属氧化物,Co3O4拥有较好的化学稳定性、电子传导性和催化活性,是P型半导体,正极末端有2个Co2+、2个Co3+和4个O2-,负极末端有2个Co3+和4个O2-,这些离子极性位点有助于检测电荷[16-19]。Xia S.Y.等[20]采用水热法制备了球体和立方体的Co3O4,并对比分析了Co3O4的形貌对电化学检测H2O2性能的影响,结果表明立方体Co3O4与电极的接触面积比球体Co3O4的大,立方体Co3O4的修饰电极具有更好的灵敏度和更低的检出限,该电化学传感器对H2O2检测的灵敏度为 211.5 μA/(mmol·L-1·cm2),线性范围为 0.04 ~2.88 mmol/L,检出限为1.208 μmol/L。H.Khadhraoui等[21]采用溶胶-凝胶法在ITO(indium tin oxide)玻璃基板上生长Co3O4薄膜,通过循环伏安法(cyclic voltammetry,CV)和安培法研究Co3O4修饰电极构建的传感器对H2O2的检测性能,该电化学传感器对H2O2检测的灵敏度为 1450 μA/(mmol·L-1·cm2),线性范围为0.05~1.10 mmol/L,检出限为18 nmol/L,同样也显示出优异的稳定性和高选择性。
本论文采用水热法合成片状Co(OH)2前驱体,进一步通过煅烧得到片状Co3O4,以片状Co3O4为电催化活性材料,通过滴涂法构建H2O2电化学传感器。系统研究了煅烧温度对Co3O4形貌以及H2O2检测性能的影响。
1 实验部分
1.1 实验试剂
六水氯化钴(CoCl2·6H2O)、辛胺(octylamine)、全氟磺酸型聚合物溶液(Na fion溶液),北京伊诺凯科技有限公司;聚乙烯亚胺(polyethyleneimine,BPEI)、盐酸多巴胺(dopamine hydrochloride,HCl-DA),北京伊诺凯科技有限公司;氢氧化钠(NaOH)、H2O2、尿酸(uric acid,UA),阿拉丁试剂(上海)有限公司;抗坏血酸(ascorbic acid,AA),天津基准化学试剂有限公司。
扫描电子显微镜(SEM),TESCAN MIRA3 LMU型,捷克泰思肯(中国)有限公司;X射线衍射仪(XRD),Model D/Max-2500型,日本Rigaku公司;电化学工作站,CHI440C型,上海辰华仪器有限公司。
1.2 样品制备
称取2.4 g CoCl2·6H2O(物质的量为10 mmol)溶于10 mL水中,配置浓度为1 mol/L的CoCl2溶液;将3 g BPEI溶于15 mL水中,配置质量浓度为0.2 g/mL的BPEI溶液。先在体积为20 mL的反应瓶中依次加入10 mL分子水、2 mL CoCl2(物质的量为2 mmol)溶液和300 μL BPEI溶液,搅拌并立即转入95 ℃水浴中;然后往混合液中加入1 mL辛胺(物质的量为6 mmol),继续搅拌并持续反应60 min;最后离心洗涤收集样品,并在60 ℃真空干燥箱中干燥12 h,得到粉红色Co(OH)2粉末样品。将得到的前驱体Co(OH)2置于管式炉中,以5 ℃/min的速率升温至设定温度(200, 500, 800 ℃)并维持该温度10 h,得到黑色Co3O4粉末。
水热过程中,辛胺能与水作用释放OH-,进而沉淀溶液中的Co2+,得到粉红色Co(OH)2。特定温度下煅烧Co(OH)2得到黑色Co3O4的化学反应式如下:

1.3 Co3O4/GCE修饰电极的制备
玻碳电极(glass carbon electrode,GCE)用尺寸为0.05 μm的氧化铝粉末(α-Al2O3)进行抛光,抛光至GCE表面呈现镜面;将抛光好的GCE依次放入分子水、乙醇超声清洗后,自然晾干,常温下保存;将Co3O4粉末超声分散于水溶液制备成3 g/L的悬浮液,用移液枪取5 μL悬浮液均匀滴涂于GCE表面,红外灯下干燥;然后用移液枪再取2 μL质量分数为0.05%的Na fion溶液滴涂于修饰材料GCE表面,自然晾干,得修饰电极Co3O4/GCE,分别命名为200-Co3O4/GCE、500-Co3O4/GCE、800-Co3O4/GCE。
修饰电极Co3O4/GCE的制备流程如图1所示。

图1 修饰电极Co3O4/GCE的制备流程Fig.1 The preparation process of modified Co3O4/GCE electrode
1.4 表征与测试
用扫描电子显微镜观察样品表面形貌;用X射线衍射仪分析样品晶型和组成;用电化学工作站测试修饰电极电化学性能,采用三电极体系,参比电极为饱和甘汞电极(saturated calomel electrode,SCE),对电极为Pt片电极,工作电极为Co3O4/GCE,电解液为0.1 mol/L的NaOH溶液;在有无H2O2存在的NaOH电解质溶液(质量浓度为0.1 mol/L )中,电位为0~0.8 V,电位扫描速率范围为10~100 mV/s,用循环伏安法测试工作电极;电位为0.6 V时,用计时安培法测试工作电极,检测工作电极与H2O2浓度的线性关系及抗干扰性。
2 结果与分析
2.1 物相与形貌的表征
图2为通过水热法所制备的前驱体Co(OH)2和经不同温度煅烧后得到的产物Co3O4的XRD图。
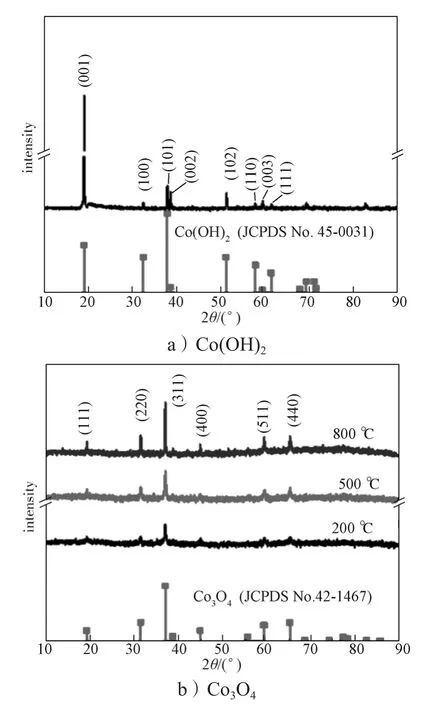
图2 Co(OH)2和不同煅烧温度下得到的Co3O4的XRD图Fig.2 XRD patterns of Co(OH)2 and Co3O4 calcined at different temperatures
从图 2a可以看出,Co(OH)2在2θ为 19.1°表现出极强的衍射峰,在32.4°, 37.8°, 38.5°, 51.3°,57.9°, 59.8°和61.6°出现了弱的衍射峰。以上衍射峰分别对应了Co(OH)2(JCPDS No.45-0031)的(001)、(100)、(101)、(002)、(102)、(110)、(003)和(111)晶面。经过200 ℃煅烧后,粉末颜色由粉红色变成黑色,XRD曲线也有明显变化(见图 2b)。在 19.3°, 31.8°, 36.8°, 44.9°, 59.5°,65.6°出现了Co3O4的衍射峰,分别对应Co3O4(JCPDS No.42-1467)的(111)、(220)、(311)、(400)、(511)和(440)晶面,表明所制备的材料为Co3O4晶体;并没有检测到如Co(OH)2和CoO等杂质的衍射峰,说明得到了比较纯净的Co3O4晶体。值得注意的是,随着煅烧温度的升高,所得样品的形貌改变,但并没有影响Co3O4的晶型,说明此方法制备的Co3O4晶体结构稳定性好。
图3为前驱体Co(OH)2和经不同温度煅烧后得到的Co3O4的SEM图。


图3 Co(OH)2和不同煅烧温度下得到的Co3O4的SEM图Fig.3 SEM of Co(OH)2 and Co3O4 obtained at different calcination temperatures
由图3a可知,Co(OH)2为二维的六边形片状结构,单片长度在4~15 m之间,厚度在200~800 nm之间。经过200 ℃(见图3b)和500 ℃(见图3c)煅烧后的Co3O4仍保持着六边形片状结构,尺寸也没有发生明显的变化,但是可以看出,当温度超过200 ℃片状Co3O4表面开始产生裂痕现象。裂痕的产生可能是由于在煅烧过程中Co(OH)2的缓慢氧化分解产生的水蒸发所致,这种裂痕结构或许可在一定程度上增加片状Co3O4的表面积,从而提供更多的活性催化位点。经过800 ℃煅烧后(见图3d),片状Co3O4存在略微的变形,表面光滑并未出现裂痕结构,但是分布了孔径较大的孔结构。这可能是由于煅烧温度过高,样品经熔融并重结晶而引起体积收缩,最终形成孔结构。
2.2 电化学性能表征
为了研究Co3O4/GCE的电化学性能,采用循环伏安法进行测试,不同修饰电极的CV曲线如图4所示。测试条件包括:1)电解液中H2O2的浓度为10 mmol/L;2)电位范围为0~ 0.8 V;3)扫描速率为50 mV/s。

图4 不同修饰电极的CV曲线Fig.4 CV diagram of different modified electrodes

彩图
由图4a可知,在浓度为0.1 mol/L的NaOH溶液中,修饰电极200-Co3O4/GCE在0.628 V处有一明确的氧化还原峰(紫色曲线),其反应可表示为

添加H2O2后,修饰电极Co3O4/GCE的氧化峰峰电流有明显增强(棕色曲线),其反应可表示为
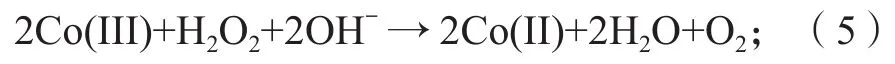
而裸GCE电极和修饰电极Co(OH)2/GCE在有无H2O2存在下均未出现明显的氧化还原峰,说明裸GCE和修饰电极Co(OH)2/GCE对H2O2并无响应。由此可知Co3O4非酶电化学传感器可以用于检测H2O2。
由图4b可知,在不同煅烧温度下得到的修饰电极Co3O4/GCE中,修饰电极200-Co3O4/GCE的氧化峰电流最强,可见煅烧温度对Co3O4的H2O2电化学检测性能具有明显影响。
以修饰电极200-Co3O4/GCE为分析对象,通过改变扫描速率,分析该修饰电极在检测过程的电催化动力学行为。不同扫描速度下(10~100 mV/s)修饰电极200-Co3O4/GCE的CV曲线以及峰电流与扫描速率的关系如图5所示。

图5 修饰电极200-Co3O4/GCE在0.1 mol/L NaOH电解液中的电化学行为Fig.5 The electrochemical behavior of 200-Co3O4/GCE in 0.1 mol/L NaOH solution
由图5可知,氧化峰、还原峰峰电流的大小与扫描速率之间均表现出良好的线性关系,揭示了电极基底材料在电解液溶液中的电化学过程是扩散控制,即200-Co3O4/GCE电极表面反应是一个典型的扩散控制过程;此外,随着扫描速度的增大,氧化峰的峰电位右移,还原峰的峰电位左移,说明该电化学过程有动力学弛豫现象,是一个准可逆过程[22-23]。
为确定修饰电极200-Co3O4/GCE检测H2O2的性能参数,本研究利用循环伏安法和计时安培法分别考察电流响应值与H2O2浓度的线性关系,测试结果如图6所示。
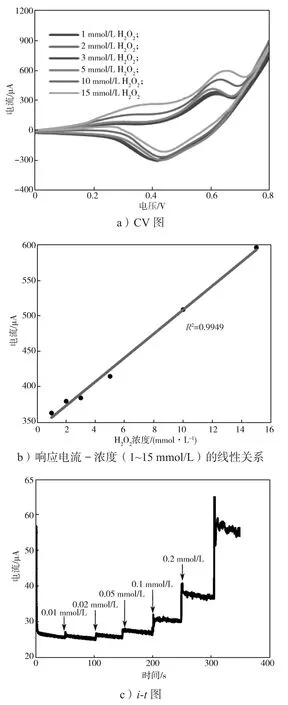

图6 响应电流峰值与H2O2浓度的线性关系Fig.6 Linear relationship between concentration of H2O2 and the peak current

彩图
由图6可知:1)当H2O2浓度逐渐从1 mmol/L增加至15 mmol/L,峰电流值也逐渐上升,这再次说明了修饰电极200-Co3O4/GCE对H2O2浓度有灵敏的响应。2)在较高浓度1~15 mmol/L范围内,峰电流与浓度表现出良好的线性关系。3)在0.6 V外加电压下,向体系中(NaOH溶液浓度为0.1 mol/L)滴加H2O2时,电流信号也是迅速增大,此时H2O2的浓度比较低,说明电极对H2O2有较高的电催化活性。4)修饰电极200-Co3O4/GCE在较低浓度0.01~0.20 mmol/L之间响应电流与H2O2浓度呈现良好的线性关系,其线性回归方程为I=61.8657C+ 24.8582(R2=0.9940),其中I表示响应电流(μA),C表示H2O2浓度。
根据上述得到的线性回归方程,可进一步计算200-Co3O4/GCE对H2O2浓度检测的检测限(LOD),该检测限值为 6.53 μmol/L(S/N=3, LOD = 3σ/S,其中σ表示在空白电解液中做10次平行测试后的标准偏差,S表示校准曲线的斜率),灵敏度为875.66 μA/(mmol·L-1·cm2),响应时间小于 5 s。将本电极与已经报道的Co3O4电极的性能进行比较,结果如表1所示。由表可知,修饰电极200-Co3O4/GCE表现出较低的灵敏度和较低的检测限。通过对比CO3O4的尺寸,修饰电极200-Co3O4/GCE中的Co3O4尺寸远远大于其他文献中Co3O4的尺寸,尺寸较大的Co3O4颗粒拥有较小的比表面积,削弱了其催化活性,从而表现出较低的灵敏度和较低的检测限。
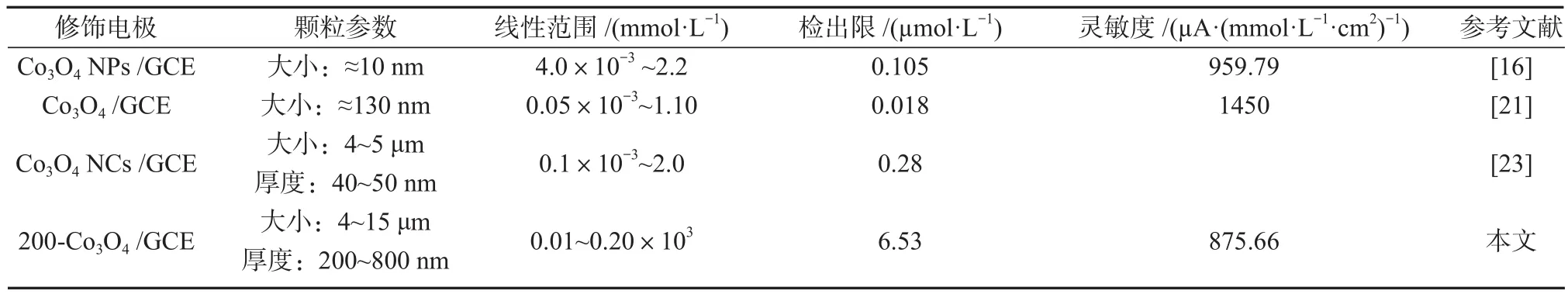
表1 Co3O4/GCE与已报道的H2O2检测电极的性能比较Table 1 Performance comparison of 200-Co3O4/GCE with previous H2O2 detectiom electrodes
修饰电极200-Co3O4/GCE对常见干扰物抗坏血酸(ascorbic acid,AA)、多巴胺(dopamine,DA)、尿酸(uric acid,UA)的响应情况如图7所示。


图7 修饰电极200-Co3O4/GCE的抗干扰性Fig.7 Anti-interference performance of 200-Co3O4/GCE
由图7a可知,修饰电极200-Co3O4/GCE对浓度为0.2 mmol/L的H2O2具有明显的电流响应,而对浓度为0.02 mmol/L的AA、DA及UA几乎没有峰值电流波动,且在AA、UA及DA同时存在的情况下,再次加入H2O2后,Co3O4/GCE依然对H2O2具有强烈的电流响应;由图7b可知,电解液中AA、DA的浓度超过0.04 mmol/L,会对H2O2的检测造成干扰。由此可见,该修饰电极在检测H2O2的过程中容易受干扰物的影响。由反应式(5)可知,由于H2O2参与了Co元素的氧化还原过程,因此引起氧化还原峰值的变化,然而该氧化还原峰并非H2O2的特征峰,因此该电极表现出较低的选择性。该现象可能也发生在其他的Co3O4电化学传感器中。根据目前的报道,二维结构的过渡金属氧化物是一种理想型的贵金属载体,通过在表面负载少量贵金属,可有效提高金属氧化对H2O2的检测性能[22],这为改善Co3O4电化学传感器的性能提供了有价值的参考。
3 结论
本研究通过水热法合成前驱体Co(OH)2六方纳米片,经过煅烧处理获得Co3O4六方纳米片电催化材料,并进一步构建出Co3O4/GCE电化学传感器用于H2O2的检测。最优条件下得到的Co3O4/ GCE电极检测H2O2时,在0.6 V外加电压下电流响应值最大,并且在较低浓度0.01~0.20 mmol/L之间灵敏度为 875.66 μA/(mmol·L-1cm2),检测限为 6.53 μmol/L;由于合成得到的Co3O4六方纳米片具有较大的尺寸,因而与已报道的非酶H2O2电化学传感器比较,该修饰电极200-Co3O4/GCE并未表现出极佳的电化学检测性能。
在未来的研究中,可通过负载少量的贵金属(如Ag, Pt等),进一步提高基于Co3O4的电化学传感器的检测性能。

