丙酮酸脱氢酶激酶4在胃癌中的表达水平及预后价值
庄燕燕
福建省晋江市中西医结合医院 362000
胃癌是全球最常见的恶性肿瘤之一,预后差,死亡率高,而我国是胃癌高发的国家,发病人数和死亡人数均约占世界的50%,因此,胃癌是我国重点防控的癌症之一[1]。尽管胃癌死因顺位在所有恶性肿瘤中有所下降,但胃癌死亡人数每年仍高达30万,约占全国总癌症死亡的15%[2],防控胃癌任重道远。随着基因芯片技术和生物信息学的快速发展,目前已经发现多种基因参与胃癌的发生发展,并且与胃癌的预后高度相关[3]。Warburg首次发现,与正常细胞不同,肿瘤细胞采用糖酵解作为主要的产能方式,以满足其快速增殖的能量需求,即瓦伯格效应[4]。随后人们发现,糖酵解代谢模式与丙酮酸脱氢酶复合物(Pyruvate dehydrogenase complex,PDC)的活性抑制有关,而这种活性抑制肿瘤发生与发展的重要分子事件[5]。
在人体内,PDC的活性主要受丙酮酸脱氢酶激酶(Pyruvate dehydrogenase kinase,PDK)调控,PDK是PDC的重要负性调节因子,其活性域可使PDC的关键蛋白发生磷酸化而抑制其活性,PDK蛋白的异常表达与多种恶性肿瘤的恶性行为相关[6-8]。PDK存在4种异构体,即PDK1、PDK2、PDK3、PDK4,其中PDK4是最重要的PDC调控因子。目前,国内外尚无学者探讨PDK4在胃癌组织中的表达及其与胃癌临床预后关系,因此PDK4在胃癌中的作用尚不明确。因此,本文采用生物信息学分析和大数据分析,探讨PDK4 mRNA在胃癌组织及癌旁组织中的表达情况,分析PDK4对胃癌总生存和无进展生存的影响,初步探讨PDK4的临床意义。
1 资料与方法
1.1 PKD4基因表达的数据收集 收集TCGA数据库(https://www.cancer.gov/about-nci/organization/ccg /research/structural-genomics/tcga)中375例胃癌组织和45例癌旁组织的mRNA表达矩阵,然后采用R语言筛选PDK4的mRNA数据,并记录其表达水平。
1.2 生存数据来源 采用Kaplan-Meier plotter在线数据库收集不同PDK4表达水平生存曲线,其官方网址是http://kmplot.com/analysis[9]。本文提取基因是PDK4,对应的基因编码是205960_at。根据数据库提供的参数条件,设置以下筛选条件:(1)数据模块:Start KM plotter for Gastric cancer;(2)基因符号(Gene symbol):PDK4;(3)人群分组:采用自动分组(Auto select best cutoff);(4)生存结局:总生存和无进展生存。
1.3 研究指标及统计学方法 本文主要的研究指标是胃癌组织和癌旁组织中PDK4的表达差异以及不同PDK4基因表达水平下的生存结果。基因表达差异采用t检验,利用R语言统计。生存比较采用Kaplan-Meier生存曲线图表示,采用Kaplan-Meier plotter在线分析。主要效应指标为风险比(HR)及其95%置信区间、P值。P<0.05组间差别有统计学意义。
2 结果
2.1 胃癌组织及癌旁组织中PDK4的表达情况 共有420个样本纳入分析,其中癌旁组织45个样本,PDK4中位表达水平为4 211(2 897~6 245);而胃癌组织375个样本,PDK4中位表达水平为6 777(2 799~9 374),差异具有统计学意义(P<0.001)。见图1。
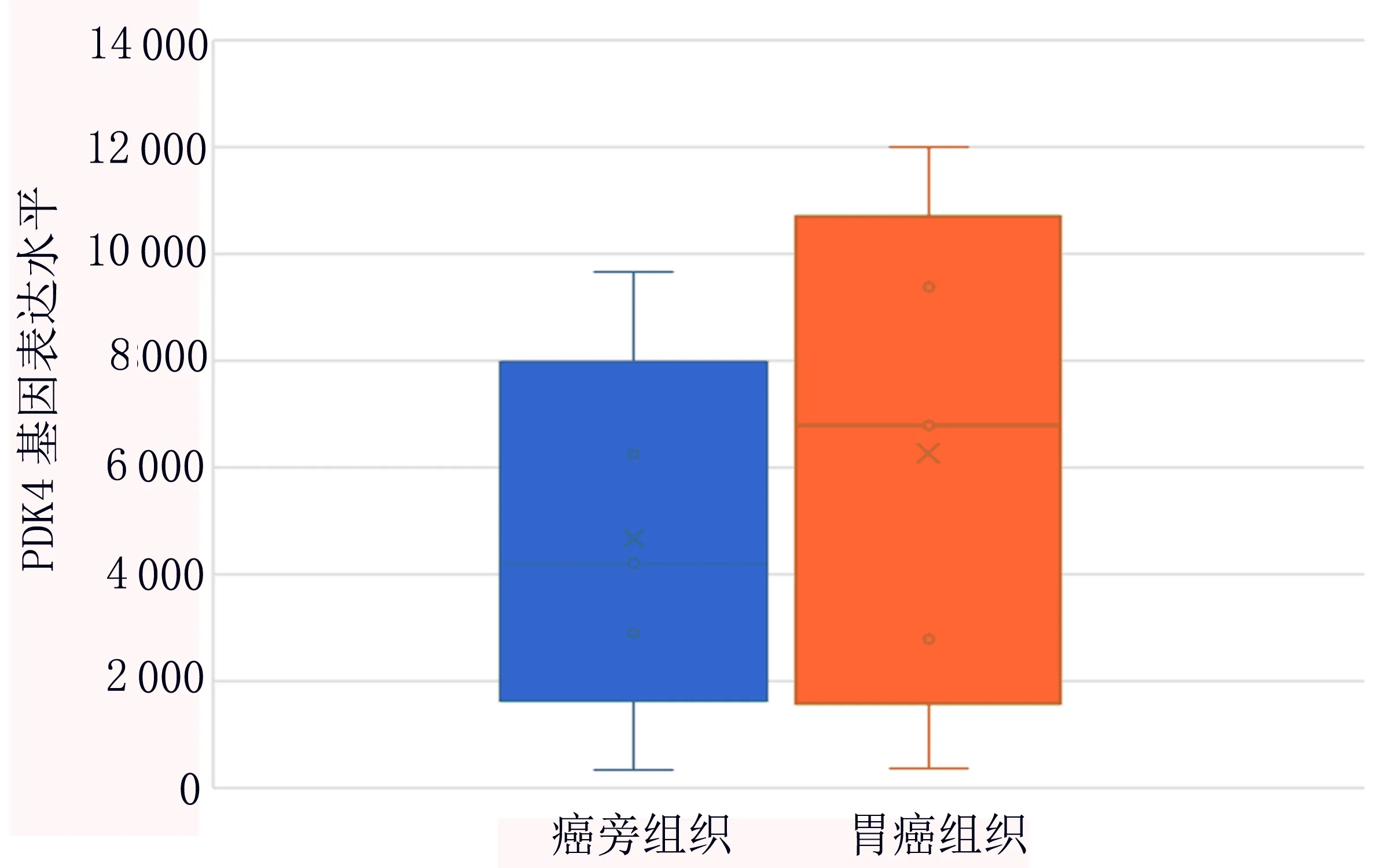
图1 胃癌组织及癌旁组织中PDK4的表达情况
2.2 不同PDK4表达水平下的总生存(OS)结果 共875例胃癌患者纳入总生存分析,其中646例患者属于PDK4高表达组,229例患者为低表达组。PDK4基因低表达组患者中位OS为53.43个月,而PDK4基因高表达组OS为27.8个月;风险比HR=1.46,95% CI 1.18~1.79,差异具有统计学意义(P=0.000 36)。相应的OS曲线见图2。
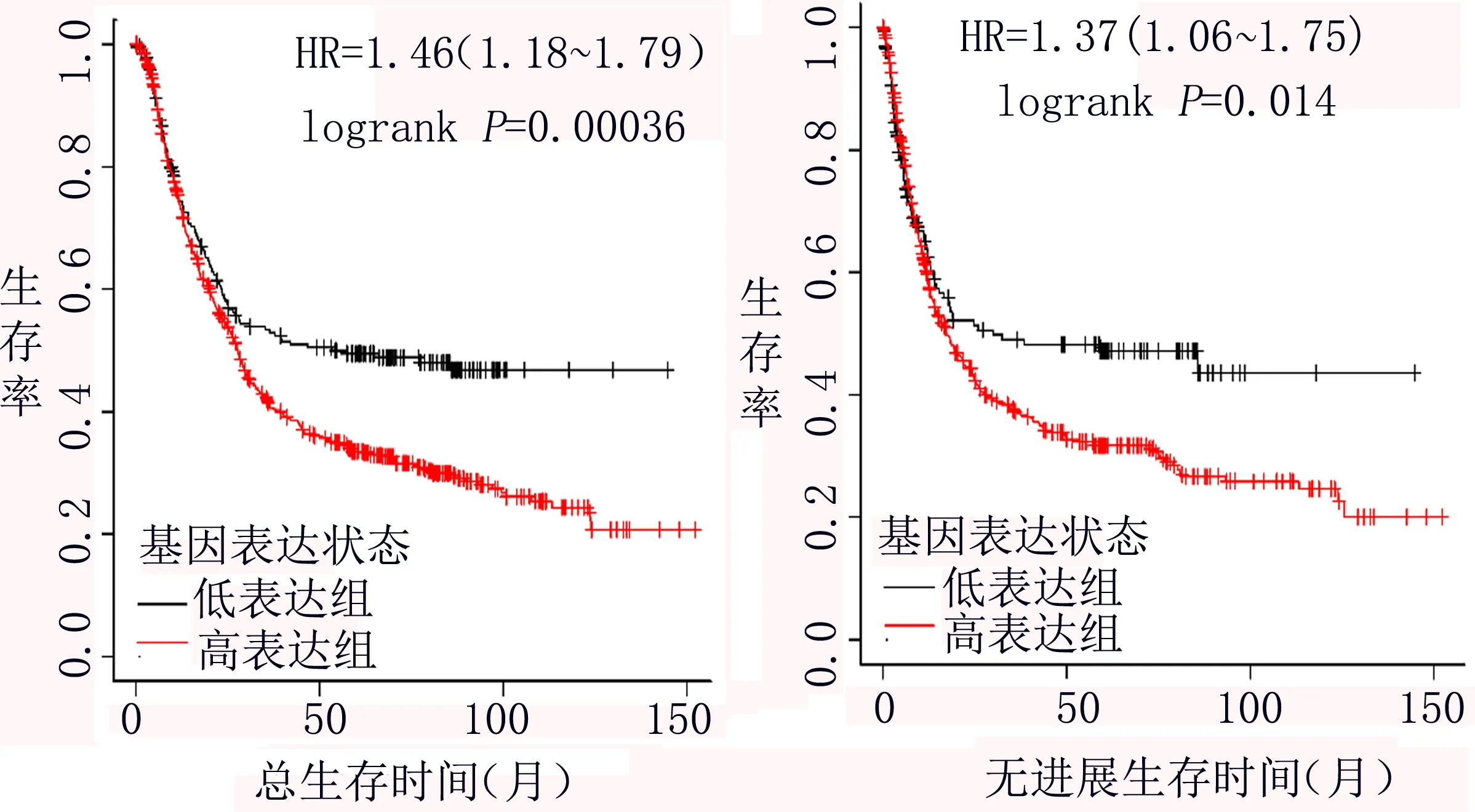
图2 不同PDK4基因表达状态的总生存和无进展生存曲线图
2.3 不同PDK4表达水平下的无进展生存(PFS)结果 共有640例胃癌患者被纳入PFS分析。其中479例患者为PDK4高表达组,161例为低表达组。PDK4基因低表达组患者中位PFS为30.00个月,高表达组为17.3个月;风险比HR=1.37,95% CI 1.06~1.75,差异具有统计学意义(P=0.014)。PFS生存曲线见图2。
3 讨论
胃癌是一种常见的消化道肿瘤,手术是其最重要的治疗手段,然而对于多数胃癌患者,即使接受手术治疗,其5年生存率也只有15%~20%。如何提高胃癌的长期生存是目前肿瘤防控的重要任务[10]。既往研究表明,肿瘤细胞获取能量的主要途径是糖酵解,而这一现象也被称为Warburg效应[4]。研究发现,通过抑制糖酵解,可以抑制Warburg效应,并切断肿瘤细胞的能量供应,继而诱导肿瘤细胞死亡,是一种潜在的治疗措施[8]。PDK介导的PDC可能参与Warburg效应[11],因此越来越多学者关注PDK在恶性肿瘤中的表达及预后价值。
童晶涛等人发现,PDK1基因在结肠癌组织中高表达,而在癌旁组织中则是低表达,进一步采用PDK抑制剂来抑制PDK1的活性时,发现结肠癌细胞增殖活性被明显抑制[8]。陈艳荣等人发现,结肠癌组织中PDK4蛋白的表达率显著高于癌旁组织,且PDK4蛋白的表达水平与肿瘤的分化程度、临床分期、淋巴结转移、预后等密切相关,提示PDK4可能参与结肠癌的发生、发展,是重要的促癌基因[6]。
胃癌同样属于消化道肿瘤,但目前尚无学者探索PDK4在胃癌中的预后价值。笔者通过TCGA数据库下载mRNA表达数据,结果发现胃癌组织PDK4中位表达水平为6 777(2 799~9 374),而癌旁组织中位表达水平为4 211(2 897~6 245),差异具有统计学意义(P<0.001),说明与结肠癌相似,PDK4同样可能参与肿瘤的发生发展。在本研究中,基于Kaplan-Meier plotter在线分析显示,PDK4基因低表达组患者中位OS和PFS均显著优于PDK4基因高表达组,说明PDK4基因是一种促癌基因,明显影响胃癌患者的预后。
目前,PDK4基因发挥促癌的机制尚未形成共识。一种观点认为,PDK4基因高表达,显著提高了肿瘤细胞的糖酵解能力,改善了肿瘤细胞的能量供应,从而促进肿瘤的发生发展。PDK4表达的调控还可以改变并促进人乳腺癌细胞、膀胱癌细胞耐药性,影响肿瘤内分泌治疗或化疗的疗效[12-13]。因此,PDK4可望成为恶性肿瘤有效的治疗靶点。
总之,根据TCGA数据分析和Kaplan-Meier plotter在线分析,笔者发现PDK4的表达水平与胃癌的预后存在相关性,或许PDK4可成为改善胃癌预后的新靶标,为今后对胃癌的基础研究和临床靶向治疗提供参考。需要注意的是,本文仅基于生物信息学分析,需要在实际病人群众进行验证,因此需要开展相关的临床和基础实验,以确认PDK4的价值。

