力学刺激影响心脏发育的研究进展
谢明辉,乔韡华,曹 红,史嘉玮,董念国
华中科技大学同济医学院附属协和医院心血管外科,武汉 430022
先天性心脏病(congenital heart disease,CHD)发病率约占新生儿的1%,是1岁以下婴儿死亡的主要原因之一[1],主要表现为多种心脏结构发育的异常。除了遗传因素,心脏毒性药物和血流动力等非遗传因素也可通过调节基因表达来调控心脏的发育与成熟。血液的流动可产生多种机械力,包括血压施加在血管壁上的法向力、血管因法向力而伸展产生的相关周向应力以及血液沿着血管壁流动时的摩擦力(也称剪切应力)[2]。与其他血管内皮细胞相比,心内膜细胞还接收除血流动力以外的其他生物物理力和机械应力,包括心脏舒张期的拉伸和收缩期的紧缩[3]。研究表明,血液的机械信号可诱导细胞水平上的基因表达,将分子水平事件的发生转化为组织水平的结构改变,进而引导胚胎心血管系统发育与成熟[4- 6]。
力学刺激对心脏发育的调节
心脏形态发育过程在不同物种之间略有区别,但通常包括心管形成、心袢形成、心内膜垫及瓣膜、间隔形态发生、心室发育与成熟等阶段。心脏发育涉及复杂的组织形态发生和重塑,其中力学刺激发挥着重要作用(图1)。
心管形成在心脏发育早期,两侧分离的心源性中胚层间充质细胞迁移至腹中线并形成中空管状结构,即原始心管。心管由外层心肌细胞层和内层心内膜细胞层组成,两者之间隔有含胶样结缔组织的细胞外基质(extracellular matrix,ECM)[7]。由ECM纤维连接蛋白构成的力学微环境和细胞黏附是心脏早期重要的机械刺激[8]。通过对纤维连接蛋白和中胚层细胞追踪成像发现,组织间的对流运动显著影响早期细胞迁移[9- 10]。Holtzman等[9]和Aleksandrova等[11]发现心脏融合包括内侧运动和角运动两种定向细胞运动,这一过程可能受到心内膜细胞及纤维连接蛋白的调控。心管形成过程中,心肌前体细胞与其周围ECM作为组织复合体一起迁移,称为组织运动。体内动态成像和计算机模拟证明心肌组织通过组织运动定向迁移到腹中线[12],内胚层的汇聚融合及心肌组织的收缩弯曲在其中发挥重要作用[13- 14],并受鞘氨醇- 1-磷酸及血小板衍生生长因子(platelet-derived growth factor,PDGF)等信号通路的调节[15- 16]。许多先天性心脏缺陷如Cornelia de Lange综合征表现为内胚层缺陷[17],因此了解内胚层和心脏中胚层之间的力学相互作用有助于阐明此类疾病的发病机制。
心袢形成心管呈不对称生长,弯曲扭转呈“S”形的过程称心袢形成。心袢形成的可能机制包括心脏胶质的扩张、心管的差异生长以及由于残余应力导致的心肌背侧系膜缩短[7- 8,18]。但这些假设与现有的实验数据并非完全吻合,可能是因为受到其他补偿机制的影响。目前已有多种实验方法来量化心袢阶段心脏内的应力和应变[19- 21],包括“C”形心袢(右袢)阶段和“S”形心袢阶段。在心脏发育的右袢阶段,离体心管可以弯曲而不能扭转[22],表明右袢的弯曲主要受细胞内力影响,而扭转主要是由细胞内力和邻近组织外力共同驱动[23],即细胞骨架的收缩、肌动蛋白聚合驱动的心肌细胞形变和ECM微力学刺激等[24- 25]。
心内膜垫及瓣膜、间隔形态发生在“S”形心袢成熟过程中,单管心管逐渐转化为2个平行的体循环和肺循环通道。房室管(atrioventricular canal,AVC)和流出道(outflow tract,OFT)部位的心肌细胞分泌ECN沉积在心脏胶质部,形成AVC和OFT心内膜垫。心内膜垫间充质来源于内皮间充质转化(endothelial-to-mesenchymal transition,EndoMT)的心内膜细胞,神经嵴细胞也参与OFT心内膜垫间质细胞的形成,该过程受到骨形态发生蛋白(bone morphogenetic protein,BMP)信号及ECM的调节作用[26- 27]。在瓣膜形成前,心房、AVC和心室的协调收缩发挥原始瓣膜作用,并驱动形成原始心管的单向血流。但AVC处仍存在逆向血流,其产生的剪切应力被心内膜细胞感知后,可诱导流动反应基因Krüppel样转录因子2(Krüppel-like transcription factor 2,KLF2)的表达,促进心内膜垫的发育进程[28]。
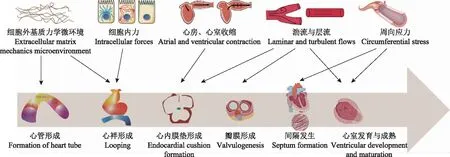
图1 心脏发育的力学调节
心内膜垫经过生长和重塑,形成成熟心脏的瓣膜及膜性间隔,其中瓣膜细胞异质性和血流动力学在瓣膜形成过程中发挥重要作用[29- 30]。在人体中,血液振荡流动和逆向流动通常可促进动脉粥样硬化和炎症形成[31],但在斑马鱼AVC处的振荡流动却有助于瓣膜形成[32- 33]。振荡流动激活心内膜细胞表面机械敏感钙离子通道多囊肾病2型致病基因(polycystic kidney disease gene 2,PKD2)和瞬时受体电位香草素亚型4(transient receptor potential vanilloid subtype 4,TRPV4),可诱导KLF2的表达,从而促进瓣膜的早期形成,而PKD2和TRPV4等位基因功能缺陷的斑马鱼胚胎发育形成了异常形态的瓣膜。内皮细胞的体外实验表明,血流动力学谐波频率(hemodynamic frequency harmonics,HFH)构成内皮炎症表型的关键调节因素[34]。HFH(尤其一次谐波)可通过PKD2和TRPV4通道的激活直接影响瓣膜形成和心内膜细胞反应[33]。血流动力的变化还可导致微小RNA(microRNA,miRNA)的表达改变,进而调节心血管的结构发育。比如miR- 21可被血液流动诱导表达,进而促进瓣膜祖细胞的增殖[35- 36]。此外,活化T细胞核因子(nuclear factor of activated T cell,NFAT)/钙调神经磷酸酶、Hippo-Yes相关蛋白(Yes-associated protein,YAP)和Notch信号通路参与响应机械力的瓣膜形态发生[37- 39],并受到Piezo和瞬时受体电位(transient receptor potential,TRP)等机械敏感通道调节[40]。因此,瓣膜发育过程依赖于多种血流相关的转录调节及信号通路的激活,但仍需要进行更多的研究明确瓣膜的机械转导网络。此外,关于静脉瓣的研究可能有助于发现心脏瓣膜相关的新的力学调节机制。
早期学者认为血流有助于心脏胶质和小梁共同形成分隔心腔的隔膜[41],其调节作用可能来自胚胎早期心脏内的两支螺旋流。由于心内压力梯度的存在,两支螺旋流之间可能形成早期心脏间隔[41]。卵黄静脉结扎可干扰胚胎心脏血流动力学,进而抑制心室间隔和瓣膜发育[42]。虽然“血流重塑”假说仍有争议,但现有实验证明胚胎心脏血流动力学的改变可以诱发多种心脏间隔发育畸形[14,43- 44],其中最常见的畸形是室间隔缺损。
心室发育与成熟血流是一种外力,可促进心室细胞的增殖,而心肌的收缩力是一种内力,限制心室细胞自身的大小。在汉堡汉密尔顿阶段(Hamburger-Hamilton stages,HH)23~30期,AVC处的高速血流在心室腔内形成明显的涡流。涡流出现的时间较心室腔发育扩张更早,而涡流大小与心室腔扩张程度相关,表明涡流的形成可能影响心室成熟[45]。同时,循环血压在小梁和致密心肌间产生周向应变梯度,可调节心肌细胞的增殖以及相关基因表达,从而促进心室发育[46]。此外,小梁处的剪切应力较高,经机械转导后促进心肌增殖成熟,从而促进心室的发育[47]。发育中的心室腔增加的壁张力或应力反过来也可促进小梁发育[48]。
随着胚胎心脏发育,循环血流形成的前负荷增加,可促进心室的扩张与成熟。左房结扎术是右心室前负荷增加和左心室前负荷降低的模型,术后可导致左侧AVC和共同心室左侧的壁应力水平下降[49- 50],出现左室心肌细胞增殖减少而右侧心肌代偿性过度发育的病理特征。在此基础上,部分夹闭右心房会增加流向左心室的血流量,导致基于心肌细胞增殖的左心室容积及心肌致密度的增加[51]。由于右心室的可塑性较左心室高,单纯的右房结扎处理不会导致类似左房结扎术后的严重形态缺陷[42]。OFT部分结扎处理后,该区域血流速度和室壁运动增加,术后狭窄处血流及后负荷增加能为心肌细胞的生长提供更多能量[52]。而病理性OFT梗阻可导致心室发育不良,梗阻解除后可一定程度上改善心室发育[53]。此外,有学者利用4D薄片成像技术研究心内膜运动。通过注射GATA结合蛋白- 1a(GATA binding protein 1a,GATA- 1a)吗啉低聚物抑制造血,从而降低血液黏度和剪切应力,最终导致心肌发育受抑制[54]。此外,收缩受抑制的弱心房m58突变体可产生心室高度发育不全的先天性畸形[54- 55]。虽然尚不清楚确切的力学作用机制,但在血流动力学紊乱的情况下,小梁及心肌发育的缺陷表明血流动力学在调节心室发育方面的重要性。
心内膜细胞的机械转导途径
将机械刺激转化为细胞信号的过程称为机械转导,包括诱导、早期适应反应和晚期重塑反应3个阶段[56]。内皮细胞表达多种机械感受器,包括离子通道、整合素、受体酪氨酸激酶、糖萼、初生纤毛、微囊、异三聚体G蛋白、血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule 1,PECAM1)和血管内皮钙黏蛋白(vascular endothelial-cadherin,VE-cadherin)等[57- 58]。这些机械感受器通过机械转导传递血流相关信号,并通过转化生长因子-β(transforming growth factor-β,TGF-β)/骨形成蛋白(bone morphogenetic protein,BMP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和Notch等下游信号通路引发调控反应[59- 60](图2)。与其他内皮组织类似,心内膜细胞对血流刺激非常敏感。血流刺激介导机械敏感的转录反应,从而引起心内膜细胞的形态及排列方向的变化,最终导致胚胎心脏对血流环境的形态及功能适应[59]。
PECAM1-VE-cadherin-VEGFR2复合物PECAM1、VE-cadherin和血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)组成的蛋白质复合物可介导对血流的多重反应[61]。VEGFR2以不依赖配体的方式被血流激活[62],激活后VEGFR2募集并激活胞内磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K),PI3K介导关键的下游信号[63],包括蛋白激酶B依赖的内皮型一氧化氮合酶的磷酸化[64]以及基底面整合素的构象激活[65]。整合素随后结合基底面的ECM,进而活化其邻近细胞的多种信号通路蛋白,包括Rho和Rac。Rho和Rac蛋白被激活后,引起内皮细胞的细胞骨架发生重构,进而发生细胞形变、拉伸以及细胞排列方向的改变以适应血流刺激[66- 67]。瓣膜内皮细胞排列依赖于Rho激酶信号通路,而血管内皮细胞排列依赖于Rho激酶和PI3K信号通路,从而导致2种细胞排列方向的差异性[68- 69]。
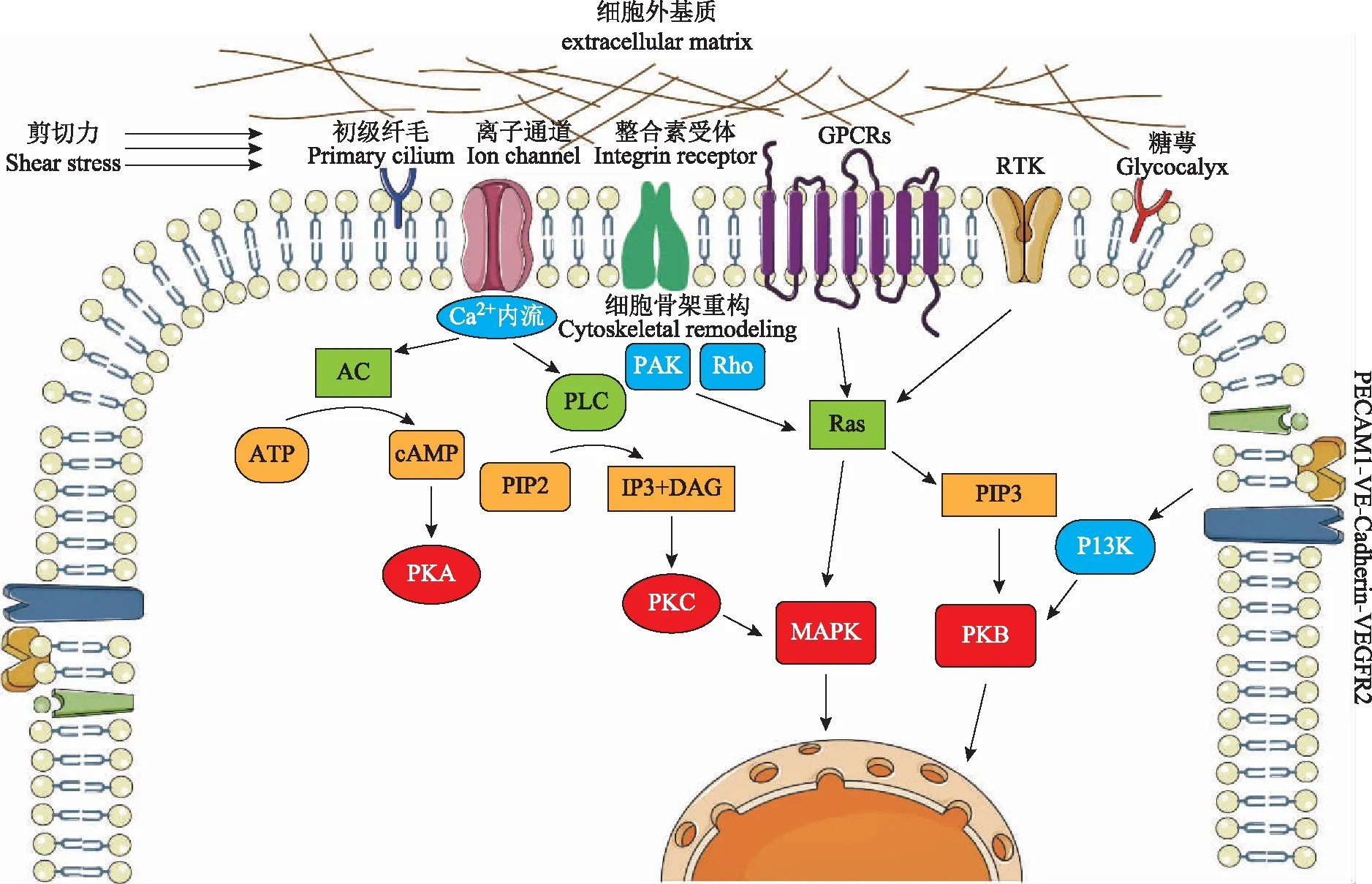
PECAM1:血小板内皮细胞黏附分子1;VE-cadherin:血管内皮钙黏蛋白;VEGFR2:血管内皮细胞生长因子受体2;GPCRs:G蛋白偶联受体;RTK:受体酪氨酸激酶;AC:腺苷酸环化酶;PLC:磷脂酶C;FAK:黏着斑激酶;ATP:三磷酸腺苷;cAMP:环磷酸腺苷;PIP2:磷脂酰肌醇二磷酸;PIP3:磷脂酰肌醇三磷酸;IP3:三磷酸肌醇;DAG:二酰基甘油;PI3K:磷脂酰肌醇3-激酶;PKA:蛋白激酶A;PKB:蛋白激酶B;PKC:蛋白激酶C;MAPK:丝裂原活化蛋白激酶
然而,PECAM1基因敲除的小鼠能够存活到成年,且只有轻微的心血管缺陷[70],表明内皮细胞相关的机械敏感通路在心血管发育过程中的作用不是唯一的,存在遗传补偿或多个通路的功能代偿。此外,VE-cadherin的敲除会导致心袢异常和心内膜细胞连接缺陷,并增加心内膜通透性[71]。但该研究未证明这些缺陷是由机械传导能力改变所致还是内皮细胞黏附功能改变所致。
初级纤毛随着心内膜的发育,初级纤毛维持在低血流或湍流处的内皮细胞表面,而在心内膜垫等高血流区域则无纤毛,这可能是与高剪切应力有关[72]。剪切应力刺激无纤毛表达的心内膜细胞后,可介导转化生长因子-β受体1(transforming growth factor-β receptor I,TGF-βR1)依赖的EndoMT过程,从而促进早期瓣膜的形成[73- 75]。内皮细胞的纤毛可能在感知低速血流中发挥关键作用,表达低水平KLF2,可通过Notch1信号介导邻近心肌细胞的增殖和分化[59,76- 77]。初级纤毛的空间分布差异,可能导致不同区域心内膜细胞对血流刺激的反应不同,而纤毛功能失调可导致房、室间隔发育缺陷等CHD的发生[78]。
离子通道血流可调节细胞膜流动性或张力的变化,通过激活细胞表面的离子通道,向胞内传递血流信号。文献报道在斑马鱼瓣膜形成过程中,纤毛与钙离子通道偶联传递剪切应力信号[72]。Piezo蛋白是一类机械激活的离子通道,可介导心内膜对血流的反应[79- 80]。其中,心内膜细胞表面的Piezo1通道由剪切应力激活[81],在AVC和OFT处表达水平最高,Piezo1缺失会导致细胞排列方向紊乱、血管发育缺陷甚至早期胚胎死亡[81- 82]。此外,PKD2和TRPV4能感知AVC区域的振荡血流,通过调节Ca2+水平和KLF2a的表达,影响瓣膜形成和心内膜细胞反应[33]。
总之,血流等力学刺激激活心内膜细胞表面的机械传感器后,力学刺激从细胞膜传递到细胞骨架,后者与核支架、染色质和核DNA相连,最终引起基因表达改变。
心肌细胞的机械转导途径
具有收缩特性的心肌细胞能直接感受到血流刺激,并影响血流模式[83]。在心脏形态发育阶段,心肌细胞通过改变其形态及增殖率来响应血流机械刺激[46,60]。附着在肌球蛋白细胞骨架上的机械传感器能够传递细胞间、细胞内和细胞外的机械刺激。例如,在细胞-ECM界面,整合素以肌原蛋白附着点和黏着斑为机械传感器;而在细胞-细胞连接处,相邻心肌细胞则通过闰盘上的N-钙黏蛋白黏附复合物传递机械力[84- 86]。
血流剪切应力、拉伸力和ECM等力学刺激共同参与心肌细胞的多个机械转导通路,促使发育中的心脏适应不断变化的血流动力学环境。研究发现Hippo-YAP通路参与心内膜细胞增殖及EndoMT、心脏成纤维细胞分化、冠状动脉发育等过程,该通路在调节心肌细胞增殖和分化、应激反应和机械信号转导中也发挥关键作用[87- 89]。ECM相关的力学微环境的改变可激活Hippo-YAP通路,进而调节心肌细胞增殖和凋亡,最终影响心脏发育和再生过程[90- 91]。局部拉伸等机械信号可导致细胞骨架重塑和YAP的激活[92- 93],激活的YAP通过与转录增强相关结构域(transcriptional enhanced associate domin,TEAD)等相互作用,促进新生心肌细胞增殖和胞质分裂[94- 95]。在心脏发育过程中,Hippo还与Wnt-β-catenin、胰岛素样生长因子等信号相互作用,调控心肌细胞的生长和增殖[96]。但机械应力是否通过Hippo信号直接调节YAP活性仍存在争议,有研究发现在Fat4基因敲除的小鼠心脏中,核YAP活性增加,而Hippo相关激酶如大肿瘤抑制激酶(large tumor suppressor kinase,LATS)和3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)的磷酸化水平没有改变[95,97]。总之,以Hippo-YAP通路为代表的机械转导通路调控着心脏发育过程中心肌细胞的增殖、凋亡、分化与成熟,从而影响正常的心脏发育与成熟,其可能是临床上一个潜在的心肌治疗靶点。
总 结
力学刺激在胚胎心脏发育过程中发挥着重要的调节作用。现有研究已证实,心内膜细胞和心肌细胞表面的机械感受器可调控血流响应的基因表达,但真实模拟分析体内心脏发育的力学环境仍比较困难,近年来心脏生物工程及体内成像技术的发展可能有助于进一步阐明复合力学刺激对胚胎心脏发育的影响。总之,结合遗传因素和力学刺激等非遗传因素深入研究CHD的病因及其发病机制,能为CHD的临床防治工作提供更为坚实的理论基础。

