增强CT 淋巴结短径及SCC-Ag在术前预测宫颈鳞癌淋巴结转移中的应用
秦 琳 吴玉梅 王 明 魏佳慧
首都医科大学附属北京妇产医院 北京妇幼保健院妇瘤科,北京 100006
宫颈癌发病位居中国女性生殖系统恶性肿瘤之首,近年来,其发病率及病死率均有上升趋势,调查数据显示[1],宫颈癌在全球女性癌症发病中居于第四位,同时也是发展中国家一个重要的卫生问题,发展中国家的发病率和死亡率分别是发达国家的1.7 倍与2.4倍,严重危害女性生殖健康。目前公认宫颈癌淋巴结转移(lymph node metastasis,LNM)是宫颈癌患者预后的独立危险因素[2]。合并LNM 患者的早期远处转移、手术难度、手术后复发及生存结局方面均差于无淋巴结转移者[3]。因此,初诊时准确预测淋巴结转移对于确定临床治疗方案有着重要意义[4]。依据病理类型,宫颈癌可分为鳞状细胞癌、腺癌、腺鳞癌等[5],其中鳞癌约占83.3%[6],鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)是鳞状细胞癌产生的一种特异性抗原。本研究探讨宫颈鳞癌患者LNM 的危险因素,旨在为完善临床相关诊疗提供参考依据。
1 资料与方法
1.1 一般资料
2019 年10 月至2020 年12 月于首都医科大学附属北京妇产医院就诊行宫颈癌根治术及盆腔淋巴结清扫术的宫颈鳞癌患者189 例,按照2018 年国际妇产科联盟(international fedration of gynecology and obstetrics,FIGO)分期标准[7-9],术前分期为ⅠA1~ⅢCr期,其中术前临床分期为ⅠA1~ⅡA2期者行广泛子宫切除+盆腹腔淋巴结清扫术;术前临床分期为ⅢC1r和ⅢC2r者,手术方式为淋巴结清扫±双侧附件切除术,未行广泛子宫切除术,术后接受根治性放疗。患者年龄29~64 岁。入选标准:①组织病理证实为原发性宫颈鳞状细胞癌,且为初始治疗;②行淋巴结清扫术;③术前均行盆腹腔增强CT 检查及血清肿瘤标志物SCC-Ag检查;④临床病理资料完整。排除标准:①合并其他恶性肿瘤或者既往接受过放化疗;②术前行新辅助化疗或者放疗。189 例患者根据术后病理检查结果是否有盆腔淋巴结转移,分为转移组30 例和未转移组159 例。
1.2 研究方法
1.2.1 盆腹腔增强CT 检查 采用GE Optima CT660扫描机,术前进行增强CT 扫描,行检查前取仰卧位,80 ml 碘海醇以3 ml/s 从肘静脉注射,层距、层厚均为5 mm,扫描范围:耻骨联合下缘至膈顶,测量腹主动脉旁及双侧盆腔部位淋巴结的横轴位最短径。
1.2.2 临床资料收集 患者年龄、是否存在人乳头瘤病毒(human papilloma virus,HPV)病毒感染、肿瘤最大径线、临床分期、细胞分化程度、术前SCC-Ag 值、盆腹腔增强CT 淋巴结短径。本研究根据2018 年FIGO 宫颈癌新分期标准作为参考。
1.3 统计学方法
采用SPSS 23.0 软件进行统计分析,计数资料采用百分率表示,组间比较采用χ2检验或Fisher 精确检验;不服从正态分布的计量资料,数据采用中位数和四分位数表示,应用Mann-Whitney U 检验统计学方法进行两组比较。多因素分析采用logistic 回归分析。以P <0.05 为差异有统计学意义。使用受试者工作特征(receive operating characteristic,ROC)曲线,得出曲线下面积(area under the curve,AUC)(AUC<0.5无价值,0.5≤AUC<0.7 预测价值较低,0.7≤AUC<0.9预测价值中等,AUC≥0.9 预测价值高),分析术前SCC-Ag 水平及增强CT 淋巴结短径对宫颈鳞癌淋巴结转移的预测价值,根据约登指数确定最佳截断值。
2 结果
2.1 两组一般资料比较
ⅠA1~ⅢCr期宫颈鳞癌初始治疗为手术的患者189 例,进行临床资料分析,两组肿瘤最大径线、临床分期、细胞分化、术前血清SCC-Ag及增强CT 淋巴结短径比较差异有统计学意义(P <0.001),年龄及HPV 感染比较差异无统计学意义(P >0.05)。见表1。

表1 两组一般资料比较
2.2 宫颈鳞癌患者盆腔LNM 的多因素分析
将肿瘤最大径线(X1:<2=0,2~<4=1,≥4=2)、临床分期(X2:ⅠA1~ⅠA2期=0,ⅠB1~ⅠB3期=1,ⅡA1~ⅡA2期=2,ⅢC1r~ⅢC2r期=3)、细胞分化(X3:G1=0,G2=1,G3=2)、术前SCC-Ag 值(X4:<1.88=0,≥1.88=1)、增强CT 淋巴结短径(X5:<0.625=0,≥0.625=1)作为自变量,是否发生LNM 作为因变量(否=0,是=1),进行logistic 回归分析。结果显示,术前SCC-Ag 值≥1.88 ng/ml及增强CT 淋巴结短径≥0.625 cm 均是宫颈鳞癌患者发生LNM 的危险因素(P <0.05)。见表2。
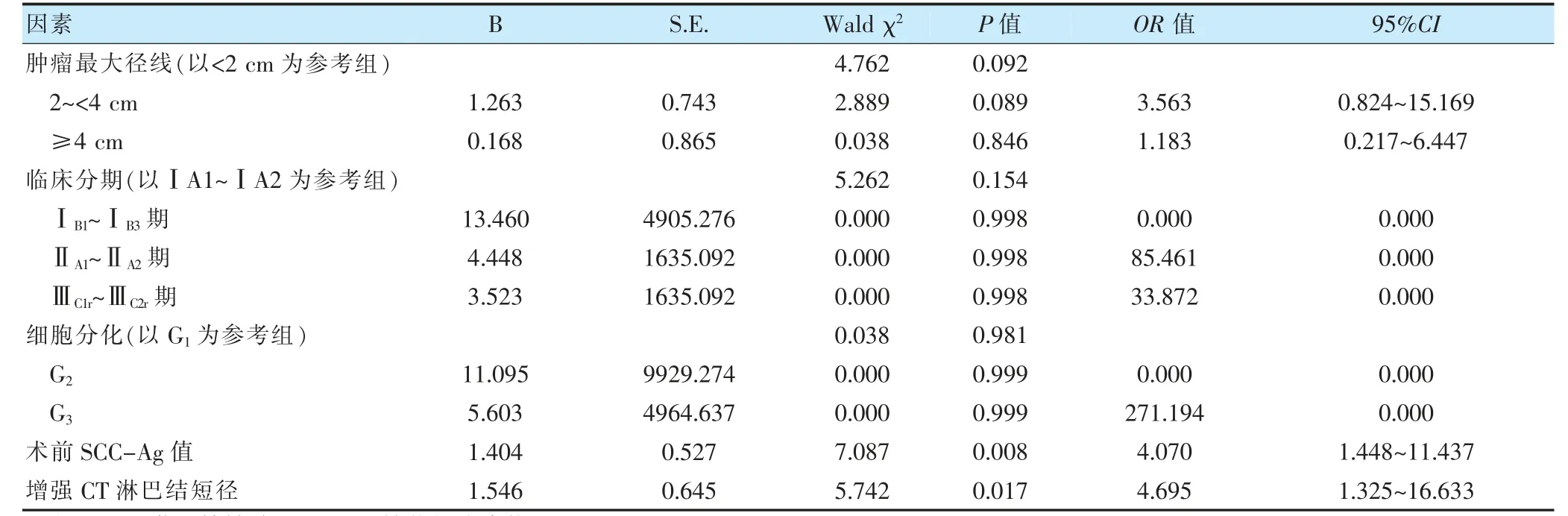
表2 宫颈鳞癌患者盆腔LNM 多因素分析结果
2.3 术前SCC-Ag及盆腹腔增强CT 淋巴结短径预测宫颈鳞癌患者LNM 的ROC 曲线分析
使用ROC 曲线分析189 例宫颈鳞癌患者术前SCC-Ag、增强CT 淋巴结短径及两者联合检测对宫颈鳞癌LNM 的预测价值(图1)。AUC 分别为0.733(P <0.001,95%CI:0.648~0.818)、0.827(P <0.001,95%CI:0.753~0.900)、0.802(P <0.001,95%CI:0.722~0.883)。两者联合检验:敏感度66.7%,特异度84.3%。见表3。
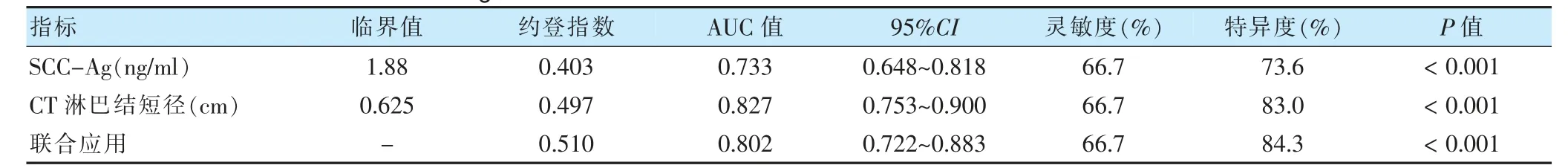
表3 术前SCC-Ag、盆腹腔增强CT 淋巴结短径单独及联合应用诊断预测宫颈鳞癌LNM 的价值

图1 术前SCC-Ag、盆腹腔增强CT 淋巴结短径及两者联合预测宫颈鳞癌患者LNM 的ROC 曲线分析
3 讨论
宫颈癌是女性生殖系统最为常见之恶性肿瘤,发展中国家宫颈癌死亡病例占全球的83%,故宫颈癌的防治是全球关注的公共卫生问题[10-11]。欧洲妇科肿瘤学会、欧洲放射肿瘤学学会及欧洲病理学会共同就宫颈癌的分期、病理及随访制订了临床及循证医学指南[12]。2018 年FIGO 分期首次将淋巴结转移纳入分期,影像学提示盆腔淋巴结转移为ⅢC1r,腹主动脉旁淋巴结转移为ⅢC2r。术后病理证实盆腔淋巴结转移为ⅢC1p,腹主动脉旁淋巴结转移为ⅢC2p。手术行淋巴结清扫的主要目的在于判断预后及是否需要补充放化疗[2],如术前影像学提示存在淋巴结转移,后又行宫颈癌根治术,使患者经受手术及放化疗双重打击,并未改善预后,同时淋巴水肿等并发症[13]增加,现2018 年FIGO 指南建议,如术前影像学提示淋巴结转移,建议全程放化疗为首选治疗[14-15]。故治疗前准确评估并预测宫颈癌淋巴结转移对于临床决策有着举足轻重的作用。宫颈癌盆腔LNM 是影响患者预后的独立风险因素之一[16],LNM 者的5 年生存率显著降低。所以,寻找LNM的特点对于治疗方案的选择至关重要。
宫颈癌LNM 影像学诊断有CT、MRI及PET-CT[17],准确诊断与医师的水平及经验也有很大关系[18]。MRI对软组织有很好的分辨能力,故在宫旁浸润、深肌层受侵诊断上优于CT,但其在评价LNM 上不如CT 检查。PET/CT[19]虽能较好地显示病变组织的代谢差异,但因其费用高,故在大多数医院中并未普及开展。本研究选择的研究对象为2020 年就诊患者,在此时间段,影像科医师对于术前盆腹腔增强CT 判断淋巴结转移状态有了一定的经验,故增强CT 影像学关于淋巴结短径值的测量可信度更高。Teymoortash 等[20]研究显示,CT 在淋巴结转移诊断上优于其他影像学诊断。CT及MRI 诊断淋巴结转移的标准是根据淋巴结的大小,目前临床上转移的标准是淋巴结短轴直径>1 cm[21],边缘不规整及中心性坏死亦可协助诊断,但增大的淋巴结也可为感染或者炎性增大。以此为标准,研究显示,MRI 诊断淋巴结转移的准确率为24%~73%[22]。PET-CT 诊断的标准是根据代谢的高低,PET-CT 对腹膜后淋巴结转移的敏感性、特异性、假阴性和假阳性率分别为53%、75%、6%和82%[23]。本研究结果显示,盆腹腔增强CT 横轴位淋巴结短径预测宫颈鳞癌LNM 的最佳截断值是0.625cm,此时敏感度为66.7%,特异度为83%,提示盆腹腔增强CT 淋巴结短径值对于治疗前宫颈鳞癌LNM 评估预测价值尚可,如术前增强CT 淋巴结短径值>0.625 cm,需考虑有盆腹腔LNM 移可能,可暂不考虑根治性手术治疗,而采用全程放化疗治疗。
SCC-Ag 是鳞状细胞癌产生的一种特异性抗原[24],是一种丝氨酸蛋白酶抑制物,为宫颈鳞癌最常用的肿瘤标志物[25],且其操作简单、方便、快速,不受医师个人经验等因素影响。Guo 等[26]研究显示,术前SCC-Ag值预测宫颈鳞癌患者预后,即无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)的最佳界值为2.75 ng/ml,即当术前SCC-Ag≥2.75 ng/ml 时,此患者的PFS 和OS 明显差于SCC-Ag 值<2.75 ng/ml者。XU 等[27]研究显示,SCC-Ag 反映宫颈癌LNM 的最佳界值为2.32 ng/ml。李丹等[28]研究显示,SCC-Ag 值预测宫颈癌LNM 的最佳截断值是2.65 ng/ml。本例研究通过绘制术前SCC-Ag 值预测宫颈鳞癌LNM的ROC 曲线,结果提示术前SCC-Ag 预测宫颈鳞癌LNM 的最佳截断值是1.88 ng/ml,此时对应的敏感度为66.7%,特异度为73.6%,即术前SCC-Ag 对于宫颈鳞癌LNM 评估具有中等诊断效能价值。
综上所述,盆腹腔增强CT 淋巴结短径、术前SCC-Ag及两者联合检测对于宫颈鳞癌LNM 患者均有预测价值,可用于宫颈鳞癌LNM 的预测,值得临床推广。同时本研究发现,术前血清SCC-Ag 联合盆腹腔增强CT 淋巴结短径检测效能低于后者单独检测,但高于前者单独检测。术前血清SCC-Ag>1.88 ng/ml及增强CT 淋巴结短径值>0.625 cm 时,宫颈鳞癌LNM可能性大,可考虑全程放化疗,不行根治性手术治疗。本研究的不足之处在于本研究为单中心、回顾性研究,样本量不够大,下一步需多中心、前瞻性、大样本量进一步验证结果。

