结合局部对比阈值与光晕移除的亮场细胞图像分割方法*
伏金浩, 王剑平, 闻路红, 洪欢欢, 史振志
(1.昆明理工大学 信息工程与自动化学院,云南 昆明 650500;2.宁波大学 高等技术研究院,浙江 宁波 315211)
0 引 言
细胞图像的准确、自动分割在生物学研究[1]和医学应用[2]中发挥着极其重要的作用。生物学家采用不同类型的显微镜进行细胞图像采集,其中荧光显微镜和亮场显微镜是最常用的两种技术。针对荧光细胞图像,分割较为容易[3],然而采集首先需要对细胞进行染色,会对细胞活性有一定影响,造成细胞死亡;另一个出现的问题是细胞偶尔会在一系列图像帧中消失和重新出现,这可能导致对细胞行为的错误跟踪[4]。亮场显微镜能够观测不经染色的活细胞,提供清晰的细胞图像,但采集的图像会出现对比度低、光照不均匀,细胞边缘存在光晕、伪影等影响。常用的基于活动轮廓的方法,如水平集算法,可以精确分割出荧光细胞,对于亮场图像只能捕捉到细胞边缘的光晕部分[5]。
针对亮场细胞图像分割,Tse T等人[6]提出一种结合分水岭和水平集的方法,但只适用于分割只含单个细胞的图像;Yin Z等人[7]对亮场显微镜进行成像建模,通过建立约束函数用于消除光圈、伪影,然后对恢复后的图像进行阈值分割,可以获得高质量的分割效果图像,但其建模过程复杂,且容易造成有丝分裂细胞丢失;Kang S M等人[8]提出基于图割与巴氏距离的算法,实现对亮场图像中多个细胞的定位,分割出整个图像帧,算法无法分割成簇的聚类细胞;Chen Y等人[9]提出一种稳健的基于主成分追踪与谱聚类的模型,能够有效分割出亮场图像中的细胞,然而会出现过分割现象,也无法实现粘连细胞的分割。
针对上述问题,本文提出一种结合局部对比阈值与光晕移除的方法,实现亮场细胞图像的自动分割,实验结果表明本文算法的有效性。
1 算法介绍
1.1 局部对比阈值
1.1.1 细胞区域检测
采集获取亮场细胞图像,进行灰度变换得到图像I(x,y)。由于图像中细胞与背景对比度较低、像素存在重叠,通过计算局部对比度以检测图像中含有细胞的区域,局部对比度C定义为图像I在滤波窗口内的标准差除以同一窗口内的平均值[10]
(1)
式中 *为卷积运算,G为采用高斯滤波器,将图像中的像素点用本身和邻域内的其他像素值加权平均后替换完成平滑滤波处理,对服从正态分布的噪声有较好的去噪效果[11],二维高斯函数为
(2)
式中 参数σ为高斯分布的标准方差,决定高斯函数的宽度。
1.1.2 阈值分割
设阈值为ε,当C(x,y)>ε的像素点(x,y),将其划分为细胞区域,否则为背景区域,阈值分割得到的图像J(x,y)为

(3)
1.2 光晕移除
由于亮场显微镜成像原理导致获取的图像中细胞边缘会存在光晕、伪影的影响,干扰细胞的形态分析。而基于局部对比阈值的方法倾向于将光晕归类为细胞区域,因此,需要进行光晕移除。
算法实现步骤如下:
1)提取阈值分割的细胞边界,建立边界像素点集合;
2)采用Kirsch算子[12]八个卷积核模板计算像素强度梯度;
3)梯度迭代,在图1(a)所示的亮场细胞图像中,沿点A向B移动,线段AB的灰度分布曲线如图1(b)所示,从光晕区域向细胞区域移动时,像素强度降低,初始边界逐渐收缩,当强度梯度变为负值时,即到达细胞的真实边界轮廓,迭代停止[13]。

图1 线段AB的灰度分布曲线
1.3 优化处理
1.3.1 形态学处理
形态学处理用具有一定形态的结构元素去度量和提取图像中对应的形状以达到对图像进行识别和分析的目的[14]。设二值图像为A,结构元素为B,形态学腐蚀变换E与膨胀变换D定义如下
E=AΘB={x,y|Bxy⊆A}
(4)
D=A⊕B={x,y|Bxy∩A≠∅}
(5)
结合二值形态学腐蚀与膨胀变换,对图像进行闭操作,能够填充细胞内部孔洞,连接邻近边界并平滑细胞边界轮廓。闭操作运算如下
A·B=(A⊕B)ΘB
(6)
1.3.2 移除小目标
在细胞培养过程中,培养皿及培养液会产生溶液杂质、组织碎屑,对细胞检测与分析造成一定影响,因此,需要去除小目标杂质。通过自定义面积阈值,移除小于该面积的小目标区域。
2 实验结果与分析
为验证算法的分割效果,实验采用C2C12(小鼠成肌细胞)数据集,图像分辨率为1 392像素×1 040像素,通过MATLAB R2014a编程实现。
根据算法实现流程,分割结果如图2所示。图2(a)为亮场细胞图像,设置参数σ为1.4,阈值ε为0.062,局部对比阈值分割结果图2(b)所示,能够检测并分割出含有细胞的区域;如图2(c)为最终分割结果,图2(d)为对分割后的细胞进行边界提取,通过对比可以看出,采用光晕移除与后处理操作,可以实现细胞边界优化,得到更准确的分割结果。

图2 亮场细胞图像分割结果
为了进一步分析本文分割方法的性能,通过Precision,Recall,Fscore三个指标进行定量评估。Precision表示图像的分割精度;Recall表示召回率,衡量真实细胞像素的查全率;Fscore反映算法的综合分割性能。各个指标的计算如下所示
Precision=TP/(TP+FP)
(7)
Recall=TP/(TP+FN)
(8)
Fscore=2×TP/(FP+TP)/(TP+FN)
(9)
式中TP为分割正确的细胞像素样本个数;FP为背景像素被误检为细胞像素的样本个数;FN为细胞像素被误检为背景像素的样本个数。
从表1可以得出,通过与文献[7],文献[15]的分割结果进行对比分析,本文提出的方法在Precision,Recall,Fscore三个指标均优于其他两种算法,表明本文所采用的方法具有更好的分割效果。
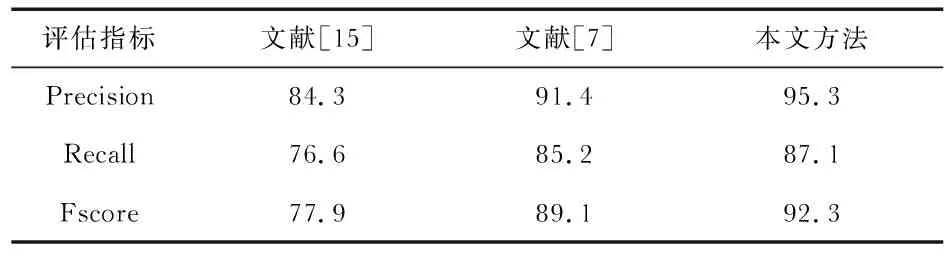
表1 算法分割结果对比 %
从图2可以看出,对于孤立的亮场细胞可以得到精确的分割,但针对粘连、聚类细胞,无法实现有效分割。通过提取粘连程度不同的细胞区域,寻找像素强度差异,设置新的局部对比阈值参数,分割结果如图3所示。

图3 粘连细胞分割
如图3(a1)对应于图2(a)三角形区域所示,图3(b1)对应于图2(a)椭圆区域所示,图3(c1)对应于图2(a)矩形区域所示。阈值分割结果如图3(a2),(b2),(c2)所示,最终分割结果如图3(a3),(b3),(c3)所示,对分割后的结果进行边界提取与细胞计数,如图3(a4),(b4),(c4),可以看出,采用本方法能够实现粘连细胞的有效分割,得到更精确的分割细节。
3 结 论
本文针对亮场细胞图像像素强度分布特征进行分析,提出一种结合局部对比阈值与光晕移除的分割方法。通过细胞与背景像素强度差异,实现图像的全局分割,再提取粘连程度不同的细胞区域进行局部分割,以获得更精细的分割结果。实验结果表明:应用本方法既可以解决亮场细胞图像对比度差、存在光晕伪影的分割难题,又能够实现粘连、聚类细胞的有效分割,为后续细胞形态分析与细胞追踪奠定良好的基础。

