千渭之会国家湿地公园典型植物底泥真菌群落结构及功能研究
魏 华, 杨 金, 成军锋, 刘丽莉, 曹 雪, 苏少峰, 王 璐, 王 猛
(1.宝鸡职业技术学院 医学院,陕西 宝鸡 721013;2.中铁水务集团有限公司, 陕西 西安 710061;3.宝鸡千渭之会湿地公园管理处,陕西 宝鸡 721004;4.西北农林科技大学 林学院,陕西 杨凌 712100; 5.中国中医科学院中药研究所 中药鉴定与安全性评估北京市重点实验室,北京 100700;6.东北师范大学地理科学学院 长白山地理过程与生态安全教育部重点实验室,吉林 长春 130024)
人工湿地是通过基质过滤、吸附、沉淀等实现污水净化的复杂生态系统,其中生物(植物和微生物)起着关键作用[1]。湿地生态系统中生长的不同植物既可以直接吸收污水中的氮磷等污染物,又能向根际分泌有机物及氧气,从而改变根际微生物群落结构和活性[2-3]。王娜等[4]研究发现,三江平原湿地不同土地利用方式明显改变了土壤细菌属的组成。有研究发现,在湿地中种植芦苇和香蒲的土壤与不种植任何植物的土壤相比,芦苇和香蒲根际土壤的碳源利用率增加,香蒲根际土壤的碳源利用率高于芦苇根际土壤,且种植芦苇和香蒲增加了根际土壤微生物群落的功能多样性[5]。高通量测序结果显示,种植植物的人工湿地相对于未种植植物的人工湿地来说,微生物丰度及多样性更高,同时具有脱氮除磷功能微生物的丰度更高[6]。真菌是土壤微生物的主要类群之一,可分解和利用土壤中的各种有机质,对于维持土壤生态稳定及生物多样性具有重要作用[7]。当土壤的物理化学性质、植被类型及气候等外界环境发生变化时,真菌群落结构和功能也会发生相应改变[8-9]。有研究表明,土壤条件和土地利用方式已成为土壤真菌群落多样性的重要驱动因素[10]。刘立玲等[11]研究认为土壤真菌能够有效改善土壤结构与质地,并参与土壤营养元素之间的生物化学循环。卯吉华等[12]研究发现接种丛枝菌根真菌能够显著促进幼苗株高、根系的生长和生物量的积累。因此,土壤真菌群落结构与功能的变化可作为衡量土地利用方式是否可行和生态环境健康的重要评价指标[13-14],其评价结果能够为受损土壤环境管理提供理论依据。季淮等[15]研究发现,人工植被类型土壤总有机碳含量显著高于自然植被类型,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)是土壤真菌的主要优势种群,人工植被类型未增加土壤微生物的多样性。有机碳含量和含水量是影响土壤微生物群落结构的主要因子。湿地土壤中的真菌在维持湿地生态系统的健康及碳、氮、硫等元素的物质循环中起重要作用[16-17]。真菌不仅可以加速动植物残体的分解[18],驱动营养物质的循环和转化[19],推动能量流动[20],同时也参与污染物降解和环境修复等过程[21]。真菌拥有强大的胞外酶系统,其有机质分解能力极强,是土壤有机质分解过程中的主要参与者[22]。陕西省千渭之会国家湿地公园(以下简称“千渭湿地”)是连通渭河与千河的生态廊道,是以河流湿地为主,集河流湿地、库塘湿地(王家崖水库)特征为一体的北方湿地公园,历经6年建设期,于2017年建成。千渭湿地对构建和恢复湿地环境,丰富生物多样性具有重要作用。因建成时间较短,国内外学者对千渭湿地的研究目前多集中于其植物和动物多样性方面[23],而对真菌群落结构多样性及功能研究鲜见报道。探讨千渭湿地土壤微生物群落结构变化规律,对研究湿地土壤变化特征,深入探讨湿地生态系统结构及功能,以及为湿地恢复和合理配置提供参考。
1 材料与方法
1.1 材料
1.1.1 研究区概况 千渭湿地位于陕西省宝鸡市东部千河与渭河交汇处(107°13′~107°20′E,34°19′~34°28′N),属大陆性季风气候类型,四季干湿分明。公园总面积1 864.0 hm2,其中湿地面积1 716.3 hm2,占总面积的92.1%。海拔540 ~ 615 m,相对高差50 ~75 m。年平均气温7.6 ~12.9 ℃,年日照1 860 ~2 250 h,年蒸发量1 300 ~1 800 mm。年平均相对湿度68%~72%,平均水面蒸发量约800 mm,气候偏干旱。区域植被主要以华山松为优势乔木;以忍冬、绣线菊为优势灌木;以芦苇(Phragmitesaustralis)、香蒲(Typhaovientalis)、白茅(Imperatacylindrica)、水葱(Fimbristylissubbispicata)、荷花(Nelumbonucifera)等组成优势水生及湿生植物[23]。
图1 研究样地图Fig.1 Map of the study areas
1.1.2 底泥样品采集 研究样地常年处于水淹状态,无干涸时段。以研究区域内不同水生环境中的底泥样品作为研究对象,于2020年7月采集分别处于中水环境(城市生活污水经处理后排入湿地,用于水生植物的种植)中水葱、香蒲、荷花和处于河水环境(植物生长的水来自于渭河)中白茅、香蒲、芦苇的底泥(水面下约40 cm)。另外,分别选取位于中水排放口无植物区、河水中无植物生长区、城市污水排放口无植物生长区的底泥样品。中水排放口无植物区、城市污水排放口无植物生长区的底泥样品分别距离出水口约100 m。每个地区选取3块底泥作为重复样本,各样本混合均匀。将所采集的底泥样品置于便携式保温冰盒送至实验室做后续处理。将采集的底泥样品,捡去石块、植物根系等去杂处理后,分成两份,一份置于-80 ℃冰箱用于后期DNA提取等分子生物学试验,另一份土样风干过筛后,用于理化性质的测定。
1.1.3 主要试剂与仪器设备 土壤DNA提取试剂盒(PowerSoilTMDNA Isolaton Kit,美国MOBIO公司);土壤酶活试剂盒(苏州科铭生物技术有限公司)。PCR扩增仪(Biomeki7 Automated Workstation,Beckman Coulter Inc.);凝胶成像仪(Smart GelTMimage analysis sustem,SAGE-CREATION);-80 ℃超低温冰箱(DW-86L228,青岛海尔股份有限公司);冰箱(HYC-326A,青岛海尔特种电器有限公司);全自动高压蒸汽灭菌锅(MLS-3020,日本SANYO公司);高速低温离心机(Allegra 64R,美国贝克曼库尔特有限公司);水平电泳槽及电泳仪(DYCP-31DN,北京六一仪器厂);超纯水机(MIlli-θ,美国Millipore公司);恒温磁力搅拌器(90-2,江苏省金坛市梅香仪器有限公司);电子分析天平(SPS202F,奥豪斯国际);制冰机(SIM-FI40AY65,日本SANYO)。
1.2 方法
1.2.1 土壤理化分析 对27份底泥样品进行理化性质测定,每个样品重复3次。土壤总有机碳含量采用重铬酸钾容量法测定[24];采用容量法测定土壤过氧化氢酶活性[25],采用3,5-二硝基水杨酸比色法测定土壤蔗糖酶[25],采用磷酸苯二钠比色法测定土壤磷酸酶活性[25],其他指标检测均采用土壤常规分析方法[26]。
1.2.2 样品DNA提取 使用土壤DNA提取试剂盒提取样品总DNA,采用琼脂糖凝胶电泳检测DNA的纯度和浓度,用无菌水稀释样本DNA至1 ng/μL。以稀释后的样本总DNA为模板,使用带Barcode的ITS5-1737F和ITS2-2043R引物扩增真菌ITS1区。用0.7%的琼脂糖凝胶电泳检测后,送至北京诺禾致源生物信息科技有限公司进行高通量测序。
1.2.3 文库构建和上机测序 使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库,将构建好的文库用Qubit和qPCR定量,达标后利用Illumina NovaSeq平台进行测序。
1.2.4 数据处理 利用FLASH、QIIME、MOTHUR等软件获得高质量序列,用Uparse软件以97%相似度划分OTU,同时对OTUs代表序列进行物种注释。计算Alpha多样性指数(ACE、香农指数),同时,进行冗余分析,分析影响群落组成的主要环境因子。选用FUNGuild软件对样本中的真菌群落进行功能预测分析[27]。
2 结果与分析
2.1 底泥样品土壤理化性质
通过对千渭湿地多点底泥土壤样品的理化性质分析发现,底泥蔗糖酶的活性在河水无植物区的空白处最大,排污口最小,且空白处大约是排污口的10倍之多,说明蔗糖酶在排污口与河水无植物区存在显著差异(P<0.05);在同样的河水环境中,不同植物底泥蔗糖酶活性之间存在显著差异(P<0.05)。在中水环境中,水葱、香蒲、荷花的底泥蔗糖酶活性,同样也存在显著差异(P<0.05)。研究发现,对于同一种植物香蒲来说,在中水及河水两种不同的环境中,后者香蒲蔗糖酶活性比前者高约2倍,底泥蔗糖酶活性同样也存在显著差异(P<0.05)。
过氧化氢酶活性在排污口的底泥样品中最高,在白茅中最小。总无机碳、总碳及总有机碳三者在河水香蒲底泥中的含量均为最高,在白茅底泥中含量最小,而且均存在显著差异(P<0.05)(表1)。

表1 千渭湿地不同采样点土壤理化性质Table 1 Physical and chemical properties of soil at sampling site at Qianwei wetland
2.2 底泥样品真菌群落结构分析
使用IIlumina NovaSeq测序平台测序,构建PCR-free文库,进行双末端测序。通过对Reads拼接,平均每个样品测得89 610条Tags,经过质控平均得到84 680条有效数据,质控有效的数据量达到78 864,质控有效率达87.88%。以97%相似度进行划分,共得到11 778个OTUs。其中,能够注释到数据库的OTUs数目为9 427(80.04%),注释到真菌界水平的比例为80.04%,在门、纲、目、科、属、种水平上的比例分别为27.54%、21.40%、20.89%、17.27%、15.23%和10.05%。
对测序序列进行随机抽样,以抽到的序列数与它们所能代表OTU的数目绘制稀释性曲线。曲线趋于平坦时,表明样品的测序数据量合理,反复多次取样,仅会出现少量新的OTU;反之,若继续测序会产生更多新的OTU。稀释性曲线既可以表明高通量测序结果是否合理,也可以反映被检测样品的取样深度,同时能够评价测序量是否足以覆盖土壤中所有的真菌类群。从图2可以看出,27个样品的稀释曲线随测序深度增加,OTU的数量增加曲线已基本趋于平缓,说明样品的OTU覆盖度已达到饱和,此时的测序数据量较为合理。

图2 千渭湿地不同采样点底泥样品的稀释曲线Fig.2 Rarefaction curves of sediment samples from different sites of Qianwei wetland
对于真菌群落进行基于Bray-Curtis距离的非度量多维尺度分析,检验真菌群落在不同采样点的差异,排序结果(图3)显示模型的应力函数值为0.158,小于0.2可认为排序效果良好,相同采样点出现明显的聚集,不同采样点表现出明显的分散,说明土壤真菌群落在不同采样点间有明显差异。

图3 不同样品土壤真菌NMDS分析图Fig.3 NMDS of fungal community structures in different samples
通过分析,发现芦苇和香蒲根系周围及河水无植物生长区底泥中真菌群落结构没有显著差异。底泥中真菌优势门丰度较高的有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、罗兹菌门(Rozellomycota)、毛霉门(Mucoromycota)、被孢霉门(Mortierellomycota)、Aphelidiomycota、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota),其中优势菌群为子囊菌门和担子菌门真菌。试验结果表明,河水无植物区底泥中子囊菌门真菌分布最高,相对丰度值为0.539 1,芦苇中子囊菌门真菌分布最低,相对丰度值为0.047。但在芦苇中担子菌门相对丰度值为0.058,略高于其他底泥样品,但不显著(图4)。

图4 真菌群落在门水平的相对丰度Fig.4 The relative abundance of fungal communities at phylum level
在纲水平上占优势地位的真菌类群为粪壳菌纲 (Sordariomycetes)、座囊菌纲(Dothideomycetes)、伞菌纲(Agaricomycetes)。其中在无植物区底泥中以粪壳菌纲分布最高,相对丰度值为0.491 8;芦苇中粪壳菌纲最低,相对丰度值为0.005 1。在目水平上的优势真菌类群为肉座菌目(Hypocreales)、粪壳菌目(Sordariales)、格孢腔菌目(Pleosporales)。在科水平上的优势物种为丛赤壳科(Nectriaceae)、毛球壳科(Lasiosphaeriaceae)、巨座壳科(Magnaporthaceae)。在属水平上的优势物种为镰孢菌属(Fusarium)、Cercophora、Kohlmeyeriopsis;优势种为尖孢镰孢菌(Fusariumoxysporum)、Cercophora_coprophila及Kohlmeyeriopsis_medullaris。
2.3 底泥样品真菌群落α多样性分析
在河水中,香蒲和白茅的底泥样品分别与无植物区底泥样品的真菌ACE指数之间存在显著差异(P<0.05)。ACE数值越大,说明底泥样品中真菌群落丰度越高,表明种植香蒲和白茅的底泥样品中的真菌群落丰度要显著高于无植物区底泥样品,但香蒲与白茅底泥样品之间的真菌群落丰度没有显著差异。白茅底泥样品与排污口底泥样品之间的真菌群落结构丰度存在极显著差异(P<0.01),且白茅底泥样品真菌群落结构丰度显著大于排污口底泥样品(图5),说明污水排放口的污水降低了真菌群落结构的丰度。

图5 ACE指数的组间差异Fig.5 Diagram of differences between groups in abundance-based coverage estimators (ACE)*表示在0.05水平上差异显著,**表示在0.01水平上差异显著,下同* and ** indicating significant differences at 0.05 and 0.01 levels respectively,same below
在中水中,水葱、香蒲及荷花底泥样品之间真菌群落结构丰度无显著差异(P>0.05)。中水荷花与河水无植物区,两底泥样品中的真菌群落结构存在显著差异,且中水荷花底泥样品的真菌丰度显著大于河水无植物区底泥样品(P<0.05)。在河水与中水中,种植的同一种植物香蒲,其真菌丰度无显著差异(P>0.05)。
通过对不同样本间真菌物种多样性和均一性的分析,发现在河水环境中白茅与芦苇的底泥样品的真菌群落多样性之间存在极显著差异(P<0.01),芦苇底泥样品与河水无植物区底泥样品真菌群落多样性之间也存在极显著差异(P<0.01),且芦苇底泥的真菌群落多样性最少。在中水环境中,各植物底泥样品的真菌群落多样性之间无显著差异,与中水口底泥样品之间也均无显著差异(P>0.05);对河水与中水两种不同生活环境中的植物底泥样品而言,仅白茅与芦苇的底泥样品中真菌群落多样性之间存在极显著差异(P<0.01),而在其他植物之间均无显著差异(P>0.05)(图6)。

图6 Shannon指数的组间差异Fig.6 Diagram of differences between groups in Shannon index
2.4 底泥样品真菌群落与环境相关性
相关性分析可以用来反映群落与环境因子之间的关系。从图7的RDA分析可以看出,横纵坐标分别为第一和第二主成分,百分比表示主成分对样品差异的解释率。图中的每个点表示一个样品,同一个组的样品使用同一种颜色表示。用箭头表示环境因子,其长度代表某个环境因子与群落分布之间相关程度,箭头越长,说明相关性越大,箭头越短相关性越小。箭头连线和排序轴的夹角表示某个环境因子与排序轴的相关性大小,夹角越小相关性越高。环境因子之间的夹角为锐角时,表明两个环境因子之间呈正相关关系,钝角时呈负相关关系。试验所测的6个土壤理化因子包括蔗糖酶、磷酸酶、过氧化氢酶、有机质、总碳、无机碳。由图7可知,RDA1轴(横轴)主要与蔗糖酶、磷酸酶以及过氧化氢酶有关;RDA2轴(纵轴)与总碳、有机质有显著关系;第1排序轴(RDA1)对真菌群落贡献率最大,达到45.77%;第2排序轴(RDA2)仅贡献了真菌群落的23.75%。RDA1和RDA2这两个主成分对真菌群落贡献率为69.52%(图7)。

图7 真菌门水平的群落组成与环境因子之间的冗余分析Fig.7 Redundancy analysis (RDA) of fungal community composition at fungal phylum level and environmental parameters
通过将真菌门分类水平上的丰度与环境因子间的相关性分析,明确环境因子与土壤真菌群落间的关系(图8)。在试验调查样地,子囊菌门与蔗糖酶、磷酸酶呈显著正相关(P<0.05);担子菌门与总碳、总有机碳呈极显著正相关(P<0.01),与蔗糖酶显著正相关(P<0.05);罗兹菌门与蔗糖酶、过氧化氢酶呈负相关但不显著(P>0.05)。丰度较小的Aphelidimocota与总有机碳呈显著负相关(P<0.05);总碳、总有机碳与Zoopagomycota、Olpidiomycota呈极显著正相关(P<0.01),而与Blastocladiomycota呈极显著负相关(P<0.01)(图8)。

图8 真菌门水平的相对丰度与环境因子之间的相关性分析Fig.8 Correlation analysis between relative abundance of fungal phyla and environmental parameters
2.5 底泥样品真菌FunGuild功能预测
基于ITS的扩增子分析,可以获得环境中的真菌物种信息,可了解其在环境生态中扮演的角色。FunGuild能够基于真菌物种分类,相应获得真菌的生态功能。以真菌物种分类为基础,通过FunGuild数据库对比,预测千渭湿地底泥样品真菌群落的营养型。如图9所示,千渭湿地底泥真菌群落主要包括3类营养型和6类复合营养型功能菌群,分别是共生营养型(Symbiotroph)、病理营养型(Pathotroph)、腐生营养型(Saprotroph)、病原-腐生-共生营养型(Pathogen-saprotroph-symbiotroph)、病理-腐生营养型(Pathotroph-saprotroph)、病理-共生营养型(Pathotroph-symbiotroph)、病理-腐生-共生营养型(Pathogen-saprotroph-symbiotroph)、腐生-共生营养型(Saprotroph-symbiotroph)及腐生-病理-共生营养型(Saprotroph-pathotroph-symbiotroph),其余的是未定义的营养型,其中以病理-腐生营养型和腐生营养型为主。在河水的无植物区,经过比对的病理-腐生营养型、腐生营养型、病理营养型三者之和在所有的样本中最高,可以达到50%以上,而其他样本的营养型占比均较低。在所有样本中,对植物有害的病理营养型平均相对丰度较低,均小于10%。
在中水荷花中,腐生营养型和病理-腐生-共生营养型真菌丰度显著高于其他组(图9),芦苇中的共生营养型真菌显著高于其他组。在河水中,病理营养型、病原-腐生-共生营养型、病理-腐生-共生营养型真菌丰度显著高于其他组。在排污口泥中,病理-共生营养型真菌为主要营养型。
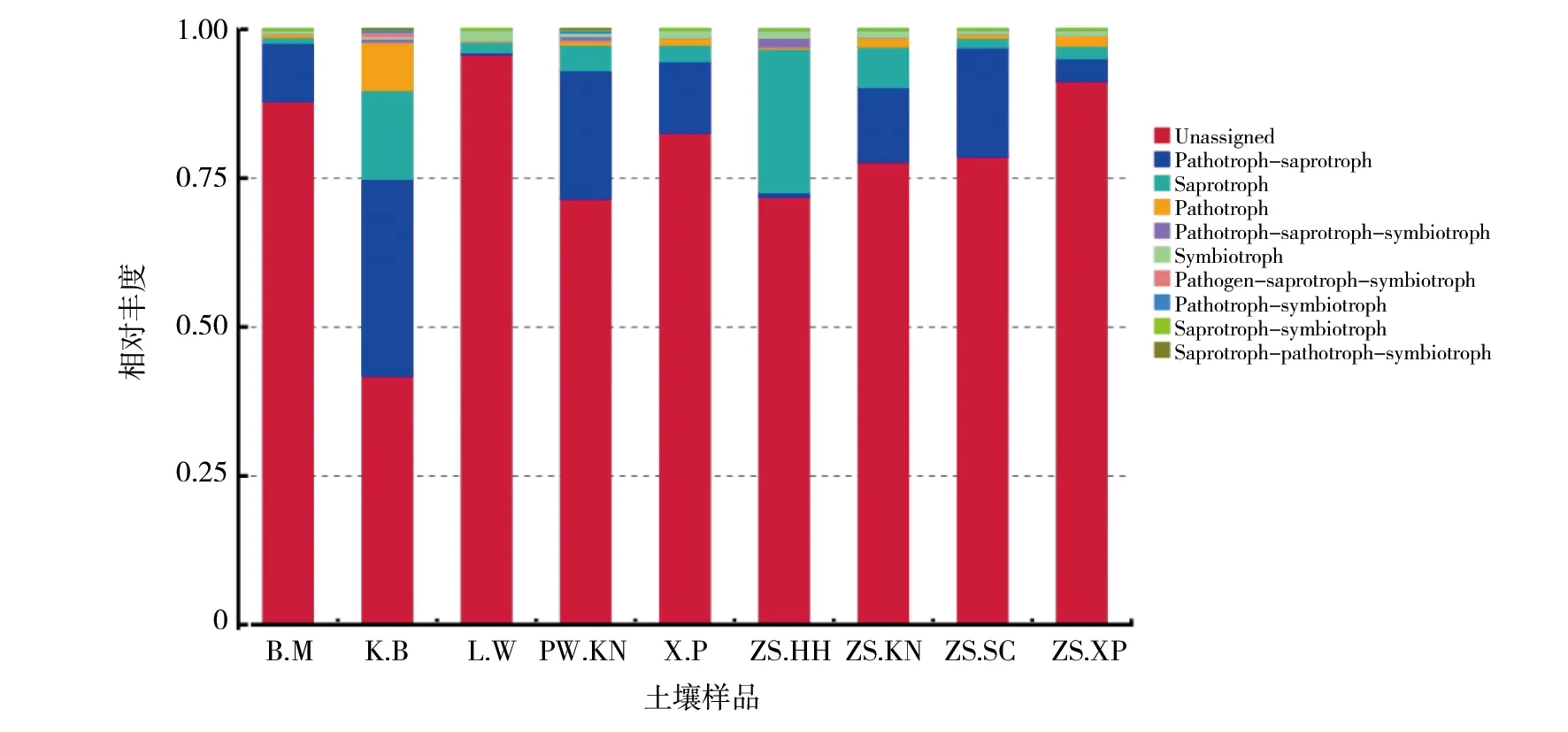
图9 基于FunGuild预测的功能相对丰度Fig.9 The relative abundance of predicted functions based on FunGuild
对各样品进行详细的物种生态功能预测,其分类结果见聚类热图(图10)。从图10可以看出,中水荷花与排污口底泥真菌群落组成最先聚为一类,说明两组之间土壤真菌的功能菌群结构相似度最高。河水无植物区底泥真菌群落组成最后与其他组聚为一个大类,说明河水无植物区底泥真菌的功能菌群结构与其他组存在较大差异。

图10 FunGuild功能预测聚类热图Fig.10 Cluster heatmap of predicted function based on FunGuild
3 讨 论
3.1 真菌群落结构及多样性
本研究通过IIlumina NovaSeq测序平台对千渭湿地中芦苇、香蒲、白茅、水葱、荷花、中水排放口、污水排放口、河水、湿地无植物区的底泥真菌ITS1区进行了测序。结果发现,所测样品真菌在门水平上的丰度及多样性均较低。可能原因有两方面,一方面与采样季节有关,夏季植物生长旺盛,而秋季落叶使水中和底泥中的营养丰富。杨雪[28]研究发现,7月在湿地检测出的真菌类群数量较少,显著低于10月份,本研究的取样时间在夏季,检测出的真菌群落结果与杨雪报道相一致;另一方面,与采样地是否淹水或干涸有关。陆梅等[29]研究发现,湿地积水条件变化和干湿季节变化均使湿地土壤真菌丰度和多样性存在差异。同时,积水状态和干湿交替导致的理化性质变化也是影响真菌群落多样性和结构的重要因素。李海云等[30]发现,土壤淹水会改变土壤透气性,引起土壤厌氧/好氧状态发生变化,进而影响真菌的生存。本研究所采集的标本为水面下40 cm处的植物底泥,处于厌氧状态,其含有的真菌丰度及多样性较低,可能是因为长期淹水导致土壤通气性差,氧气可利用度降低,不利于好气性真菌的生长繁殖。
本研究发现,千渭湿地芦苇底泥中担子菌门丰度最高,且不含毛霉门真菌,而其他样品中丰度最高的均为子囊菌门。子囊菌门与担子菌门,依然是千渭湿地的优势菌群。有研究报道,子囊菌门真菌在碱蓬湿地、秋茄湿地、桐花湿地、木榄湿地中均是优势度最高的物种[29,31],这与本研究的结果一致。在检测的各种底泥理化指标中,芦苇底泥各指标的含量均较低,这可能说明芦苇的根系分泌物更适合担子菌门真菌的生长,不适合毛霉门真菌,其他植物根系分泌物更适合子囊菌门真菌的生长。
程跃扬等[32]认为,不同植物根际效应的差异会造成真菌群落丰度和多样性发生变化。植物能改变土壤条件和小气候等,从而对微生物活动产生间接影响。此外,植物根系与微生物之间有争夺土壤养分的竞争关系,这与本研究结果相一致。本研究结果表明,在千渭湿地,芦苇与其他植物底泥真菌的群落结构及丰度存在明显差异,显然与芦苇根系分泌物的化学组成等存在密切关系。植物种类不同,其根际土壤微生物群落结构和活性均存在差异,进一步验证植物类型影响土壤微生物群落的组成[33]。
千渭湿地因长期淹水,导致水面以上的枯枝落叶难以直接进入到土壤补充养分,这就使得底泥有机质含量相对较少,进而影响其中微生物的数量和活性。不同湿地类型对土壤微生物数量的影响存在差异,这与植物凋落物的种类和数量存在一定关系[34]。在千渭湿地,香蒲、白茅及荷花三种植物底泥真菌群落的丰富度显著高于无植物区底泥样品中的真菌群落,表明在千渭湿地种植植物,尤其是种植香蒲、白茅和荷花三种植物可以提高底泥中真菌群落丰富度。排污口底泥的ACE指数比其他样品低,同时排污口底泥的香农指数也比其他样品低(除芦苇外),这与秦文韬等[35]关于污水处理系统内的真菌群落物种丰富度和多样性较低的研究结论相一致。由于芦苇底泥样品中真菌多样性低于其他植物的底泥,因此,在基于真菌多样性优化植物配置时,可以优先选择其他湿生植物。
3.2 真菌群落结构与环境因子之间的关系
有研究表明,土壤含水量、pH、硝态氮、有机碳、溶解氧、土壤质地等理化性质是影响真菌群落多样性和驱动真菌群落分布的重要因子[30,36-37]。在本研究中,千渭湿地排污口处底泥中过氧化氢酶活性较高,真菌多样性较低,可能因为过氧化氢酶过高不利于真菌的生长。其他采样点,因为有植物的存在,过氧化氢酶活性相对较低,可以初步推断植物可有效防止土壤中过氧化氢对真菌的毒害,起到保护土壤真菌多样性的目的。过氧化氢酶活性过高不适合真菌生长和繁殖,这也就能够解释在湿地公园中栽种植物的重要性和必要性。在芦苇湿地,底泥过氧化氢酶活性与有机质呈极显著正相关,表明土壤有机质既是底泥养分的重要来源和储藏场所,还是过氧化氢酶的来源和储藏地[38]。相比于其他样品,在芦苇湿地,底泥过氧化氢酶活性和有机质含量均处于中间位置,至于其与真菌群落结构和多样性是否有关还有待进一步研究。
张淑香等[39]研究发现,底泥含水量高可以抑制土壤有机碳的矿化,抑制土壤酶的分解作用。蔗糖酶是一种可以把土壤中的蔗糖分解为葡萄糖和果糖的水解酶。经蔗糖酶水解的小分子量的葡萄糖和果糖容易被植物和土壤真菌吸收利用,进而为土壤真菌生长和繁殖提供营养和能量。本研究检测发现,在排污口处底泥蔗糖酶活性最低,说明排污口处底泥肥力低,显然也说明排入湿地的城市污水经过处理后显著降低了污水中有机质等营养物质的积累。有机质既可以为土壤酶提供底物,还可以为微生物的生长提供碳源,因而,土壤有机质的含量对微生物的生长和酶活性均有影响[40]。
芦苇和白茅为多年生根茎禾草,繁殖能力强,对贫瘠、干旱及中轻度盐渍化土壤均有较强的适应性。二者分别为C3和C4植物[41],具有不同的光合作用途径,其根系分泌物存在差异,可能是二者底泥真菌群落结构和多样性差异的主要原因。
3.3 真菌群落结构和潜在功能
真菌是土壤微生物的重要组成部分,其中绝大多数营腐生生活。这些腐生真菌参与有机质分解,转化土壤腐殖质供给植物吸收[42]。土壤中也存在大量的植物病原菌,可引起根腐、茎腐和枝枯等病害[43]。真菌是重要的有机物分解者,在物质循环中起着重要作用[44]。相比其他类群的真菌,担子菌分解木质素和纤维素的能力更强[45]。镰孢菌属为土壤习居菌,有些种类是重要的植物病原菌,有些种类具有较强的生物转化能力,在环境污染有机物降解方面展现出较强的能力。白腐真菌在有机污染土壤的原位修复方面显示了优越的处理性能,例如,美国农业部利用白腐真菌使污染土壤中五氯苯酚减少了98%;Biotal公司采用白腐真菌对污染土壤进行处理后,PCBs的浓度下降了200倍[46]。有一些真菌类群为石油降解菌,在其自身代谢过程中可以利用土壤中的电子受体,将石油烃等污染物氧化降解,从而缓解石油对植物生长的毒害[47]。
在千渭湿地底泥土壤中的真菌以共生营养型、病理营养型、腐生营养型、病原-腐生-共生营养型、病理-腐生营养型、病理-共生营养型、病理-腐生-共生营养型、腐生-共生营养型及腐生-病理-共生营养型为主要功能营养型,与刘会会等[48]的研究结果一致,符合湿地生态系统的功能特点。FunGuild功能预测结果显示,真菌采取更为复杂的“生存策略”,在功能上采用多种兼有型的营养方式,聚焦于营养偏好,增加代谢功能多样性,以适应生存环境的变化。
千渭湿地长期处于水淹状态,枯落物的有机质分解缓慢,刺激腐生真菌大量生长,产生一系列的水解和氧化酶,从而完成有机质的分解[49]。河水的无植物区样本与病理营养型、病原-腐生-共生营养型、腐生-病理-共生营养型这几种营养型呈正相关,而其他采样区无明显关系。本研究发现,千渭湿地不同植物底泥真菌群落中病理-腐生营养型和腐生营养型相对丰度较高,占据主导优势,包括在排污口泥样本中,也以这两种营养型为主,其真菌群落结构、多样性及功能与其他样本没有显著差异。说明千渭湿地底泥真菌群落结构组成比较健康,排入千渭湿地的污水都经过了相应的物理、化学或生物学处理,达到排放标准。
此外,本研究所检测的千渭湿地所有底泥样本的营养类型结构高度相似。采用高通量测序并结合FunGuild功能预测,研究湿地土壤真菌群落结构和功能,所得结果与其他学者研究结果相一致[48]。有研究发现,内生真菌与寄主植物形成共生关系,植物可以为内生真菌的生长提供营养,内生真菌调节寄主体内植物激素水平,从而调节植物生长,帮助寄主植物抵御恶劣环境[50],从而淘汰抗性差的植物物种,保留下来的湿地植物对植物病原菌具有较高的抗性。这也说明,在湿地生态系统中,真菌功能类群不仅主要受水分条件的影响,湿地中的植被条件也对真菌功能类群产生一定的影响。
本研究对夏季千渭湿地土壤真菌群落结构以及土壤酶对其多样性的影响,以及其潜在功能差异进行了分析,以期为筛选人工湿地植物和有效利用湿地资源和生态修复提供参考。关于其他季节湿地土壤真菌的群落结构组成和多样性变化还有待于进一步研究。
致谢感谢宝鸡市千渭之会国家湿地公园管理处的大力支持与帮助。

