中性粒细胞与淋巴细胞比值和血小板计数与淋巴细胞比值与胆源性急性胰腺炎严重程度及并发肝损伤的相关性研究
廖国豪,程斌*,余红雨,熊上,徐丽,吴利东,张桦,杜航
急性胰腺炎(AP)时胰腺局部损伤,通过激活细胞因子级联导致全身炎性反应,其临床表现不尽相同,从无症状到全身炎症反应综合征(SIRS)、多器官功能衰竭甚至死亡。胆源性急性胰腺炎(BAP)是常见的AP 病因之一,其中急性肝损伤(ALI)是BAP 常见的并发症之一[1]。BAP 肝损伤的机制较复杂,从引发ALI 的源头疾病来讲,除胰腺炎疾病本身对肝脏造成的影响,胆管疾病亦可引发肝损伤。目前普遍认为BAP并发ALI 或胆源性胰腺炎肝损伤等类似名称均包括了AP 和胆管疾病引起的肝损伤[1-3]。BAP 肝损伤的发病机制为炎性反应、感染、胰酶损伤、胆汁淤积、氧化应激等[1-3]。因此,及时准确评估BAP 严重程度、尽早预测ALI 并积极治疗,避免胰腺炎重症化显得尤其重要。目前诊断ALI 的基础手段为肝功能实验室检测,但其价格相对昂贵且检测时间较长。炎性反应在引起胰腺炎重症化及并发ALI 中具有重要作用[1,4]。中性粒细胞与淋巴细胞比值(NLR)、血小板计数与淋巴细胞比值(PLR)作为炎性反应标志物,已被证实在预测肝损伤、胆管疾病严重程度中具有重要意义[5-6]。本研究拟探讨NLR、PLR 与BAP 严重程度及ALI 的相关性,以期为临床评估BAP 严重程度及预测ALI 提供简便的方法。
1 对象与方法
1.1 研究对象 选取2019 年3 月至2021 年3 月就诊于南昌大学第二附属医院急诊科的142 例BAP 患者。纳入标准:(1)AP 的诊断符合2012 年修订的亚特兰大定义[7],AP 的诊断符合以下3 项标准中的至少2 项:①急性、持续中上腹疼痛;②血清淀粉酶或脂肪酶>参考值上限的3 倍;③AP 的典型影像学改变。(2)经影像学(B 超、CT、MRI/MRCP)检查确定AP 的病因为胆源性。(3)病例有完整记录,无中途出院或不遵医嘱出院情况。(4)入院24 h 内(使用药物治疗前采集血液进行检测)完成所需实验室指标采集。排除标准:(1)存在慢性肝功能不全、肾功能不全、冠心病病史,或进行过肝移植、合并肝硬化、合并肝恶性肿瘤;(2)就诊7 d 内有相关可疑导致肝损伤行为:如服用肝脏毒性药物、大量饮酒等;(3)存在重大影响免疫力的疾病:如艾滋病、恶性肿瘤等。患者均已签署知情同意书,并经南昌大学第二附属医院伦理委员会审批(研临审2021 第87 号)。
1.2 分类 按照2012 年修订的亚特兰大分类和定义[7]:轻症急性胰腺炎(MAP):无局部或全身性并发症和器官衰竭;中度重症急性胰腺炎(MSAP):局部或全身性并发症、一过性器官衰竭(<48 h),或两者兼而有之;重症急性胰腺炎(SAP):局部或全身性并发症,以及持续性单器官或多器官衰竭(>48 h)。将患者分为MAP/MSAP 组(98 例)、SAP 组(44 例)。根据有无肝损伤,将患者分为ALI 组(92 例)和无ALI 组(50例)。ALI 目前无统一标准,参照陈军提出的肝损伤诊断标准[8]:丙氨酸氨基转移酶(ALT)和/或天冬氨酸氨基转移酶(AST)升高3×参考范围(ULN)或以上定义为肝细胞型肝损伤,碱性磷酸酶(ALP)或谷氨酰转肽酶(GGT)升高2×ULN 以上定义为胆管细胞型肝损伤,二者兼有称为混合型肝损伤,将ALI 组分为肝细胞型肝损伤亚组(1 例)和胆管细胞型肝损伤亚组(16 例)和混合型肝损伤亚组(75 例)。因肝细胞型肝损伤亚组仅有1 例患者,故以下有关研究并未纳入该组。
1.3 观察指标 收集患者一般人口学特征:性别、年龄、有无糖尿病及高血压;入院24 h 内肝功能指标(ALP、GGT、ALT、AST、白蛋白、总胆红素)、血液学参数〔白细胞计数、中性粒细胞、淋巴细胞、血小板计数(PLT)、NLR、PLR〕、血清电解质(Na+、K+、Cl-、Ca2+)、尿素氮、肌酐、D-二聚体。
1.4 统计学方法 采用SPSS 25.0 统计学软件进行数据分析,所有数据采用K-S 法进行正态检验,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t 检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验。计数资料的分析采用χ2检验或Fisher's 确切概率法。绘制NLR、PLR 及二者联合诊断SAP 及并发ALI 的受试者工作特征(ROC)曲线,并采用二元Logistic 回归分析探究NLR、PLR 对BAP 严重程度及并发ALI 的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况及临床资料 MAP/MSAP 组和SAP 组年龄、性别、糖尿病发生率、高血压发生率、ALP、GGT、ALT、AST、总胆红素、PLT、Na+、K+、Cl-、肌酐比较,差异均无统计学意义(P>0.05)。MAP/MSAP组白细胞计数、中性粒细胞、NLR、PLR、尿素氮、D-二聚体均低于SAP 组,白蛋白、淋巴细胞、Ca2+均高于SAP 组,差异有统计学意义(P<0.05),见表1。

表1 MAP/MSAP 组与SAP 组一般情况及临床资料比较Table 1 Comparison of general situation and clinical data of MAP/MSAP group and SAP group
ALI 组NLR、PLR 均高于无ALI 组,差异有统计学意义(P<0.05),见表2。
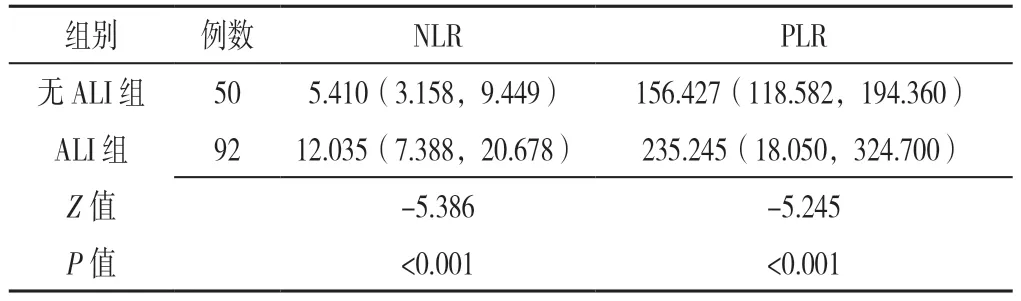
表2 ALI 组与无ALI 组NLR、PLR 比较〔M(P25,P75)〕Table 2 Comparison of NLR and PLR in liver injury group and non-liver injury group
胆管细胞型肝损伤亚组、混合型肝损伤亚组、无ALI 组NLR、PLR 比较,差异均有统计学意义(P<0.05);其中胆管细胞型肝损伤亚组、混合型肝损伤亚组NLR、PLR 比较,差异均无统计学意义(P>0.05),见表3。
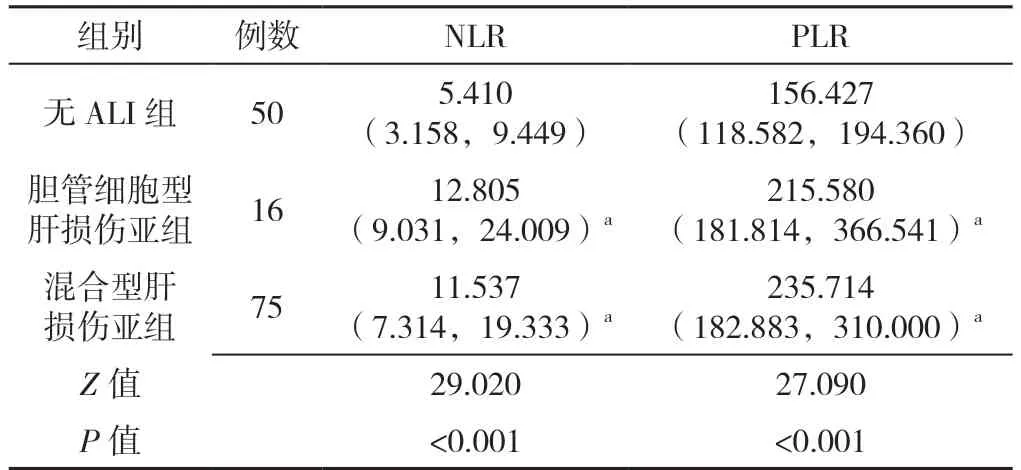
表3 各种类型肝损伤患者NLR、PLR 比较〔M(P25,P75)〕Table 3 Comparison of NLR and PLR in various types of liver injury
2.2 NLR 与PLR 对BAP 重症化及并发ALI 的诊断效能 绘制NLR、PLR 诊断SAP、ALI、胆管细胞型肝损伤、混合型肝损伤的ROC 曲线,见图1~4、表4。

表4 NLR 与PLR 及二者联合对SAP 及并发ALI 的诊断价值Table 4 The diagnostic value of NLR,PLR and their combination on SAP and concurrent ALI

图1 NLR、PLR 及二者联合诊断SAP 的ROC 曲线图Figure 1 ROC curves of NLR,PLR and their combined diagnosis of SAP
2.3 二元Logistic 回归分析 分别以是否发生SAP(赋值:是=1,否=0)、ALI(赋值:是=1,否=0)、胆管细胞型肝损伤(赋值:是=1,否=0)、混合型肝损伤(赋值:是=1,否=0)为因变量,以NLR、PLR 为自变量进行二元Logistic 回归分析,结果显示,NLR 升高是SAP 的危险因素(P<0.001);NLR 和PLR 升高是BAP 发生ALI 的危险因素(P<0.05);NLR 升高是BAP 发生胆管细胞型肝损伤的危险因素(P<0.05);NLR 和PLR 升高是BAP 发生混合型肝损伤的危险因素(P<0.05),见表5。
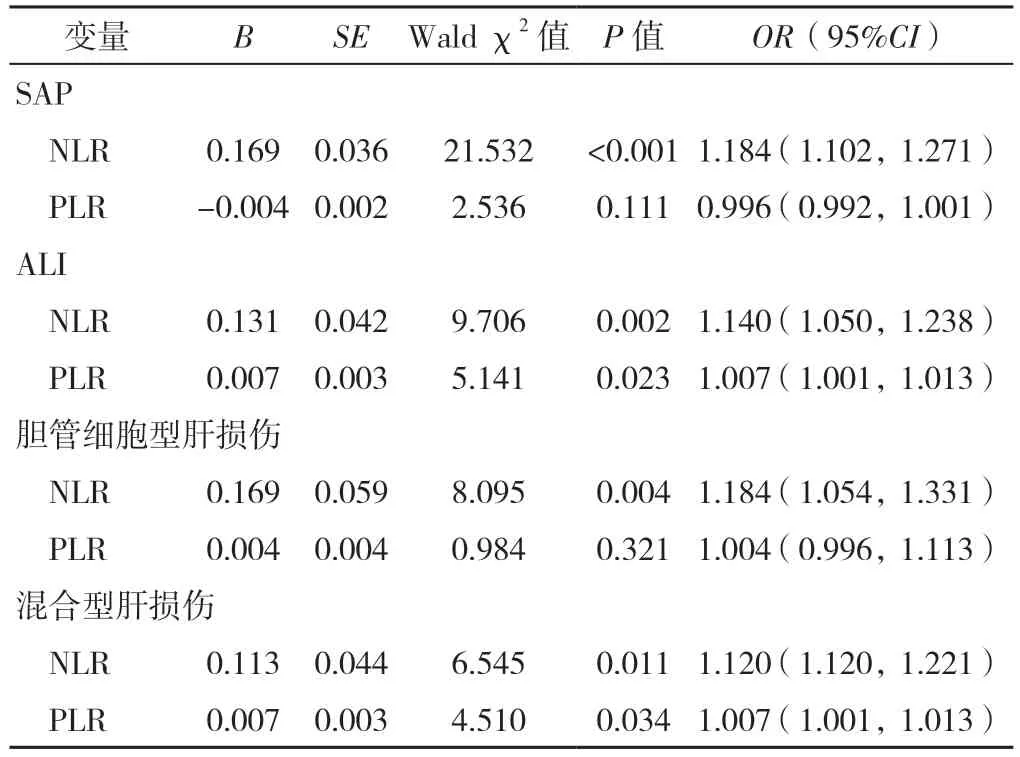
表5 NLR、PLR 预测SAP、ALI、胆管细胞型肝损伤和混合型肝损伤的二元Logistic 回归分析Table 5 Binary Logistic regression analysis of NLR,PLR predicting SAP,ALI,cholangiocytic liver injury and mixed liver injury
3 讨论
AP 是一种炎性疾病,可累及胰腺周围组织甚至远隔器官,病理生理机制以炎性反应、多器官功能障碍综合征(MODS)甚至死亡为特征。发生SAP 时,大量的炎性因子会经门静脉进入肝脏而导致肝脏受损。SAP 患者常并发肝脏损伤,而肝脏受到损伤后又会导致对胰源性致病因素的屏障作用受损,从而使病情加重,引起或加重SIRS 甚至发生MODS,因此对SAP 合并的ALI 应予以重视[1]。
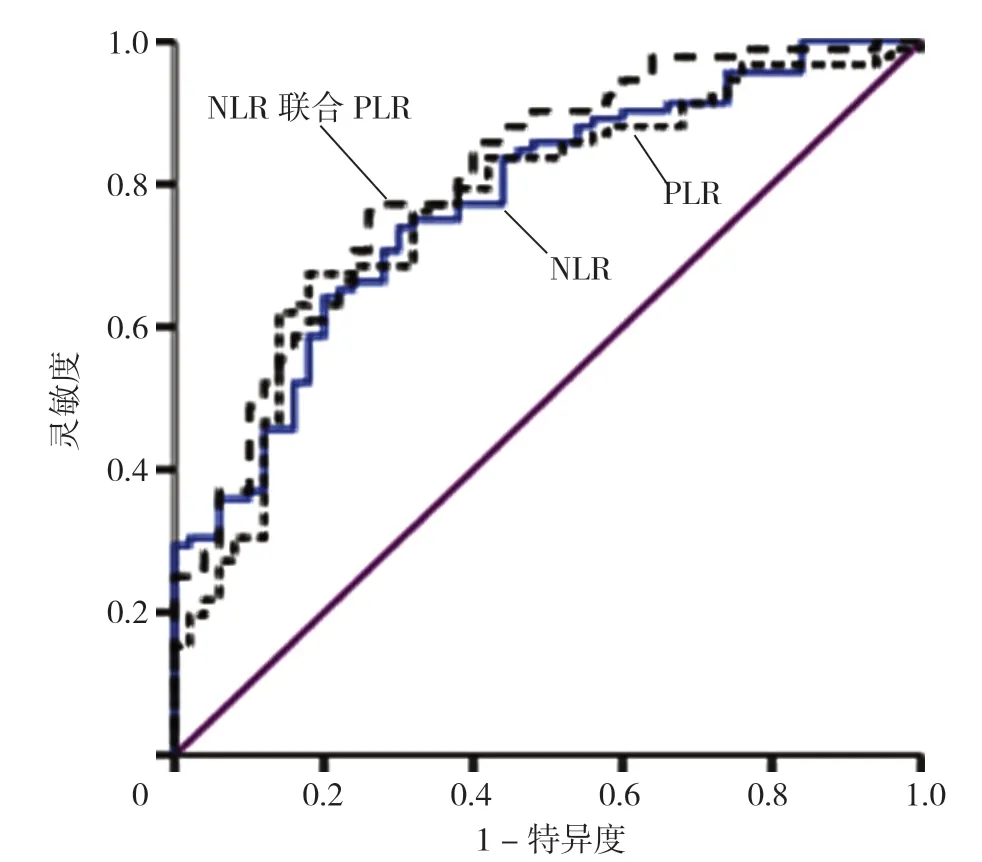
图2 NLR、PLR 及二者联合诊断BAP 并发ALI 的ROC 曲线图Figure 2 ROC curve of NLR,PLR and their combined diagnosis of BAP and concurrent liver injury
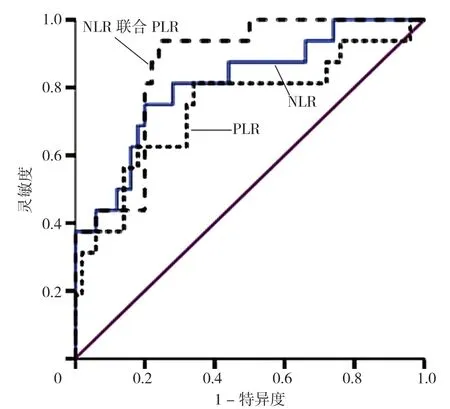
图3 NLR、PLR 及二者联合诊断BAP 并发胆管细胞型肝损伤的ROC曲线图Figure 3 ROC curve of NLR,PLR and their combined diagnosis of BAP and concurrent bile duct cell liver injury
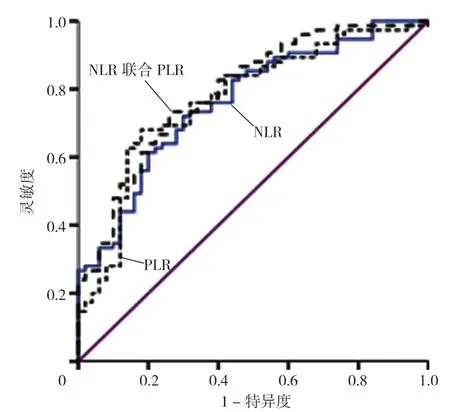
图4 NLR、PLR 及二者联合诊断BAP 并发混合型肝损伤的ROC 曲线图Figure 4 ROC curve of NLR,PLR and their combined diagnosis of BAP and concurrent mixed liver injury
NLR、PLR 作为全新的炎性反应标志物,在一定程度上反映了机体固有免疫与适应性免疫的现状[4,9]。一些炎性反应标志物,如CRP、PCT、NLR,已经证实可以作为预测AP 合并ALI 的指标[9]。本研究结果显示,MAP/MSAP 组PLR 与NLR 低于SAP 组,提示炎性反应越重,病情程度越重。ROC 曲线下面积提示NLR与PLR 对BAP 重症化有一定的诊断价值,与CHO 等[10]研究结果相符,但NLR 明显优于PLR,并计算出最佳阈值分别为10.49 与211.15。二元Logistic 回归分析亦显示NLR 升高是BAP 重症化的独立危险因素。
需要指出的是,PLR 预测BAP 重症化的灵敏度及特异度偏低,二元Logistic 回归分析显示PLR 并不能作为预测BAP 重症化的独立危险因素。AP 患者虽然淋巴细胞会减少[4],但PLT 数量不确定。AP 患者外周血PLT 随病理过程的严重程度呈现多向性特征,MAP 患者PLT 仍处于参考范围,SAP 患者PLT 随病程进展而逐渐增加,出院时PLT 仍较高。严重的弥漫性胰腺坏死的致命结果是在入院时PLT 减少,并有进一步的发展[11]。本研究结果显示,MAP/MSAP 组与SAP 组PLT无明显差异,虽然PLT 有助于调节炎性反应和免疫反应[12],但是不同于其他类型AP,BAP 早期出现的胆管感染会引起PLT 消耗或骨髓抑制[13]。另外,本研究发现MAP/MSAP 组与SAP 组ALT、AST 无明显差异,BAP 严重程度可能与肝转氨酶水平高低无明显相关[1-2]。
本研究结果显示,NLR、PLR 预测BAP 肝损伤有一定意义,与张琪等[14]和何彩霞等[15]研究结论相符。ALP 主要分布于毛细胆管,GGT 分布于全程胆管,当胆汁淤积等引起肝损伤时二者均会升高[8,16]。既往研究认为胆汁淤积时,通过自身能够溶解细胞膜的毒性,高浓度胆汁酸通过其毒性直接损伤肝细胞,但是通过体外实验及动物实验后推翻了该结论。目前认为胆汁引起肝损伤的机制为炎性反应,其介导相关炎性因子表达从而引起中性粒细胞等其他免疫细胞在肝脏组织浸润,水平明显增加,进而导致肝损伤;同时,胆管上皮细胞亦参与了肝损伤进程[17]。因此,本研究基于肝损伤分组,证实NLR、PLR 对诊断胆管细胞型肝损伤与混合细胞型肝损伤均有一定的诊断与预测价值,并计算出最佳诊断阈值。这也间接证实了BAP 肝损伤的发病机制虽然复杂,但炎性反应仍占据十分重要的作用。但是两者灵敏度及特异度较低,限制了其在早期预测中的价值。
综上所述,NLR、PLR 预测BAP 严重程度及并发ALI 均有一定的临床价值,但NLR 优于PLR,单一指标难以准确判断及预测,如多指标联合应用,可减少局限性,当肝功能等相关检查暂不明确时,其可供临床参考。本研究具有一定局限性,首先,观察指标被设定在入院24 h 内(使用药物治疗前采集血液进行检测),虽然能避免治疗对指标的影响,但没有动态分析住院期间NLR、PLR 和BAP 严重程度及肝功能变化的关系,因此无法推断两者之间长期关联。其次,本研究为回顾性、非随机和单中心研究,可能导致数据偏差。再次,部分临床资料不完整的病例没有加入研究,可能导致样本量少。为了进一步验证本研究结论,需要更多的大样本多中心研究。
作者贡献:廖国豪、程斌提出研究选题方向和总体研究目标,负责设计研究方案及确定研究方法;廖国豪、余红雨、熊上、徐丽、张桦、杜航进行数据收集;廖国豪负责数据进行统计学处理,并对结果进行分析与解释,绘制图表,撰写论文初稿;廖国豪、程斌、吴利东负责论文最终稿的质量控制及审校;程斌对论文整体负责,监督管理;所有作者确认了论文的最终稿。
本文无利益冲突。

