透明细胞肾细胞癌转移至中枢神经系统血管母细胞瘤1例并文献复习
冯 莎,田 军,黄文亭,4
中枢神经系统(central nervous system, CNS)血管母细胞瘤(hemangioblastoma, HB)属于罕见的良性肿瘤,分为VHL综合征相关性和散发性,主要发生于小脑和脊髓,较少发生于脑干,发生率分别为63%、32%和5%[1]。HB多生长缓慢,与VHL综合征相关者易出现多部位、多灶性生长,且容易复发。HB肿瘤细胞为多边形大细胞,因胞质富含脂质小空泡而透明,与CNS转移性透明细胞肾细胞癌(clear cell renal cell carcinoma, CCRCC)形态相近。瘤细胞常散在分布于丰富的薄壁血管间质内,当瘤细胞数量较少时易被忽略,尤其当HB与CCRCC同时出现在一个病灶内时更容易被漏诊。本文现报道1例CCRCC转移至CNS-HB的患者,着重探讨其临床病理特征、发生机制、诊断、鉴别诊断、治疗及预后,以提高临床与病理医师的认识水平。
1 材料与方法
1.1 临床资料患者男性,41岁,外院会诊病例。2019年患者因脑出血入院检查发现延髓、小脑蚓部占位,在外院行脑干占位切除术。患者既往于2008年行右肾癌根治术,术后病理诊断为CCRCC,术后8年出现肺及胸膜转移。2017年发现肾脏和胰腺的多发囊肿,经基因检测证实为VHL综合征患者。此次会诊切片为外院脑干肿物切除标本。
1.2 方法HE染色和免疫组化染色切片均为外院会诊切片。免疫组化染色采用EnVision两步法,抗体包括CK(AE1/AE3)、PAX-8、CK8/18、CD10、S-100、Fli-1、CD34、D2-40、Ki-67,具体操作步骤严格按试剂盒说明书进行,均设阴阳性对照。
2 结果
2.1 临床特点送检组织绝大部分为出血、坏死物,仅残存少量肿瘤组织,低倍镜下见两种形态不同的成分,分界尚清(图1)。一部分呈实性巢状、片状或索状分布的细胞巢,细胞界限清晰,胞质透亮或淡染,核圆形或卵圆形,居中或偏位,肿瘤细胞巢间见薄壁血管(图2);另一部分可见丰富的薄壁血管及毛细血管,血管间散在泡沫状细胞,胞质透明,富含大小不一的小空泡,核偏位、不规则(图3)。
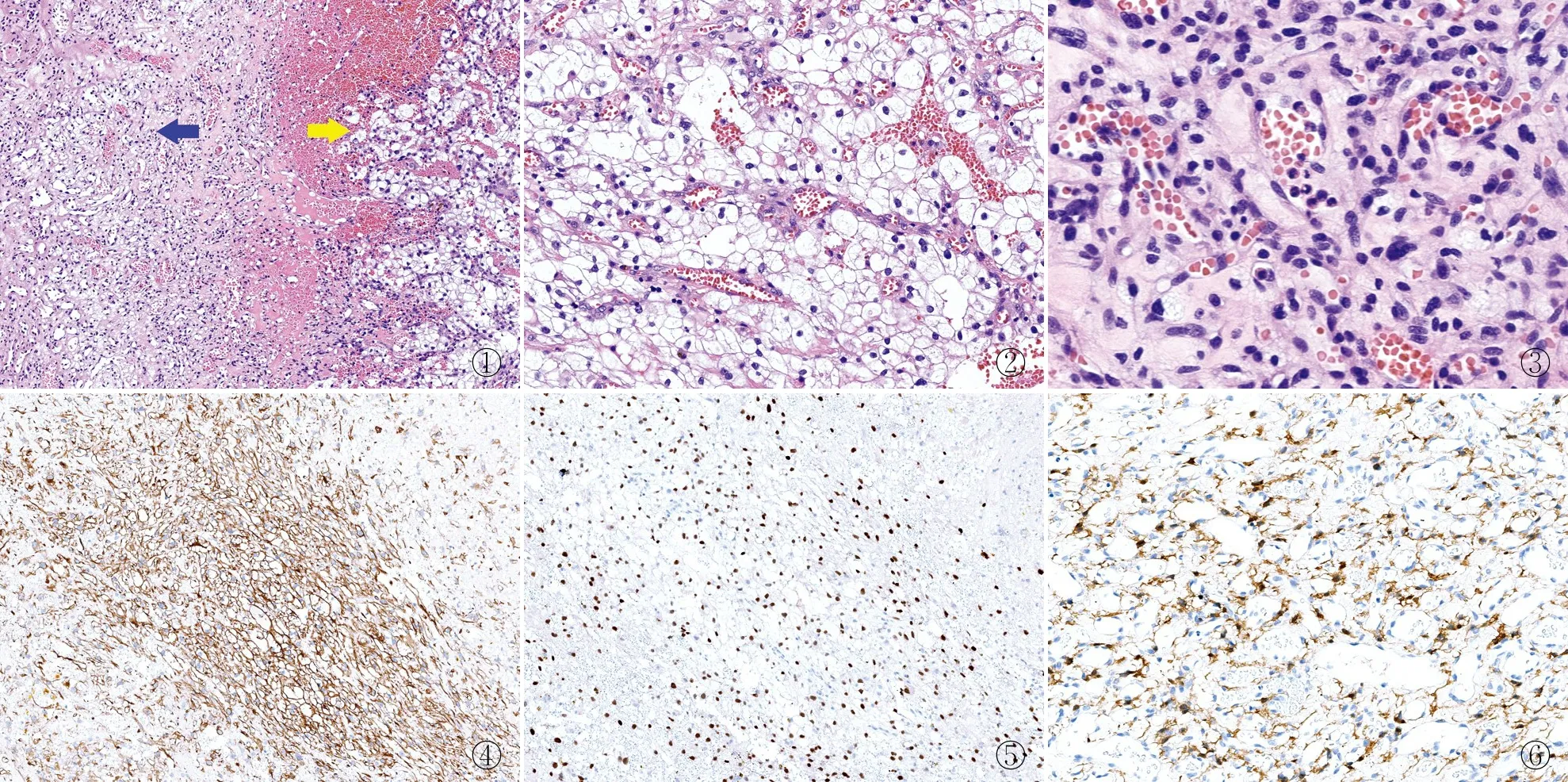
图1 脑干肿物中显示两种肿瘤成分:血管母细胞瘤(蓝色箭头)、透明细胞肾细胞癌(黄色箭头),两者界限尚清 图2 转移性透明细胞肾细胞癌:肿瘤细胞呈实性巢片状、索状分布,细胞界限清晰,胞质丰富、透明或淡染,细胞核圆形或椭圆形、居中或偏位,细胞巢之间可见薄壁血管 图3 血管母细胞瘤:薄壁毛细血管间质内见泡沫状间质细胞分散分布,间质细胞大、不规则,胞质丰富,富含大小不一的小空泡,部分细胞核偏于一侧 图4 透明细胞肾细胞癌中CK(AE1/AE3)呈阳性,细胞膜着色,EnVision法 图5 透明细胞肾细胞癌中PAX-8呈阳性,细胞核着色,EnVision法 图6 中枢神经系统血管母细胞瘤:间质细胞S-100呈阳性,细胞核着色,EnVision法
2.2 免疫表型透明细胞巢区域:CK(AE1/AE3)(图4)、PAX-8(图5)、CK8/18、CD10、EMA均阳性,S-100、Fli-1、CD34、D2-40均阴性,Ki-67增殖指数约10%;血管丰富区域:血管内皮细胞Fli-1、CD34、D2-40均阳性,间质内泡沫状细胞S-100(图6)部分阳性,CK(AE1/AE3)、PAX-8、CK8/18、CD10、EMA等上皮标记均阴性,Ki-67增殖指数约1%。
2.3 病理诊断结合组织形态及免疫组化结果诊断为CCRCC转移至CNS-HB。
3 讨论
VHL综合征是一种由VHL基因胚系突变引起的常染色体显性遗传病,包括多个器官的肿瘤:HB、肾透明细胞癌、嗜铬细胞瘤、胰腺神经内分泌肿瘤、胰腺/肾脏囊肿等,其中HB和肾透明细胞癌最常见,发生率分别为50%~60%和70%[2]。文献报道发生CCRCC转移至CNS-HB者临床罕见,均为散发的个案报道。自1992年Jamjoom等[3]首次报道,文献报道合计18例类似病例[3-13],其中仅有1例为国内报道[12]。总结文献发现CCRCC转移至CNS-HB有以下特点:(1)肿瘤发生部位主要是脊髓(10/18)和小脑(8/18),发生于脑干的尚未见报道。(2)女性略多,男女比为8 ∶10。(3)除Jarrell等[9]报道的6例无详细病程外,其余12例发病年龄19~54岁,平均34岁。多以CNS-HB为首发症状,9例发生CNS-HB早于肾癌;2例发生肾癌早于CNS-HB;1例为进行家族性筛查时,发现同时存在2种肿瘤。(4)除手术或尸检同时发现外,从肾癌确诊到发生转移的潜伏期为1~10年,平均潜伏期为4.4年。(5)患者发现转移前,有多次CNS-HB复发的病史。(6)患者均为VHL综合征患者,除表现多部位多灶性的CNS-HB外,有9例发生其他部位一个或多个肿瘤,分别为视网膜HB(5例)、肾囊肿(5例)、胰腺囊肿(3例)、嗜铬细胞瘤(2例)及胰腺神经内分泌肿瘤(2例)。(7)8例有VHL综合征家族史,有家族史者和无家族史者平均年龄接近(分别为33.9、35.6岁)。(8)临床症状及体格检查无特异性,可表现为头痛、头晕、呕吐、抽搐、四肢麻木无力、浅表感觉丧失、步态共济失调、意识模糊等。(9)MRI检查多提示为小脑囊性病变伴强化的附壁结节或脊髓内实性增强结节,前者与发生于小脑的纯HB的MRI表现相似[14]。(10)镜下两种肿瘤成分界限清晰,多呈中心的转移性肾细胞癌由周围的HB部分或全部围绕。本例为41岁男性患者,表现为CCRCC、CNS-HB、视网膜HB、左肾及胰腺多发囊肿,VHL综合征诊断明确。本例出现CCRCC早于CNS-HB,且转移潜伏期为11年,比文献报道的更长。本例发生于脑干,文献尚未见报道。
目前,关于CCRCC转移到CNS-HB的发生机制尚不明确。肿瘤远处转移与受体部位的高度血管化有关,肿瘤倾向于转移至血运丰富的部位,转移灶倾向于分布在血管周围。据统计,肾细胞癌[10]和脑膜瘤[13]分别是肿瘤转移最常见的内脏和CNS受体肿瘤。HB富于血管的结构特征,可能是其成为内脏肿瘤转移到CNS的第二大受体肿瘤[10]的原因。VHL基因突变,pVHL蛋白合成障碍,缺氧诱导因子经缺氧途径的活动增强,致使VEGF、EPO及GLUT-1等过表达,导致肿瘤血管异常增生,肿瘤高度血管化为肿瘤远处转移、生存和发育提供结构基础。同时,VEGF也参与肿瘤转移的“前转移龛”建立,促进转移灶的生长[15]。HB生长缓慢,无明显症状临床多以随访观察为主,为CCRCC的转移提供了时间可能。通常小于3 cm的肾细胞癌不建议手术切除[2],这也是肿瘤潜在的进展转移风险。此外,HB最常见的转移供体是CCRCC,可能这两种肿瘤分泌类似的旁分泌因子相互作用,促进肿瘤转移[8]。
有文献报道一种罕见的具有HB特征的CCRCC生长模式[16-17],典型的CCRCC区域与HB样成分逐渐过渡,后者同时表达PAX-8、RCC或CD10、S-100和α-inhibin,兼具HB和CCRCC的免疫表型。除VHL相关性肾细胞癌和HB外,散发性肾细胞癌也与VHL抑癌基因突变有关[18]。这些现象提示HB与CCRCC关系密切。有研究认为,类似于正常组织中存在干细胞,肿瘤中也存在肿瘤干细胞[19],使得肿瘤细胞具有自我更新和生长繁殖的能力,并具有多向分化的潜能。细胞在不同分化阶段的肿瘤转化便可导致多种肿瘤类型。因此,鉴于HB和CCRCC的相似性及关联性密切,推测两者亦有可能为处于不同分化阶段的同一谱系的肿瘤。
HB和CCRCC形态学具有相似性,需进行鉴别。两者均可见胞质丰富、透明的肿瘤细胞及丰富的薄壁毛细血管,但排列形式和分布方式往往有差异,CCRCC肿瘤细胞常呈实性巢片状、索状或管状分布,毛细血管呈网状分布于肿瘤细胞巢边缘,血管内皮细胞可能不明显;而HB肿瘤细胞多散在分布于丰富的薄壁毛细血管之间,血管内皮细胞明显。细胞型HB间质细胞丰富,在形态上与CCRCC易混淆,但其表达S-100,而不表达上皮标记如CK、EMA等,可与表达上皮标记,但不表达S-100的CCRCC进行鉴别。本例2种肿瘤成分界限较清晰,巢状分布的透明细胞巢表达CK及PAX-8、不表达S-100,提示为CCRCC;血管丰富区域的泡沫状细胞表达S-100,但不表达上皮标记,提示为HB。
目前,CCRCC转移至CNS-HB的治疗方式尚无统一标准,多以手术完整切除肿瘤。文献报道2例于术后1年内死亡[3,6];本例患者术后3个月死亡。CCRCC转移至CNS-HB临床极其罕见,其临床表现及影像学特征无明显特异性,易误、漏诊。全面详细的组织学形态分析和免疫组化染色,可帮助鉴别CNS-HB中的转移性CCRCC成分。

