胃底腺肿瘤12例临床病理及分子遗传学分析
刘 蕾,董新茜,范 雪,张学东,朱晓云,任玉波
胃底腺又称泌酸腺,正常分布于胃底、胃体部,包括主细胞、壁细胞、颈黏液细胞、内分泌细胞、干细胞。目前,以胃底腺细胞分化为特征的肿瘤报道大多来自于日本,该肿瘤多数以主细胞分化为主,与传统胃腺癌相比,有其独特的病理特征。本文收集12例胃底腺肿瘤,探讨其临床病理学特征及分子遗传学特征、鉴别诊断、治疗及预后,以提高临床医师和病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2015年1月~2021年3月北京大学国际医院和山东省聊城市人民医院存档的约6万例胃镜切除标本,其中12例术后病理证实为胃底腺肿瘤。患者男性5例,女性7例,年龄46~75岁,平均63岁。因腹胀、腹痛、反酸就诊或体检偶然发现,病程数天~10年。患者临床病理资料均完整,复习病理切片,明确肿瘤组织中各形态学亚型所占比例、脉管侵犯、坏死比例及周围黏膜情况。
1.2 方法
1.2.1免疫组化 标本均经10%中性福尔马林固定,常规取材,石蜡包埋,4 μm厚切片,HE染色,镜下观察。免疫组化染色采用EnVision法,一抗MUC5ac、MUC6、MUC2、CD10、β-catenin、p53、Ki-67、CD56、Syn、CgA及工作液,均购自北京中杉金桥公司。Pepsinogen Ⅰ、H+/K+-ATPase抗体购自Abcam公司,DAB显色,阳性呈棕黄色。幽门螺旋杆菌(helicobacter pylori, HP)银染法试剂盒购自珠海贝索公司,阳性呈棕黑色。
1.2.2原位杂交 采用原位杂交法检测EBV,试剂盒购自北京中杉金桥公司,以鼻咽癌作阳性对照。
1.2.3基因检测 采用北京吉因加公司高通量Panel测序技术,即第二代测序(next-generation sequencing, NGS)。通过检测蜡块中肿瘤DNA,一次性获得TP53、GNAS、KRAS、NRAS、BRAF、PIK3CA、APC、CTNNB1、HER2、MLH1、MSH2、MSH4、MSH6、PMS2等基因的变异信息,以瘤周组织作正常对照。
2 结果
2.1 临床特征胃底腺肿瘤12例均为原发,血、尿常规,生化检验无明显异常,仅1例CEA略升高(7.0 ng/mL,正常值≤5 ng/mL);尿素酶试验均阴性。内镜检查可见胃底或胃体中上部有一小灶黏膜呈隆起或浅表凹陷,颜色与周围组织相比,其稍红、褪色或微黑改变,直径0.3~1.2 cm,质软、边界较清楚,6例内镜下可见分支状扩张血管(图1)。
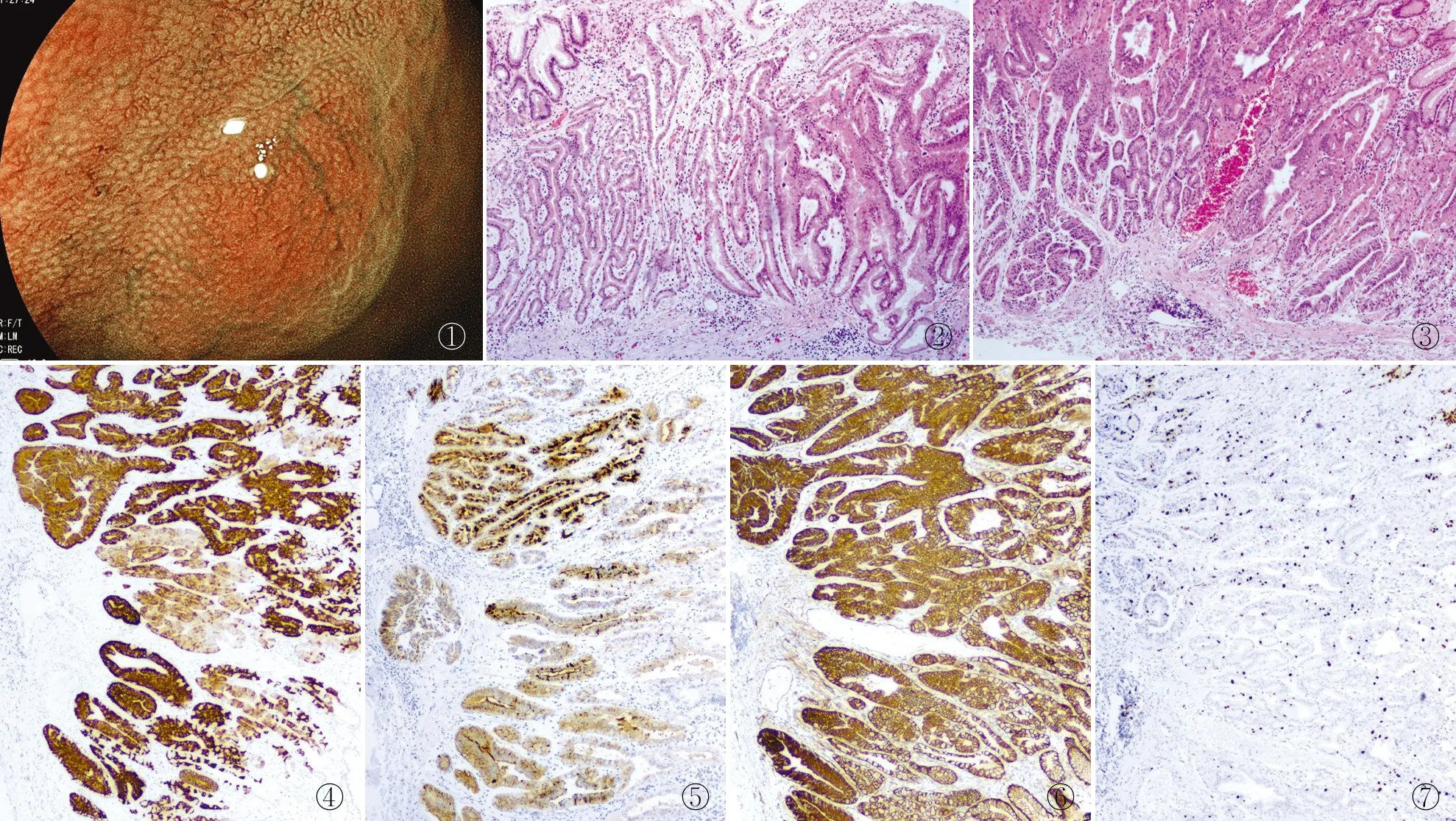
图1 内镜下黏膜一灶扁平隆起区,表面血管扩张 图2 肿瘤位于黏膜内,主要由立方/柱状主细胞构成腺管状或条索状 图3 肿瘤侵至黏膜下 图4 肿瘤细胞MUC6呈弥漫阳性,EnVision法 图5 肿瘤细胞PepsinogenⅠ呈弥漫阳性,EnVision法 图6 肿瘤细胞β-catenin膜阳性,未见核阳性,EnVision法 图7 肿瘤细胞Ki-67增殖指数较低,呈弥散分布,EnVision法
2.2 病理检查肿瘤主要由立方/柱状的主细胞构成腺管状或不规则分支小管吻合成条索状(图2),与周围正常腺体界限清晰。肿瘤细胞比周围正常胃底腺稍大(1.5~2倍)、深染,部分复层化排列。主细胞占60%以上,胞质略嗜碱或嗜双色,核圆形/卵圆形位于基底部,轻~中度异型,核仁小或不明显,未见核分裂象;其中见少数壁细胞,胞质富含嗜酸性颗粒。10例肿瘤侵至黏膜下(图3),1例局限黏膜内,1例黏膜活检标本无法判定肿瘤深度。间质纤维反应性增生轻微,未见坏死、脉管侵犯。
周围黏膜呈轻~中度慢性炎症,1例见个别胃底腺扩张,2例HP阳性。12例均未见肠上皮化生、萎缩、未见活动性炎。
2.3 免疫表型MUC6(图4)、PepsinogenⅠ(图5)均弥漫阳性,MUC5ac、H+/K+-ATPase阴性或少数阳性,MUC2、CD10均阴性。神经内分泌标记Syn、CD56、CgA均阴性或部分阳性,β-catenin(图6)均膜阳性,p53阴性或部分弱阳性,Ki-67增殖指数为1%~20%(图7),呈弥散分布(表1)。

表1 12例胃底腺肿瘤主要免疫表型、基因突变、临床病理资料
2.4 原位杂交检测检测结果显示12例EBV-EBER均阴性。
2.5 NGS检测本组12例胃底腺肿瘤中有7例GNAS错义突变,2例KRAS错义突变。其中2例GNAS、KRAS同时发生错义突变;1例TP53错义突变;1例APC、KRAS、NRAS同义突变;1例MSH6同义突变;其余基因APC、CTNNB1、BRAF、PIK3CA、HER2、MLH1、MSH2、MSH4、MSH6、PMS2均未检出变异(表1)。
2.6 治疗及随访10例胃底腺肿瘤患者行内镜黏膜切除术或内镜黏膜下剥离术,切缘阴性。余2例患者未行完整切除,切缘无法准确判断。随访10~42个月,患者均无复发或转移。
3 讨论
胃底腺分化的肿瘤临床罕见,绝大多数呈主细胞为主型。2003年Müller-Höcker等[1]及2005年Matsukawa等[2]报道胃底黏膜内的主细胞为主型胃底腺异型增生性息肉。2007年Tsukamoto等[3]首次提出主细胞为主型胃底腺腺癌。WHO(2019)消化系统肿瘤分类将黏膜内的胃底腺肿瘤定义为泌酸腺腺瘤,有黏膜下浸润时为胃底腺型腺癌。有学者提出新分类建议,将胃底腺黏膜上皮性肿瘤分为3种亚型:泌酸腺腺瘤、胃底腺型胃腺癌和胃底腺黏膜型胃腺癌;前两者表现为低级别上皮性肿瘤,而胃底腺黏膜型胃腺癌归类为胃底腺黏膜上皮性肿瘤的侵袭性变体,表现为高级别上皮性肿瘤。Tohda等[4]报道4年内经内镜检查的3万多例患者中,仅4例被确诊为胃底腺肿瘤。本组在5年内检查6万例患者,仅12例被确诊为胃底腺肿瘤,其发生率均小于0.1%。既往研究中患者以中老年为主(36~87岁),男性略占多数[3,5-6],而本组女性略多。患者一般临床症状轻,如腹部不适、反酸就诊或无症状。临床检查均无明显异常,个别病例有C反应蛋白和CEA略升高[1],本组仅1例CEA略有升高,临床表现及实验室检查均无特异性。
胃底腺肿瘤均发生于胃底腺黏膜,绝大多数为胃中上1/3的孤立性病灶,通常呈多灶[7]。直径多为1.0 cm,文献报道最大直径8.5 cm[8]。病变区表现为隆起、扁平或凹陷[9-10]。Fukatsu等[11]报道中央凹陷型胃底腺肿瘤黏膜下受累的可能大。本组瘤体相对较小,1例浅表凹陷病例完整切除后黏膜下浸润较深。此外,黏膜颜色的改变也有助于早期发现,有黏膜外观表现为白色、黄色或黑色素沉着[12]。约半数病例中可观察到扩张的分支血管,可能由于肿瘤生长方式位于黏膜层的深层,与黏膜下肿瘤相似,肿瘤压迫引起的充血导致扩张。虽然组织学上无法得以证实,但Ueyama等[13]认为胃底腺癌内镜下有分支状扩张的血管,可用来区分其他黏膜下肿瘤(除了类癌)。然而,内镜下的黏膜形状、颜色、血管改变均缺乏特异性,肿瘤标本的病理检查是必需的。
胃底腺肿瘤的组织形态学表现大多分化良好,肿瘤腺体结构可呈吻合腺体、实性腺体、簇状腺体或扩张腺体[5]。主细胞间可散见壁细胞,通常无内分泌细胞。肿瘤多轻~中度异型,即使发生黏膜下浸润,与传统类型、分化良好的腺癌相比,纤维增生反应较弱,肿瘤坏死少见[6]。肿瘤相邻黏膜基本正常,慢性炎症轻微。个别病例显示肿瘤周围伴少量扩张胃底腺,是否与质子泵抑制剂的使用有关尚待进一步分析。本组肿瘤多数侵至黏膜下层(10/12),异型较轻;仅1例肿瘤周围胃底腺扩张,但无相关用药史。
HP感染、肠上皮化生、黏膜萎缩与传统型胃腺癌的发生有相关性;而在胃底腺肿瘤中的发生率比传统型胃腺癌低,仅少数报道显示有HP感染或萎缩、肠化[4,9,14]。本组HP轻、中度阳性各1例,12例均未见肠上皮化生及萎缩改变。缺乏萎缩、胃酸分泌正常,也可部分解释患者长期主观症状轻微的现象。
胃底腺肿瘤中主细胞表达PepsinogenⅠ、MUC6,多不表达小凹标记MUC5ac及肠型标记CD10、MUC2;Ki-67增殖指教通常较低,多小于5%,且p53无过表达,预示肿瘤生长缓慢,恶性潜能低。尽管可侵入黏膜下层,但长期随访无复发或死亡报道,被视为低度恶性肿瘤,预后良好。个别肿瘤细胞有明显异型、异常小凹分化、脉管侵犯、淋巴结转移,则可能是侵袭性标志,提示预后不良[6,8,15-17]。本组有1例Ki-67增殖指数较高(10%~20%),但经完整切除后无明显异型、无脉管侵犯,患者预后尚好。在评估肿瘤黏膜下浸润时,需注意与异位腺体鉴别,根据无细胞异型性、无纤维增生和周围固有层,排除肿瘤黏膜下浸润[18]。另外,有关于胃底腺癌合并印戒细胞癌的个案报道[19]。
胃底腺肿瘤的组织学特征与神经内分泌肿瘤相似,均起源于深层;神经内分泌肿瘤呈黄色,肿瘤表面血管较少,外观质硬,而胃底腺肿瘤表面血管扩张,外观柔软。常规HE染色难以区分这两种肿瘤时,免疫组化检测有助于鉴别:胃底腺肿瘤Syn、CD56、CgA的表达较少,且PepsinogenⅠ和MUC6弥漫表达有助于鉴别。
此外,胃底腺息肉中的异型增生/腺癌通常是由黏膜表面的小凹上皮引起,而不是深层黏膜的胃底腺,可以与胃底腺肿瘤进行鉴别。早期胃癌、正常胃黏膜伴局灶性萎缩、黏膜相关淋巴组织淋巴瘤可能呈扁平或凹陷状,与胃底腺肿瘤内镜下特征相似。因此,行组织病理学检查对于准确诊断是必要的。
既往文献报道约1/2的胃底腺肿瘤病例可检测到CTNNB1、AXIN、APC、GNAS、PPP2R1A突变,并提示Wnt/β-catenin信号通路的激活导致β-catenin过度积累和核转移可能在其致癌过程中起作用,β-catenin核染色优先出现于肿瘤的较深部位(侵入面)[6,8,20]。但发生基因突变的病例未必一定呈β-catenin核表达[21]。另外,胃底腺肿瘤中SFRPS、AXIN、APC基因甲基化介导Wnt/β-catenin信号通路途径的激活,β-catenin蛋白在高甲基化病例中的核表达明显高于低甲基化,提示高甲基化可能与某些胃底腺肿瘤进展有关[22]。本组免疫组化染色显示β-catenin膜染色而无核聚集,通路相关基因如CTNNB1、APC在本组也未检出突变,提示肿瘤尚处于早期阶段,预后较好。与传统型胃腺癌不同,GNAS突变在较多胃底腺型腺癌及个别泌酸腺腺瘤中有报道,而KRAS突变较少检出[6,8,23]。本组胃底腺型腺癌中GNAS错义突变率较高(6/10),而1例泌酸腺腺瘤未检出基因突变,突变与肿瘤浸润深度、肿瘤大小无关,需积累更多病例进一步分析。另外,p53异常的发生率极低,目前尚无过表达的报道,本组仅1例TP53错义突变。本实验首次在分子层面显示胃底腺肿瘤与EBV无相关性,且肿瘤微卫星稳定,HER-2无扩增。
多数胃底腺肿瘤局限于黏膜或浅表黏膜下层,生长缓慢,脉管侵犯罕见,临床过程良性,缺乏转移和复发,病程可长达12年,无进展[24]。内镜黏膜切除术或内镜黏膜下剥离术可对浅表、异型轻的胃底腺肿瘤进行切除[25]。黏膜下浸润伴明显异型或脉管侵犯的患者,则通过全胃/节段性胃切除术+淋巴结清扫[6,16]。由于肿瘤通常位于黏膜深层,获得足够数量的组织对诊断、治疗及预后至关重要。本组2例仅行活检检查,建议患者行肿瘤完整切除后进一步分析。
综上所述,本组12例胃底腺肿瘤均为主细胞主型,根据形态学特征、辅以免疫组化检测可明确诊断。异型轻微、无脉管侵犯患者,预后良好。肿瘤完整切除对治疗及疾病预后评估是必要的。GNAS突变是胃底腺型腺癌较常见的遗传特征。

