胃肠道间质瘤中GNG13的表达及其临床意义
杨 珺,施维佳,赵 靖,贾宇新,倪 辉
胃肠道间质瘤(gastrointestinal stromal tumor, GIST)是消化道最常见的间质性肿瘤,主要起源于Cajal间质细胞,由梭形细胞、上皮样细胞和多形性细胞组成。其发病部位50%~70%位于胃部,20%~30%位于小肠[1]。GIST的临床诊断主要依赖于病理学分型和基因突变检测,大多数GIST含有c-Kit或PDGFRA基因突变[2]。手术是GIST临床治疗的最佳方法。然而,GIST可从良性转变为恶性,增加术后复发和远期预后不良的风险[3]。目前,GIST具体发病机制尚不十分清楚。近期研究发现[4],细胞间递质和激素分泌异常是神经内分泌细胞和恶性肿瘤的重要特征之一,受G蛋白偶联膜受体的调控。GIST存在多种神经内分泌表型,其中G蛋白偶联膜受体高表达,G蛋白具有识别激素、改变代谢物水平和传递神经信号等多种生物学活性[5]。G蛋白亚单位γ13(G protein subunit gamma 13, GNG13)是重要亚型,在机体的正常生理功能和器官发育中发挥重要作用[6],但其在胃肠道肿瘤中的作用尚不清楚。本文着重探讨GIST组织中GNG13的表达及与临床病理特征、预后的关系,为GIST的诊断和治疗提供新的生物学标志物。
1 材料与方法
1.1 临床资料收集2011年2月~2016年2月江苏省人民医院溧阳分院/溧阳市人民医院经病理学确诊的122例GIST患者。纳入标准:(1)年龄>18岁;(2)符合GIST病理学和基因突变的诊断;(3)手术完整切除肿瘤组织和邻近5 mm癌旁正常组织切缘均为阴性;(4)取得患者的知情同意权,经江苏省人民医院溧阳分院/溧阳市人民医院伦理委员会批准,临床资料均完整。排除标准:(1)术前有放化疗、基因靶向治疗史;(2)合并胃肠道恶性肿瘤、消化性溃疡等胃肠道疾病;(3)严重肝肾功能障碍、自身免疫性疾病、营养代谢性疾病;(4)免疫组化结果被污染,无法分析。
1.2 方法将术中完整切除的GIST组织和癌旁正常组织快速冷冻处理,常规制作石蜡组织,5 μm厚切片。采用免疫组化EnVision法检测组织中GNG13的表达,具体操作步骤:切片经脱蜡、水化和抗原修复后,加入3%H2O2溶液和正常山羊血清工作液,27 ℃孵育30 min以封闭抗体,提高组织显色效率;依次滴加鼠抗人GNG13抗体一抗(江苏碧云天公司,工作浓度1 ∶2 000),置于湿盒内4 ℃孵育过夜,以正常小鼠IgG代替一抗作为阴性对照;洗涤干净后滴加兔抗鼠IgG抗体二抗(江苏碧云天公司,工作浓度1 ∶500),置于湿盒中27 ℃孵育20 min;洗涤干净后滴加辣根酶标记链霉卵白素工作液(江苏碧云天公司),置于湿盒中27 ℃孵育20 min;经洗涤后加入DAB显色液,镜下观察。
采用半定量法计算,GNG13阳性主要定位于细胞质,根据阳性细胞着色强度、阳性细胞百分率进行评分:按阳性细胞染色强度将阴性“-”计为1分、弱阳性“+”计为2分、中等阳性“”计为3分和强阳性“”计为4分;按阳性染色细胞百分比将≤5%计为0分、6%~25%计为1分、26%~50%计为2分、>50%计为3分;两项得分相乘,其中0~3分为低表达,4~12分为高表达。
1.3 统计学分析采用SPSS 23.0软件对数据进行统计学分析,计数资料采用例数和百分比表示,组间比较采用χ2检验;Kaplan-Meier生存曲线分析总生存期(overall survival, OS),组间比较采用Log-rank χ2检验;单因素和多因素Cox回归分析影响OS的危险因素;采用逐步后退法,以双侧检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 GIST和癌旁正常组织中GNG13的表达免疫组化检测结果显示,GIST组织中GNG13的高表达率(73.8%,90/122)明显高于癌旁正常组织 (11.5%,14/122),差异有统计学意义(χ2=96.796,P<0.001,图1)。
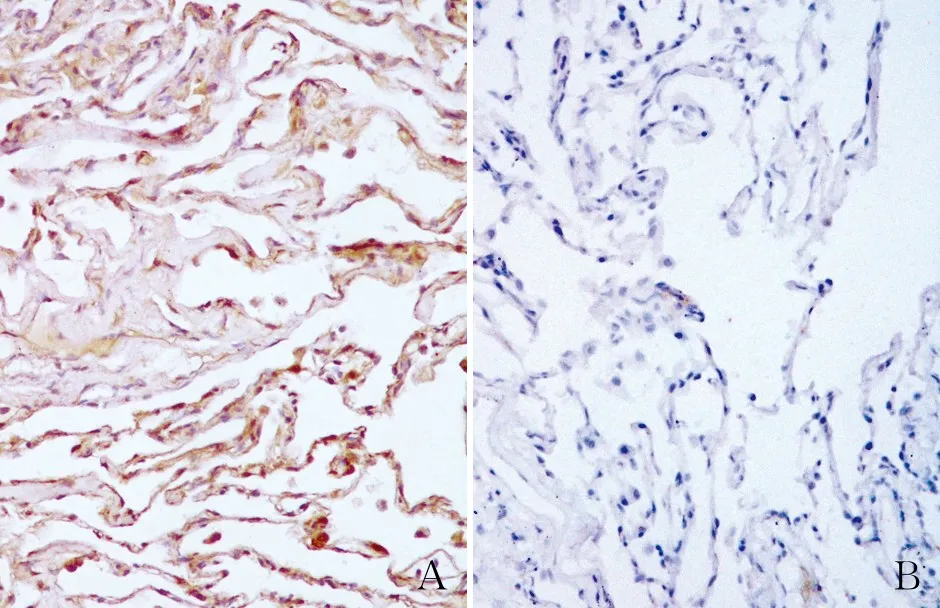
图1 GNG13的表达,EnVision法:A.胃肠道间质瘤中GNG13呈阳性;B.癌旁正常组织中GNG13呈阴性
2.2 GIST中GNG13表达与临床病理特征的关系GIST中GNG13高表达组肿瘤直径和有丝分裂指数、DOG1和CD117表达,均明显高于GNG13低表达组(P<0.05)。其他指标间比较,差异无统计学意义(P>0.05,表1)。
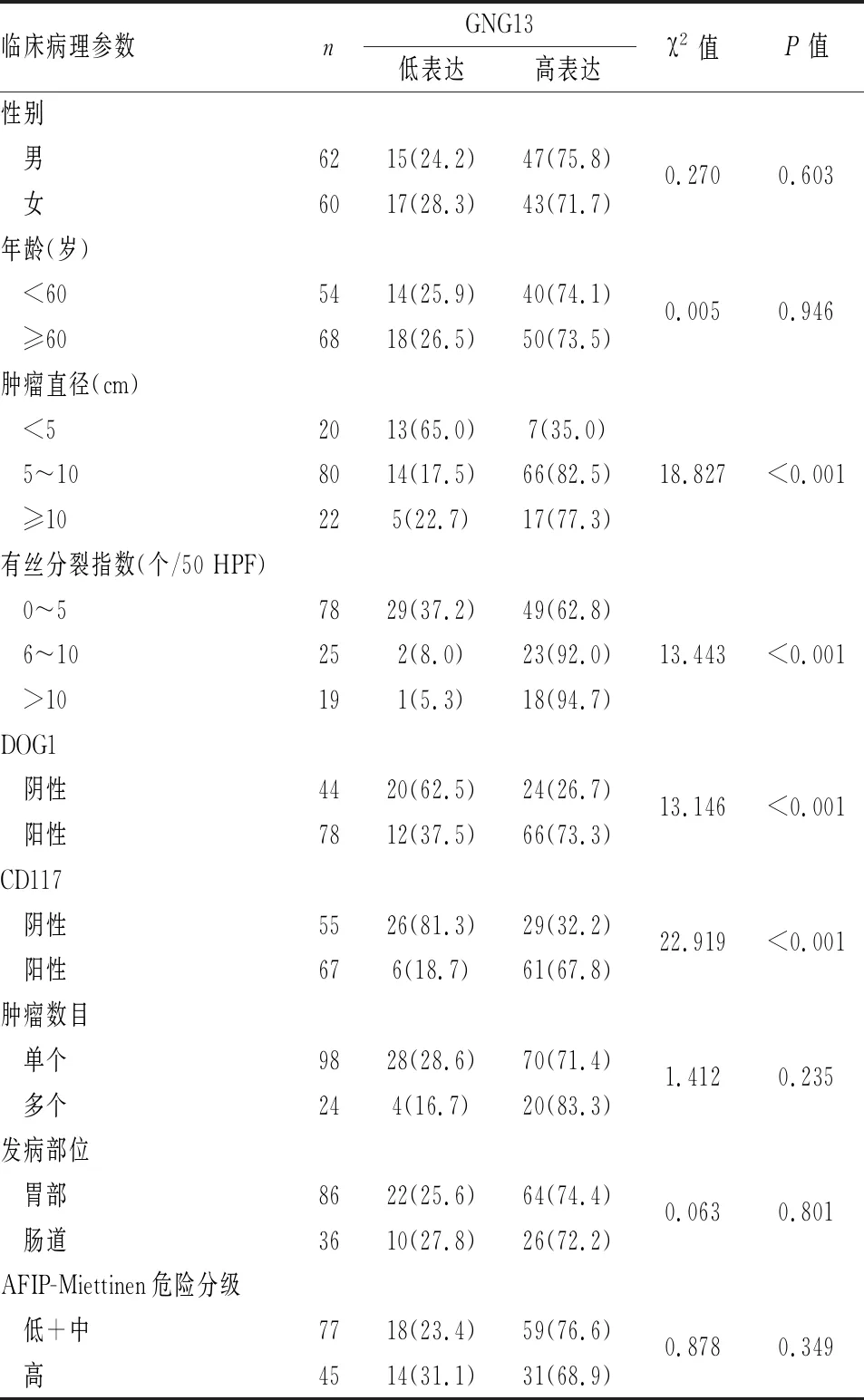
表1 胃肠道间质瘤中GNG13表达与临床病理特征的关系[n(%)]
2.3 GIST中不同组间的预后比较Kaplan-Meier生存曲线显示,GIST中GNG13高、低表达组与肿瘤直径、有丝分裂指数的5年OS相关(P<0.05,表2,图2)。

表2 胃肠道间质瘤中不同组间的预后比较
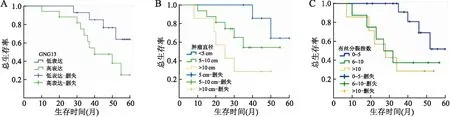
图2 胃肠道间质瘤患者的预后分析:A.GNG13表达与总生存期的关系;B.肿瘤直径与总生存期的关系;C.有丝分裂指数与总生存期的关系
2.4 GIST预后的危险因素分析将GIST的临床和病理特征作为自变量,生存或死亡作为因变量进行单因素和多因素Cox回归分析。本组结果显示GNG13高表达、肿瘤直径和有丝分裂指数增加均是GIST患者5年OS降低的独立危险因素(P<0.05,表3)。

表3 胃肠道间质瘤预后的危险因素分析
3 讨论
GIST是胃肠道最常见的良性肿瘤,早期手术可彻底根治,复发率通常较低,术后放、化疗对肿瘤复发、耐药和转移者的治疗效果较差[7]。分子靶向药物如伊马替尼、舒尼替尼对复发性GIST有一定联系,改善临床转归[8]。GIST的基因突变类型复杂多样,可能与患者的临床特点及预后密切相关[9],随着研究的深入,更多的突变位点被识别和检测,对提高肿瘤临床疗效以及预后转归有重要意义。
本实验结果显示GIST组织中GNG13高表达率明显高于癌旁正常组织(73.8%vs11.5%,P<0.001),提示GNG13高表达可能参与GIST的进展。GIST具有神经内分泌细胞的肿瘤特性,肿瘤细胞中含有多种跨膜受体,其功能表达需要G蛋白介导细胞内信号转导,最终实现靶向基因和蛋白的表达[10-12]。G蛋白的分子结构由α、β和γ亚基组成,Gγ分子亚基可以独立介导细胞外信号向细胞内和细胞核传导,并参与有丝分裂和细胞膜等过程运输[13-14]。GNG13是由人类16号染色体上的GNG13基因座编码的Gγ分子,由3个3.5 kb外显子和984 bp开放阅读框组成,起始于外显子2终止于外显子3。GNG13在嗅觉、味觉和视网膜神经元中大量表达,并与小鼠的攻击行为密切相关[15-16]。本实验进一步发现,GNG13高表达组肿瘤直径和有丝分裂指数、DOG1和CD117表达,均明显高于GNG13低表达组(P<0.05);提示GNG13高表达主要参与肿瘤的有丝分裂和细胞增殖过程。DOG1和CD117也被认为是GIST重要肿瘤标志物,GNG13与DOG1、CD117之间的关系尚不清楚。在GNG13高表达组中DOG1和CD117表达亦明显增多,提示GNG13是GIST发生的重要生物学标志物。文献报道G蛋白亚单位参与调节器官发育、生理功能以及肿瘤的发生,其中Gγ由12个亚基组成:Ⅰ类包括Gγ7和Gγ12,Ⅱ类包括Gγ2、Gγ3、Gγ4和Gγ8,Ⅲ类包括Gγ5和Gγ10,Ⅳ类包括Gγ1、Gγ9和Gγ11,Ⅴ类包括Gγ13。Gγ1主要通过丙戊酸钠途径控制果蝇心脏的形成,并与生殖细胞的迁移有关[17-19]。Gγ11通过ERK1/2进一步激活丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)信号通路,促进细胞衰老和凋亡的发生[20-21]。GNG11通过诱导活性氧和异常细胞核形态进而抑制人肺成纤维细胞系SUSM-1细胞的恶性增殖[22-23]。Gγ家族在细胞正常生长发育和肿瘤发生中发挥重要作用。如GNG7在胰腺癌、胃癌和结直肠癌中表达较低,且GNG7是霍奇金淋巴瘤发生的重要抑制因子[24-26]。启动子甲基化抑制GNG7可以明显降低头颈部肿瘤和食管癌体外细胞的恶性增殖和迁移能力[27-28]。Montemagno等[29]报道NeoB是靶向胃泌素释放肽受体(gastrin releasing peptide receptor, GRPR)的放射性示踪剂,GRPR是在多种癌症中表达的G蛋白偶联受体,利用NeoB能够较准确评估GIST中的GRPR分布情况以及评估靶向疗效。
本实验显示,GIST中GNG13高、低表达组与肿瘤直径、有丝分裂指数的5年OS相关(P<0.05);提示三者可能导致GIST预后不良。采用单因素和多因素Cox回归分析显示,GNG13高表达、肿瘤直径和有丝分裂指数增加均是5年OS降低的独立危险因素(P<0.05)。DOG1和CD117在多因素回归分析中并未显示与OS的关系,考虑与纳入样本量和患者的临床特征有关。GNG13在多因素Cox回归分析中仍显示与OS有紧密联系,提示GNG13表达上调与GIST的发生和预后密切相关。GNG13高表达与GIST的恶性表型有关,原发性GIST最重要的预后因素有肿瘤直径、有丝分裂指数、原发部位和AFIP-Miettinen危险分级,但该研究未观察到原发部位和AFIP-Miettinen危险分级与GIST的临床预后有关,可能与样本量和观察时间有关。有研究指出[30],相同肿瘤直径、有丝分裂指数的GIST临床预后可能不同,提示GIST的发生、发展与多种因素相关,尤其是分子水平。本实验的意义在于发现GIST组织中GNG13高表达,可能是肿瘤发生和预后的重要参与机制。
综上所述,GNG13高表达可能参与GIST的发生、发展,与肿瘤直径和有丝分裂指数增加有关,是影响患者预后的独立危险因素,可作为早期诊断GIST和评估临床预后的重要生物学标志物。本实验首次提出GNG13高表达可能参与GIST的发生、发展,为肿瘤诊断、靶向治疗以及评估预后提供重要参考。由于本组病例数和观察时间有限,还需积累更多病例进一步分析。本课题组后续将通过体外细胞和动物模型,进一步分析GNG13参与GIST发生、发展的具体机制。

