自身免疫性肝炎患者肝组织IL-35表达和外周血髓样抑制细胞百分比变化临床意义探讨*
马国斌,赵晓宏,赵 鹏,杨 冰
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种累及肝脏实质的特发性疾病,以血清γ-球蛋白增高和对免疫抑制剂治疗应答为临床特点[1]。相关研究指出,由Treg细胞分泌的白介素-35(interleukin-35,IL-35,又称为EB病毒诱导蛋白3,Epstein-Barr virus-induced gene 3,Ebi3)与多种自身免疫性疾病的发生密切相关[2]。IL-35是IL-12家族成员,由Ebi3蛋白和p35亚基组成异源二聚体,可直接发挥免疫抑制作用,并能调节Treg细胞分化,抑制Th17细胞亚群分化和增殖,进而可对过度免疫反应起到一定的抑制作用。有学者发现,髓样抑制细胞(myeloid-derived suppressor cells,MDSCs)百分比异常与肝癌的发生存在密切的关联[3]。MDSCs是髓系来源的异质性细胞,由骨髓祖细胞与未成熟的骨髓细胞组成,为免疫调节细胞,可负性调节适应性免疫应答[4],但目前对于IL-35和MDSCs与AIH发病的关系尚处于探索阶段。本研究检测了AIH患者肝组织IL-35表达和外周血MDSCs百分比变化,以探讨其临床意义。
1 资料与方法
1.1 临床资料 2017年5月~2020年2月我院收治的AIH患者35例,男5例,女30例;年龄为34~59岁,平均年龄为(45.1±6.8)岁。符合《自身免疫性肝炎诊断和治疗共识(2015年)》[5]中关于AIH的诊断标准。排除标准:(1)严重的心脑血管疾病;(2)合并乙型肝炎病毒或丙型肝炎病毒或人类免疫缺陷病毒感染;(3)肝硬化;(4)既往有肝脏手术史;(5)存在其他严重的免疫系统疾病;(6)存在恶性肿瘤。
1.2 肝组织IL-35表达检测 常规肝穿刺活检取得肝组织,自液氮冻存管中取出肝组织,用生理盐水洗涤,取100 mg,加入细胞裂解液100 μL和蛋白酶抑制剂2 μL,充分匀浆,于液氮中冻融3次,低温高速离心后取上清液60 μL,应用蛋白定量试剂盒进行蛋白定量分析。取蛋白160 μg,用无菌超纯水将肝组织体积补充至20μL,将入还原剂和缓冲液补充终体积至60 μL,于75℃水浴中煮5 min,-20℃保存。缓慢加入10%分离胶溶液,添加去离子水封顶,常温下放置1 h,待其完全凝固后倾倒出上层去离子水,按同法添加积层胶,常温下放置40 min,待其完全凝固,使用北京六一实验设备厂生产的DYY-10型电泳仪,在电泳槽中加满1×SDS电泳缓冲液,用注射针头调整各个孔的胶体至准确位置,排出气泡。加入蛋白80μg,在电泳槽中放入冰盒,电泳1 h。当溴酚蓝印迹线到达凝胶底部时关闭电源,终止电泳。取出凝胶,切去基层胶和多余的分离胶,将胶块泡在电泳缓冲液中备用。用甲醇液浸泡5 min,转入电转移液中浸泡。根据目的蛋白分子量大小和预实验结果确定电转移时间,转膜结束后取出转移膜,制作封闭液,将纤维素膜放入含有5 ml封闭液的封口袋中封闭2 h。按照稀释比例(1:500)配制羊抗人p35抗体(英国Abcam公司)、鼠抗人Ebi3单抗(英国Novus公司)或抗β-actin(英国Abcam公司),稀释比例为1:100,4℃下过夜。分别加入适量的1×TBS-T稀释辣根HRP标记的羊抗大鼠IgG(北京普利莱技术公司,1:5000)或辣根HRP标记的兔抗山羊IgG(索莱宝技术有限公司,1:5000),室温下孵育2 h,用1×TBS-T洗膜3次。按照说明书配制超敏发光液,均匀滴加至纤维膜正面,于德国Lecia显影仪曝光,调整至合适的灰度值。
1.3 外周血MDSCs百分比检测 采集外周静脉血3 ml,抗凝,避光孵育20 min,加溶血素1 mL,混匀,离心,分离血清。加入1×Fix/Perm Buffer 1 mL,离心,弃上清液,加入荧光标记的抗细胞表面特异性抗原(抗CD14-PE、抗CD11b-FITC、抗CD33-Cy5、抗HLA-DR-ECD,美国BD公司)各5 μL,混匀,在4℃环境下孵育45 min,重复该操作一次。使用美国CytoFLEX公司生产的LX型流式细胞仪测定MDSCs百分比。
1.4 病情严重程度判定 参照《自身免疫性肝炎诊断和治疗共识(2015年)》[5],根据界面破坏范围和细胞浸润深度分度,轻度:局部或少数门管区破坏;中度:<50%门管区或纤维间隔破坏;重度:≥50%门管区或纤维间隔破坏。
1.5 肝组织学检查 常规行病理学检查,采用Knodell组织学活动度指数积分系统进行炎症活动度分级和纤维化分期[6]。
1.6 治疗与应答 给予泼尼松30~60 mg.d-1或波尼松联合硫唑嘌呤50 mg.d-1治疗。根据患者病情控制情况,将泼尼松逐渐减量至5~10 mg.d-1。参照《自身免疫性肝病的诊治:从共识到指南》[5],完全应答为血化学指标缓解,即血清转氨酶和免疫球蛋白G(immunoglobulin G,IgG)水平均恢复正常。
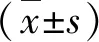
2 结果
2.1 不同病情严重程度患者肝组织蛋白表达和外周血MDSCs百分比比较 重度组肝组织p35和Ebi3表达及外周血MDSCs百分比显著高于轻度或中度组,中度组MDSCs百分比显著高于轻度组(P<0.05,表1)。
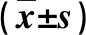
表1 三组肝组织蛋白表达和外周血MDSCs百分比比较
2.2 不同肝纤维化和炎症分级患者肝组织IL-35表达和外周血MDSCs百分比比较 纤维化分期S3~S4期患者p35和Ebi3表达及MDSCs百分比显著高于S1~S2期,炎症分级G3~G4级患者p35和Ebi3表达及MDSCs百分比显著高于G1~G2级(P<0.05,表2)。
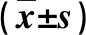
表2 不同肝纤维化分期和炎症分级患者肝组织IL-35表达和MDSCs百分比比较
2.3 不同治疗时间应答患者肝组织IL-35表达和外周血MDSCs百分比比较 本组AIH患者经治疗均获得完全应答,但<3个月应答组肝组织p35和Ebi3表达显著低于3~6个月或>6个月应答组(P<0.05,表3)。
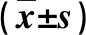
表3 不同时间应答患者IL-35表达和MDSCs百分比比较
3 讨论
界面性肝炎是AIH组织学特征之一,主要是因门管区炎症导致门管区或纤维间隔相邻的肝细胞坏死引起的,多表现为界面处肝细胞呈单个或小簇状坏死、脱落,导致小叶界面呈“虫蛀”状改变[7,8]。既往研究发现,多种自身免疫性疾病、炎症性疾病和冠心病等的发生都与IL-35过表达有关[9,10]。IL-35是IL-12家族成员,是由EB病毒诱导基因3编码蛋白和p35两个亚基组成的异源二聚体,属于Ⅰ型细胞因子超家族成员,与IL-12等具有部分同源性,为新型抗炎因子,其可扩增Treg细胞数量,可抑制效应性T细胞的产生,并能抑制Th17细胞分化,进而可抑制和减轻炎症反应[11,12]。MDSCs是未成熟的髓系细胞亚群,目前认为其可抑制机体对细菌感染、病毒等疾病的免疫应答,且能够诱导调节性T细胞和增加L-精氨酸的代谢等途径发挥作用[13,14]。当机体受到感染或免疫功能遭到破坏时,未成熟的骨髓细胞分化被阻断,导致MDSCs大量产生,聚集于血液、骨髓等部位,高表达免疫抑制分子,可发挥免疫调控功能。本研究发现,重度AIH患者肝组织p35表达和外周血MDSCs百分比显著高于轻度组或中度组,中度组显著高于轻度组,说明肝组织IL-35表达和外周血MDSCs百分比与界面性肝炎严重程度有关。
肝组织炎症反应是保护肝细胞免受伤害,促进组织损伤修复,但炎症反应太过强烈则会对肝实质造成不可逆的损害[15,16]。本研究发现,纤维化分期和炎症分级较高患者的肝组织IL-35表达和外周血MDSCs百分比较高。MDSCs可通过抑制T细胞增殖和活化起到负向调控机体免疫应答作用[17,18],肝炎的发生可导致MDSCs增殖、聚集,但其过度表达则会导致机体免疫功能紊乱,进而加重肝功能损伤。
治疗AIH的目标主要在于缓解临床症状,防止疾病进展[19]。目前,多采用泼尼松等药物治疗,但不同患者的治疗应答速度不同,可能会对预后造成影响[20]。本研究结果显示,治疗不同时间应答患者肝组织p35表达和外周血MDSCs百分比显著不同,迟迟不能应答患者蛋白表达和细胞百分比显著增强或升高,说明治疗应答时间越短,患者肝组织IL-35表达和外周血MDSCs百分比越低,可能与IL-35表达弱和外周血MDSCs水平较低患者肝组织损伤较轻有关。

