鸡粪和玉米秸秆混合干发酵特性及微生物多样性研究
宋佳楠,于佳滢,冯磊,甄箫斐,李海洋,于跃玲,李福强
(1.沈阳航空航天大学能源与环境学院,辽宁 沈阳 110136;2.沈阳航空航天大学民用航空学院,辽宁 沈阳110136;3.兰州交通大学新能源与动力工程学院,甘肃 兰州 730070)
0 引言
随着化石燃料的供应紧张和环境问题的日益突出,寻找替代能源刻不容缓。生物质能源是重要的可再生能源,我国生物质的年产量居世界第一,其中农作物秸秆年产量达7亿多t[1]。据农业部统计,我国每年的畜禽粪便产生量高达40亿t,但综合利用率却不足60%[2],[3]。鸡粪中含有饲料中未被消化的35%的氮和16%的磷,处理不当会导致持久污染[4]。如果能够合理地利用这部分生物质资源,不仅能够对环境起到保护作用,还能够生产沼气等清洁能源[5]~[7]。同时,相关政策的支持也为厌氧消化技术的工程应用带来了较大的机遇。
欧洲各国的沼气工程发展迅速,为各国带来了巨大的环境经济效益。截至2010年,欧盟各国的大、中、小型沼气工程已有将近9 000座。在随后的几年中,沼气工程数量不断增多,年平均增长约28%。伴随着我国农村能源的逐渐匮乏,国家鼓励发展农村沼气工程,大中型沼气工程迎来了快速发展期[8]。单一地对农作物秸秆或畜禽粪便进行厌氧发酵,容易产生氨化、酸化和纤维素不易降解等问题。因此,我国进行了许多关于混合干发酵的研究,如混合干发酵原料配比对产气量的影响,温度和pH值对产气效率的影响等,混合干发酵将是沼气工程的重要发展方向[9]。
针对沼气工程运行过程中微生物学机制研究较少的现状,本文以鸡粪为底物,添加10%的玉米秸秆开展中温连续式干发酵实验,定期监测甲烷日产量、pH值、VFAs浓度、COD浓度和氨氮浓度等参数的变化,重点分析了发酵过程的产气性能以及不同种类酶活性和微生物群落结构的变化,以期为鸡粪与秸秆混合干发酵沼气工程的长期稳定运行提供一定的技术支持和微生物学依据。
1 材料与方法
1.1 实验材料
本实验以新鲜鸡粪为原料,鸡粪取自取自辽宁北票宏发食品有限公司旗下的东官黄古屯肉鸡养殖基地,为成年白羽肉食鸡的新鲜粪便。玉米秸秆取自沈阳郊区农田,为研磨后的新鲜玉米秸秆(进过铡草机,处理后长度≤2 mm)。接种物为含水率80%的新鲜活性污泥,取自沈阳市北部污水处理厂,取回后中温驯化24 h。
1.2 实验方法
图1为本实验所用的厌氧消化装置示意图。该装置主要由4联30 L厌氧发酵罐和中央控制系统组成。实验启动时,鸡粪与玉米秸秆的总质量为3 000 g,质量比为9:1,接种污泥的量为3 000 mL,启动过程中的温度设置为37±0.2℃,实验启动周期为20 d。实验启动后,通过加料(加料的鸡粪和玉米秸秆质量比也为9:1)使系统内的总固体(TS)含量达到15%以上,根据产气情况继续加料以提高TS含量,直到系统内TS含量达到20%以上。实验温度为37℃,为保证实验过程中微生物有充足的可利用营养物质,第0~30天间隔两日加1 000 g原料,第31~90天每日加1 000 g原料,第91~103天每日加2 000 g原料。

图1 厌氧消化装置示意图Fig.1 Anaerobic reaction digestion device
1.3 检测方法
甲烷产量采用LML-1型湿式气体流量计和GT901型甲烷气体检测仪进行测量;TS含量采用重量法进行测定;COD浓度采用重铬酸钾法进行测定;氨氮(NH4+-N)浓度采用纳氏试剂分光光度法进行测定;挥发性脂肪酸(VFAs)浓度采用分光光度计比色法进行测定;pH值采用pH计进行测定;酶活采用连续法进行测定;微生物群落采用16 S rRNA测序技术进行测定。
2 结果与讨论
2.1 产气特性分析
鸡粪与玉米秸秆混合干发酵的甲烷日产量和累积产量变化情况如图2所示。
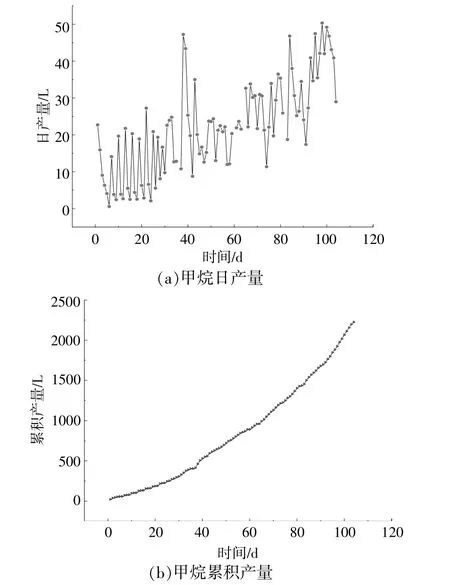
图2 甲烷日产量和累积产量的变化情况Fig.2 The changes of daily and cumulative methane production
从图2(a)可以看出:实验启动后,随着原料的添加,甲烷日产量整体呈上升趋势;在前30天,由于进料间隔较长,每次增加原料后,甲烷日产量均呈现出新的峰值;90 d之后的甲烷日产量均值明显高于前期的甲烷日产量均值;在第100天左右出现了甲烷日产量最高峰,为50.32 L。随着厌氧消化反应的继续进行,在每次加料的间隔,鸡粪与玉米秸秆的厌氧消化进入饥饿阶段,消化液中可生化降解的有机物逐渐被利用,微生物可利用的营养物质消失殆尽,甲烷产量逐渐降低,直至下一次添加原料,甲烷日产量出现新的峰值。从图2(b)可以看出,甲烷累积产量的主要变化趋势为先快后慢,这是因为实验后半阶段的加料间隔明显缩短且加料量增加,系统内的TS含量明显升高,进而造成甲烷日产量和累积产量的上升。
2.2 氨氮浓度的变化情况
氨态氮是指厌氧消化液中以游离氨(NH3)和铵离子(NH4+)形态存在的氮,消化液中的氨态氮通常是由水解细菌在分解蛋白质过程中形成的,简称氨氮。一定浓度的氨氮可以为微生物的生长繁殖提供氮源,但是,当消化液中的氨氮浓度过高时,氨氮会通过阻碍酶的合成而抑制甲烷的产生,氨氮还会通过被动运输的形式进入微生物细胞膜中,从而影响细胞内部质子和钾离子的平衡,严重抑制厌氧微生物的活性[10]。因此,控制消化液中的氨氮浓度对提高厌氧消化效率和甲烷累积产量至关重要。鸡粪与玉米秸秆混合干发酵过程中氨氮浓度的变化情况如图3所示。
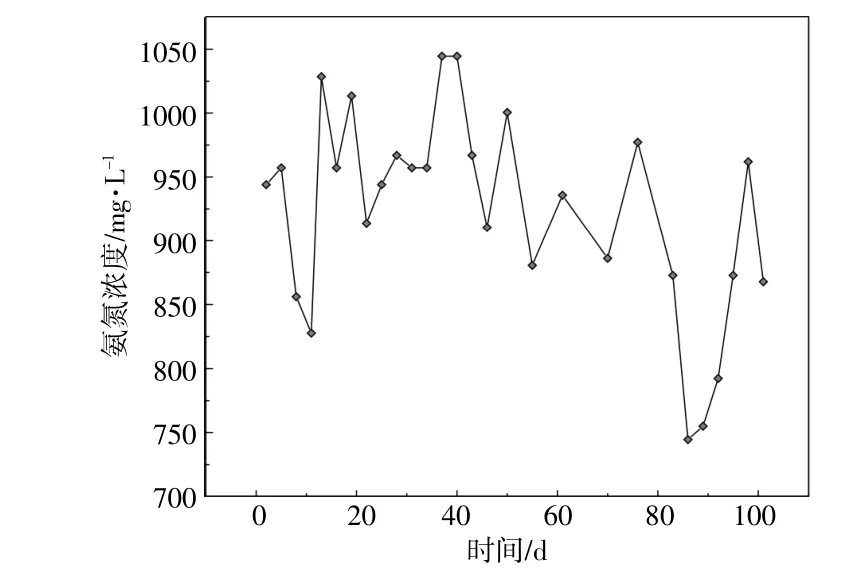
图3 混合干发酵过程中氨氮浓度的变化情况Fig.3 The change of ammonia nitrogen concentration in the process of mixed dry fermentation
从图3可以看出:在整个厌氧消化过程中,氨氮浓度整体上呈现出先上升后下降的趋势;在实验前期,随着厌氧消化反应的进行,水解细菌对蛋白质等大分子进行分解,生成大量的氨氮,同时由于不断加入反应物料,使得氨氮累积量逐渐上升,氨氮浓度在第37天和40天出现峰值,为1 044 mg/L;之后,随着产甲烷古菌的活性逐渐增强,其以消化液中的氨氮作为合成自身细胞的氮源,从而导致氨氮浓度逐渐下降[11];在整个厌氧消化过程中,氨氮浓度维持在700~1 050 mg/L,消化反应过程中无明显的拮抗反应现象出现。厌氧消化液中的氨氮浓度是维持消化系统稳定的重要指标,若能控制氨氮浓度在适宜的范围内,对提高甲烷产率和厌氧消化的效率有关键作用。
2.3 pH值和VFAs浓度的关系
pH值可以反映厌氧消化系统的酸碱状态、水解酸化细菌和产甲烷古菌的活性。VFAs作为生物代谢的中间或最终产物而存在,其积累和消耗对厌氧消化反应有直接影响。图4反映了鸡粪与玉米秸秆混合干发酵过程中pH值与VFAs浓度的变化情况。结合图2和图4可以看出:甲烷日产量与pH值和VFAs浓度有密切的关系,pH值与甲烷日产量成正比,当pH值升高到最大时,甲烷日产量也相应达到峰值;而VFAs浓度与甲烷日产量和pH值成反比,VFAs浓度越高,则甲烷日产量和pH值越低。

图4 混合干发酵过程中pH值与VFAs浓度的变化情况Fig.4 Changes of pH value and VFAs concentration during mixed dry fermentation
在实验初期(1~6 d),水解性细菌产生水解酶把非水溶性大分子(碳水化合物、脂肪和蛋白质等)水解成可溶性的单糖、脂肪酸和氨基酸等较小分子化合物,酸化细菌将这些小分子化合物转化成了VFAs。此时消化系统中的产甲烷古菌未完全适应环境,其利用乙酸的速率与各种产酸菌的生产速率不能达到动态平衡,产甲烷速率处于较低水平,从而导致VFAs积累,pH值降低[11]。在第7~24天,每隔两天加料1 000 g,pH值上升至6±0.2后保持相对稳定状态;产甲烷菌数量逐渐增加,积累的有机酸被利用,VFAs浓度先减小后逐渐累积。从第31天起,每天加料1 000 g,随着发酵底物的增加,VFAs逐渐累积,VFAs浓度在第50天达到峰值,为19.07 mg/mL,此时pH值开始从5.87逐渐下降。在第55~78天,系统出现酸化现象,pH值较低,产气效果较差。加入适量的NaOH调节后,pH值在第78天达到峰值,为6.8~7.3,之后趋于稳定。研究表明,甲烷菌适宜的pH值为6.8~7.8,低于6.5或高于8.0均会对其产生明显的抑制作用。同时,过低的pH值还会降低蛋白质的生物催化效果,不利于厌氧消化反应的进行。因此,保持厌氧消化系统适宜的pH值对提高厌氧消化效率和甲烷产量至关重要。
2.4 COD浓度和不同种类酶活性的变化关系
在厌氧消化过程中,多种具有水解作用的酶会参与到厌氧消化过程中的大部分生物化学反应。消化液的COD浓度可以代表溶解在消化液中的有机物浓度,因此,根据消化液的COD浓度可以判断厌氧消化反应器的运行状态。本研究的发酵基质为鸡粪和玉米秸秆,因此,根据鸡粪和玉米秸秆组成,本文研究了厌氧消化过程中纤维素酶、半纤维素酶、蛋白酶、脂肪酶和淀粉酶的活性变化,并分析了消化液中COD浓度的变化与这些酶活性变化的关系。图5为鸡粪与玉米秸秆混合干发酵过程中不同种类酶活性与COD浓度的变化情况。

图5 混合干发酵过程中COD浓度和不同种类酶活性的变化情况Fig.5 Changes of COD concentration and activities of different enzymes during mixed dry fermentation
从图5可以看出,COD浓度的总体变化趋势为先上升后下降,这是因为实验初期的微生物活性不高,随着添加物料的增加,消化液中的有机物浓度逐渐增加,表现为COD浓度逐渐上升,随着厌氧消化反应的不断进行,微生物开始大量繁殖,有机物被微生物作为营养物质消耗,导致COD浓度有下降的趋势。随着厌氧消化反应的进行,各类水解细菌逐渐适应生存环境,各类水解酶的丰富度逐渐增大,水解类细菌分泌的纤维素酶和半纤维素酶在促进纤维素和半纤维素水解的同时,还可以提高植物细胞壁的溶解效率,使植物细胞内更多的内溶物通过细胞壁释放出来,从而提高厌氧消化反应的原料利用效率[12]。从图5还可以看出,纤维素酶、半纤维素酶、蛋白酶、脂肪酶和淀粉酶活性的最大值分别为2.44×105,0.34,153.06,471.93,307.76 IU/L,COD浓度的最大值为110 400 mg/L;随着厌氧消化反应的进行,这5种酶的活性逐渐降低,最后趋于稳定。在实验后期,通过人为调控将pH值调到6.8以上并维持相对稳定状态,此阶段的进出料相对稳定,COD浓度逐渐降低,产甲烷量逐渐升高,系统内的有机质得到有效降解,VFAs浓度保持在18 mg/mL左右,产酸细菌的产酸效率与产甲烷菌对VFAs的利用效率达到相对平衡的状态,此时的厌氧消化效率较高且较为稳定。
2.5 干发酵过程中微生物群落结构的变化情况
厌氧消化过程中水解酸化细菌和产甲烷古菌的动态平衡有利于消化反应的稳定运行。厌氧消化系统中的微生物是动态变化的,在每个时期都有其特定的优势菌群。本实验分别在第1(D1),5(D5),10(D10),15(D15),20(D20),30(D30),40(D40),50(D50),60(D60),70(D70),80(D80),90天(D90)对消化液进行取样,并利用16S rRNA测序技术对发酵系统的微生物群落进行鉴定和分析。
图6为古菌在门和属水平的菌群相对丰度变化情况。从图6可以看出;实验各阶段的优势菌群均为广古菌门(Euryarchaeota),因此,可进一步寻找广古菌门活性最高的生存环境,并与厌氧消化的反应条件相结合,从而提高产气量;在实验末期,厚壁菌门(Firmicutes)的相对丰度增加至27%;古菌属水平的优势菌在初期为甲烷丝菌属(Methanosaeta),随着厌氧消化的进行,优势菌逐渐演变为甲烷拟杆菌属(Methanobacterium)和甲烷球形菌属(Methanosphaera)。甲烷球形菌属和甲烷拟杆菌属为实验过程中的主要优势菌种,均属于甲基营养型产甲烷古菌,主要利用H2、甲醇和乙酸等物质进行产甲烷代谢,将其转化为CH4和CO2。甲烷丝菌属(Methanosaeta)属于乙酸营养型产甲烷古菌,是实验前期的优势菌,其相对丰度随时间的变化而逐渐降低,且受玉米秸秆添加量的影响,主要将甲基胺或甲醇歧化为CH4和CO2,或将H2,CO2和乙酸转化为CH4[12]。

图6 古菌门和属水平的菌群相对丰度变化情况Fig.6 Changes in the relative abundance of bacterial groups at the phylum and genus levels
图7为细菌在门和属水平的菌群相对丰度变化情况。从图7可以看出;在反应初始阶段,细菌门水平上的优势菌为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),随着反应的进行,变形菌门和拟杆菌门的相对丰度逐渐减少,而厚壁菌门在整个反应过程中均为优势菌;细菌属水平上相对丰度有所降低,没有特别明确的优势菌;前15天的优势菌为乳酸菌属(Lactobacillus)和拟杆菌属(Bacteroides)。第50~70天的优势菌为乳酸菌属,80天后的优势菌为乳酸菌属和厌氧球菌属(Anaerococcus)。乳酸菌属属于乳杆菌目,在实验中期的相对丰度较高,可产生乳酸和多种脂肪酶,增加厌氧消化系统的丁酸含量;厌氧球菌属在实验中期和后期的相对丰度较高,属于专性厌氧菌,可以将蛋白质和葡萄糖水解为有机酸和醇类等物质。综上可以得出,接种的污泥菌属主要由拟杆菌门、变形菌门和厚壁菌门等微生物构成,该类微生物主要参与纤维素、半纤维素和蛋白质等大分子有机物的水解,对促进厌氧消化底物的水解起着重要作用,具有发酵氨基酸(半胱氨酸、亮氨酸、丝氨酸、色氨酸)产生小分子有机物的功能,这些细菌共同参与水解酸化反应,为产酸细菌提供可利用的的营养物质[13]。因此,可通过对这些细菌的进一步培养,增加其丰富度,以加速对底物中纤维素和半纤维素的水解,提高反应的产气效率。

图7 细菌门和属水平TOP10菌群相对丰度变化情况Fig.7 Changes in relative abundance of TOP10 flora at the phylum and genus levels
3 结论
①鸡粪与玉米秸秆混合干发酵时所表现出来的产甲烷规律,主要与物料的添加和产甲烷菌的活性有明显关系;在一定有机负荷内,加料量越大、加料频率越高,甲烷的日产量越高。
②在整个厌氧消化过程中,氨氮浓度表现为先上升后下降的变化趋势,氨氮浓度没有对厌氧微生物的生长产生拮抗作用;消化液的pH值呈现出先稳定后减小,最后上升至7±0.2并保持稳定的变化趋势,VFAs浓度的变化趋势为先上升后趋于稳定。
③COD浓度最大值为110 400 mg/L,纤维素酶、半纤维素酶、蛋白酶、脂肪酶和淀粉酶活性的最大值分别为2.44×105,0.34,153.06,471.93,307.76 IU/L。
④细菌在门水平上的优势菌为广古菌门、厚壁菌门、变形菌门和拟杆菌门,属水平上各微生物的相对丰度明显下降,没有明显的优势菌。

