血管生成素-2、瓜氨酸联合降钙素原对脓毒症合并急性呼吸窘迫综合征诊断及预后的评估
雷翔慧,李 涛
(郴州市第一人民医院a.病理科; b.重症医学科,湖南 郴州 423000)
脓毒症是感染所致的炎症反应失衡,常伴有肺、肾和肝等重要脏器的严重损伤,病情发展迅速,病死率高[1-2]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是脓毒症最常见和最严重的并发症,主要累及呼吸系统,患者表现为全身炎症和细胞因子失衡导致的肺功能障碍,可增加其病死率。因此,探索脓毒症合并ARDS的诊断与预后评估的临床生物标志物至关重要[3]。
血管生成素(angiopoietin-2,Ang-2)是一类促血管生成因子。其可通过阻断其相应的Tie-2受体促进血管生成,从而导致血管通透性增加乃至器官功能障碍,与脓毒症的预后不良呈正相关[4-5]。瓜氨酸是一种非蛋白氨基酸,主要参与合成尿素、一氧化氮和精氨酸等。瓜氨酸可清除羟基自由基,减轻缺血、缺氧和应激时自由基造成的组织损伤。脓毒症患者体内瓜氨酸合成减少,导致肺内一氧化氮减少,促进ARDS的发生、发展[6]。降钙素原(procalcitonin,PCT)是降钙素前体,在甲状腺C细胞中产生。在细菌感染时,PCT水平显著升高,成为细菌性脓毒症的诊断标志物,但在创伤、手术、烧伤和自身免疫性疾病等患者体内也可轻度升高[7]。本研究以脓毒症合并ARDS患者为研究对象,检测患者血清Ang-2、瓜氨酸及PCT水平,探讨其对脓毒症合并ARDS的诊断及预后评估的价值,为临床提供参考。
1 资料与方法
1.1 研究对象
收集郴州市第一人民医院2017年12月至2021年3月脓毒症患者的临床资料,共105例。其中,脓毒症合并ARDS患者(脓毒症合并ARDS组)45例,单纯脓毒症患者(脓毒症组)60例。脓毒症合并ARDS组28 d内死亡(死亡亚组)21例,生存(生存亚组)24例,脓毒症组28 d内死亡15例,生存45例。记录各组患者入院初急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ)评分及氧合指数。纳入标准:1)符合脓毒症及ARDS的诊断标准;2)年龄≥18岁;3)临床资料完整;4)患者及家属自愿参与本研究并签订知情同意书。排除标准:1)年龄<18岁及妊娠期妇女;2)既往6周内有心肌梗死病史;3)正在接受免疫抑制剂治疗的患者;4)恶性肿瘤及艾滋病患者;5)临床资料不全的患者。脓毒症的诊断标准符合2016年美国重症医学会联合欧洲重症医学会发布的脓毒症3.0诊断标准[8]。ARDS的诊断依据2012年柏林诊断标准[9]:1)急性起病,有明确的危险因素;2)急性低氧血症,氧合指数≤300 mmHg(1 mmHg=0.133 kPa);3)胸片双侧阴影,不能完全解释为胸腔积液、肺萎陷或结节;4)不能完全用心力衰竭或体液过载来解释的呼吸衰竭。本研究通过本院医学伦理委员会批准。
1.2 方法
1.2.1 Ang-2、瓜氨酸和PCT的测定
动态检测患者入院第1、3和7天血清Ang-2、瓜氨酸和PCT的变化情况。采用高效液相色谱法测定血清瓜氨酸的水平。用甲醇沉淀血清中的蛋白,经低温冷冻离心后,提取血清中的瓜氨酸,加入高精氨酸作为内标,经过滤器过滤后,用高效液相色谱仪(美国Waters公司)进行分离,分离后用紫外检测器进行检测,波长为254 nm,血清瓜氨酸浓度与检测信号的强度呈正相关。采用酶联免疫吸附法检测血清中Ang-2、PCT的水平,试剂盒购自江苏江莱生物科技有限公司。
1.2.2 统计学方法
2 结果
2.1 2组基线资料比较
与脓毒症组比较,脓毒症合并ARDS组氧合指数更低,APACHE Ⅱ评分更高,机械通气率和28 d内死亡率更高,其差异均有统计学意义(均P<0.05)。其他基线资料差异无统计学意义,具有可比性。见表1。
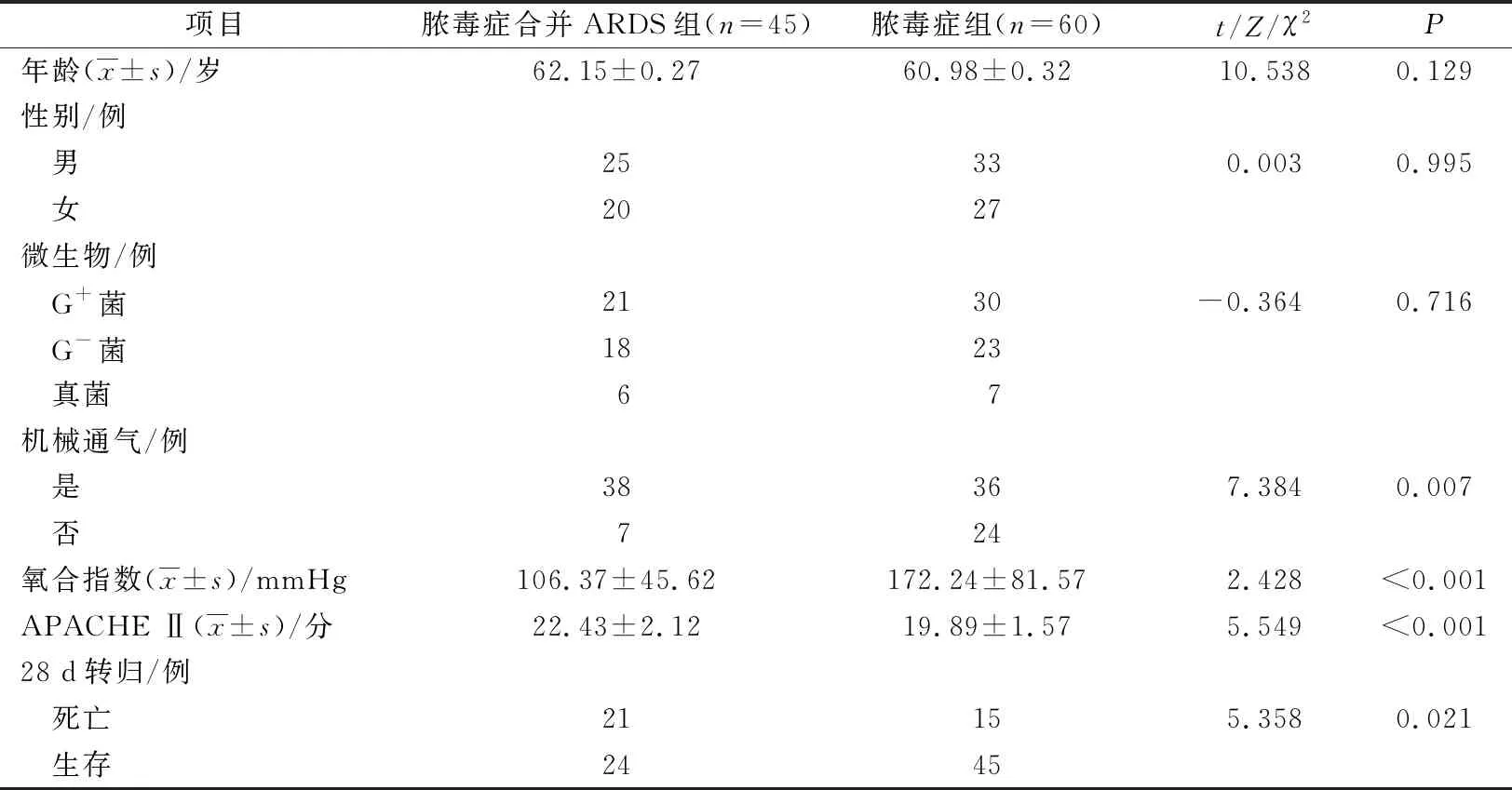
表1 2组基线资料比较
2.2 2组患者入院第1天血清Ang-2、瓜氨酸和PCT比较
与脓毒症组比较,脓毒症合并ARDS组入院第1天血清Ang-2、PCT水平更高,瓜氨酸水平更低(均P<0.05)。见表2。

表2 2组患者入院第1天血清Ang-2、瓜氨酸和PCT比较
2.3 血清Ang-2、瓜氨酸和PCT对脓毒症合并ARDS的诊断效能
血清Ang-2、瓜氨酸和PCT对脓毒症合并ARDS诊断的约登指数、临界值、敏感度、特异度和AUC见表3;血清Ang-2、瓜氨酸和PCT联合检测对脓毒症合并ARDS的AUC为0.918,明显高于各指标的单独检测,三者联合诊断的敏感度为84.4%,特异度86.7%。血清Ang-2、瓜氨酸和PCT单一和联合对脓毒症合并ARDS的诊断ROC曲线见图1。

表3 血清Ang-2、瓜氨酸和PCT对脓毒症合并ARDS的诊断价值

图1 ROC曲线
2.4 脓毒症合并ARDS 28 d内不同转归患者血清Ang-2、瓜氨酸和PCT变化
45例脓毒症合并ARDS患者中,死亡亚组血清中Ang-2、PCT随病程时间延长而逐渐增加,瓜氨酸随病程时间延长而逐渐减少(均P<0.05);生存亚组血清中瓜氨酸随病程时间延长而逐渐增加,Ang-2、PCT随病程时间延长而逐渐减少(均P<0.05)。见表4。

表4 脓毒症合并ARDS 28 d内不同转归患者血清各指标的比较
3 讨论
脓毒症主要表现为器官功能障碍和对感染的异常免疫反应。器官功能障碍是由于局部或全身释放炎症介质,在感染部位或远离刺激感染的器官所致[10]。肺损伤常见于脓毒症,进一步可发展为ARDS。因此,及时有效地诊断和治疗脓毒症患者可及时控制疾病的进程[11]。
PCT作为机体中降钙素的前体分子,正常情况下或者机体局部出现感染或炎性反应时水平较低,而只有在严重创伤、广泛烧伤、胰腺炎、器官移植和大手术等情况下PCT才会增加,因此PCT常被作为全身性炎性反应的重要指标[12]。贾明雅等[13]对117例重症肺炎合并脓毒症患者进行研究发现,PCT与重症肺炎合并脓毒症患者预后密切相关,与死亡患者比较,存活患者的PCT水平明显更低。本研究发现,血清PCT对脓毒症合并ARDS的敏感度为77.8%,特异度为75.0%,AUC为0.805,且生存亚组患者的PCT水平在入院治疗后的第1天、第3天、第7天水平均明显低于死亡亚组,提示PCT与脓毒症合并ARDS患者的预后不良相关。
内皮细胞可直接反映机体肺损伤情况。Ang-2是由内皮细胞合成,与ARDS的肺血管神经性水肿相关。有研究[14]显示,Ang-2与IL-6、TNF-α等炎症因子水平呈正相关,说明Ang-2水平可以反映机体炎症程度。LOMAS NEIRA等[15]研究表明血管内皮细胞的破坏会导致脓毒症小鼠体内Ang-2含量增加,与小鼠器官衰竭有关。相反,Ang-2基因敲除小鼠对多种内皮损伤有保护反应,组织因子和白细胞粘附分子不能上调,从而维持内皮屏障并提高小鼠的生存率。WHITNEY等[16]临床研究表明成人感染性休克和ARDS的死亡率与体内Ang-2升高有关。本研究表明,Ang-2对脓毒症合并ARDS的特异性最高,为88.3%,表明Ang-2对脓毒症合并ARDS诊断的误诊率最小,而且生存亚组患者的Ang-2水平在入院治疗后的第1天、第3天、第7天水平均明显低于死亡亚组,提示Ang-2可以预测脓毒症合并ARDS患者病情发展。
瓜氨酸可在肾脏中转化为L-精氨酸琥珀酸盐,随后转化为L-精氨酸。ASGEIRSSON等[17]研究发现,脓毒症大鼠体内的瓜氨酸主要合成精氨酸,给大鼠摄入瓜氨酸可通过免疫调节的手段降低促炎介质(IL-6和抵抗素)的分泌,同时不抑制抗炎介质(IL-10和脂联素)的分泌。本研究发现,脓毒症合并ARDS患者血清中瓜氨酸显著低于脓毒症患者,且生存亚组患者的瓜氨酸水平在入院治疗后的第1天、第3天、第7天水平均明显高于死亡亚组,提示瓜氨酸水平与脓毒症合并ARDS患者病情发展密切相关。
合理准确地选择标志物,对于脓毒症患者早期诊断和病情评估以及病情发展的预测意义重大。本研究显示,与单纯脓毒症组比较,脓毒症合并ARDS组入院初血清Ang-2、PCT水平更高,瓜氨酸水平更低,且血清Ang-2、瓜氨酸和PCT联合检测对脓毒症合并ARDS的AUC为0.918,明显高于3种指标单独检测,三者联合诊断的敏感度为84.4%,特异度86.7%,具有较好的诊断价值。脓毒症合并ARDS死亡亚组患者各时间点血清中Ang-2、PCT水平较生存亚组更高,瓜氨酸水平较生存亚组更低,提示3项指标对脓毒症合并ARDS的预后评估具有一定的参考价值。
综上所述,血清Ang-2、瓜氨酸及PCT对脓毒症合并ARDS的诊断及预后评估具有一定的价值,三者的联合检测对脓毒症合并ARDS诊断价值最高。

