桉木半纤维素与苯氧乙醇作为化妆品成分的实验探究
张馨予, 刘海棠,2
(1.中国轻工业造纸与生物质精炼重点实验室, 天津市制浆造纸重点实验室, 天津科技大学轻工科学与工程学院, 天津 300457; 2.江苏省生物质能源与材料重点实验室, 南京 210042)
全球能源需求正不断增长, 预计到2040年,能源需求将在现有基础上再增加28%[1]。 其中,化石能源是当前消耗的最主要能源, 是人类社会生存和发展的重要物质。 随着化石能源的逐渐消耗,各国开始发展生物质能源,其不仅环保可再生,还能重复利用[2-3]。
桉木属于阔叶木,生长周期短,质轻,易折[4]。 在桉木溶解浆的生产过程中,预水解液是重要产物,其组成成分复杂,大部分是木糖,也存在少量乙酸、木素和糠醛等[5]。 通过生物质精炼将半纤维素转化为有利的产品, 则对经济效益和制浆造纸的绿色发展都具有重要意义[6]。
含有丰富的营养成分是化妆品最重要的特性之一,但在为皮肤提供养分的同时,脂类、蛋白质等有机组分也会为侵入的微生物提供营养物质。因此,需要在化妆品中添加防腐剂,从而抑制、杀灭侵染的微生物,延长使用期限,保护化妆品在生产、储存、运输和使用的过程中免受细菌的污染[7-8]。
苯氧乙醇(Phenoxyethanol)是一种液体有机化合物,无色,略有芳香气味,具有较好的抗菌功效且致敏性低。自20 世纪50年代初,苯氧乙醇就经常被作为防腐剂添加到化妆品中, 是相对较安全的防腐剂之一[9]。 随着防腐体系变得越来越安全、环保,目前对防腐剂的研究有两个方向: 一是研究复合防腐剂体系, 根据其性质, 添加两种或以上的防腐增效剂,使它们相互促进,提高对微生物抑制效果;二是研究天然防腐剂, 即从动植物及微生物中直接提取用于化妆品、食品、药品等领域的防腐剂[10]。
本文从桉木预水解液中提取半纤维素, 并对其进行羧甲基化改性,探究了其改性前后的抗氧化性、吸湿性、保湿性以及抗菌性。
1 材料与方法
1.1 原料与试剂
桉木预水解液,山东太阳纸业股份有限公司;氢氧化钠、浓硫酸、无水乙醇、氯乙酸、五氧化二磷、硫酸亚铁、过氧化氢、水杨酸、硫酸铵、硫酸钾、氯化钠,分析纯,国药集团化学试剂有限公司;溴化钾,光谱纯, 国药集团化学试剂有限公司;DPPH (质量分数96%)、苯氧乙醇有机试剂,上海麦克林生化科技有限公司;蛋白胨、酵母浸粉、琼脂粉,生物试剂,北京奥博星生物技术有限责任公司。
1.2 实验设备
SJ-3100 型精密PH 计, 奥豪斯仪器有限公司;RH basic 磁力搅拌器, 德国IKA 公司;PL602-S 型电子天平、AR2140 型分析天平、SL-200PL 型移液枪,梅特勒-托利多仪器(上海)有限公司;TG18G 型台式高速离心机、50 mL PE 离心管, 成都天奇仪器设备有限公司;VOS-60A 型真空干燥箱, 上海施都凯仪器设备有限公司;N-1100 型旋转蒸发仪, 上海爱郎仪器有限公司;DF-101S 型集热式恒温加热磁力搅拌器, 巩义市予华仪器有限公司;FTIR-650 型红外光谱分析仪, 天津港东科技股份有限公司;HHS-21-4 型电热恒温水浴锅, 上海博迅医疗设备厂;T6 新世纪紫外可见光分光光度计, 北京普析通用仪器责任有限公司;HCB-1300V 型超净工作台,青岛海尔特种电器有限公司;DSX-24L-I 型手提式高压蒸汽灭菌器,上海申安医疗器械厂。
1.3 半纤维素(HC)提取
称取连带离心管共85 g 的预水解液,8000 r/min离心15 min,取400 mL 上清液倒入旋蒸瓶,60 ℃旋转蒸发至溶液原体积的约三分之一, 将剩余液体转移至烧杯中;滴加浓硫酸,调pH 至2,放入4 ℃的冰箱静置一夜; 通过抽滤去除沉淀的木素, 获得上清液,加入4 倍体积的无水乙醇,使半纤维素醇沉,搅拌均匀后,静置12 h,倒去上清液,多次加无水乙醇洗涤沉淀,直至沉淀变为淡黄色;将沉淀的半纤维素通过抽滤的方式分离出来,放入40 ℃的真空干燥箱烘干12 h,获得半纤维素。
1.4 半纤维素羧甲基化实验
利用响应曲面法[11]确定实验条件,根据实验条件制备羧甲基半纤维素并测定产品的取代度, 探究最佳实验条件。
称取1 g 半纤维素加入100 mL 的三颈烧瓶中,用10 mL 蒸馏水溶解50%的NaOH(占所需加入NaOH的量)加入烧瓶,在45 ℃下搅拌30 min;加入40 mL无水乙醇,再加入氯乙酸和剩下50%的NaOH,放入80 ℃的水浴锅中加热,在全部反应时间2 h 中的前1 h 要用搅拌器进行搅拌,转速为100 r/min;反应结束后除去上清液,加入一定量85%的乙醇清洗沉淀后倒出,重复清洗3 次,然后抽滤得到沉淀,放入真空干燥器中干燥12 h,得到羧甲基半纤维素(CMHC)。
参考文献[15]的方法测量样品的取代度:称取0.2 g CMHC 样品放入烧杯,在烧杯中加入50 mL 蒸馏水, 用浓度为0.05 mol/L 的稀硫酸和氢氧化钠将pH 调节至8.0。 缓慢往溶液中滴定0.05 mol/L 的硫酸标准溶液,直至溶液pH 达到3.74,记录滴定所消耗的硫酸标准溶液的量,根据式(1)计算取代度DS。
其中
式中:m 为羧甲基半纤维素的质量, 单位g;c 为硫酸溶液的浓度,mol/L;V 为滴定消耗的硫酸标准溶液的体积,mL;n 为1 g 样品所抵消的酸的物质的量,mmol/g。
将结果输入Design-Expert 软件,使用响应曲面法计算半纤维素最佳醚化条件。
1.5 性能表征
1.5.1 傅里叶红外光谱(FTIR)检测
用傅里叶红外光谱仪对半纤维素(HC)和羧甲基半纤维素(CMHC)进行结构分析。
将待测的HC、CMHC 和溴化钾(KBr)放入105 ℃烘箱烘干4 h 后取出备用。 称量1 mg 样品和100 mg溴化钾,以m(待测样)∶m(KBr)=1∶100 的比例放入玛瑙研钵充分研磨,取适量粉末进行压片制样,然后用傅里叶变换红外光谱分析仪进行分析, 检测扫描范围400~4000 cm-1的波长。
1.5.2 扫描电子显微镜(SEM)分析
将羧甲基化改性前后得到的冻干样品 (HC 和CMHC)用导电胶粘在样品台上,使用10 mA 的喷金电流处理60 s 后,用扫描电子显微镜观察其微观结构。
1.6 抗氧化活性测定
采用DPPH 自由基清除能力、 羟基自由基清除能力、ABTS 自由基清除能力来评价半纤维素和羧甲基半纤维素的抗氧化活性。
1.6.1 DPPH 自由基清除能力测定
配制0.06 mmol/L 的DPPH 溶液; 将样品配制成4 mg/mL 的样液, 取15 个试管分别编号A1—A7、B1—B7 和A0,在试管A1—A7 中分别加入3 mL梯度稀释的样液, 再在每个试管中分别加入3 mL DPPH 溶液;试管B1—B7 中则使用3 mL 无水乙醇代替配制的DPPH 溶液;A0 试管为空白对照,用3 mL蒸馏水代替样液,再加入3 mL 配制的DPPH 溶液。最后,将所有试管于25 ℃水浴避光反应30 min。 用紫外分光光度计于517 nm 波长处测定样液吸光度。 根据式(3)计算样品对DPPH 自由基的清除率。
式中:A0为空白对照的吸光度;AA为A 组各浓度样品的吸光度;AB为B 组各浓度样品的吸光度。
1.6.2 羟基自由基清除能力测定
配制4.5 mol/L FeSO4溶液、3 mmol/L 水杨酸溶液、2.9 mmol/L H2O2溶液; 分别称取半纤维素和羧甲基半纤维素样品,配制成4 mg/mL 的样液;取15 个试管,分别编号为A1—A7、B1—B7 和A0,在试管A组试管中分别加入3 mL 梯度稀释的半纤维素样液, 接着在A 组每个试管加入1 mL 亚硫酸铁溶液和1 mL 水杨酸溶液,混合均匀,静置10 min。 B 组操作同上。 A0 试管为空白对照,用3 mL 蒸馏水代替样液。再在A 组每个试管中加入1 mL 稀释10 倍的H2O2溶液,B 组每个试管中加入1 mL 蒸馏水。放入37 ℃水浴锅中水浴反应15 min, 用紫外分光光度计于510 nm 波长处测量吸光度。 根据式(3)计算羟基自由基的清除率。
1.6.3 ABTS 自由基清除能力测定
配制7.4 mmol/L ABTS 储备液;配制2.6 mmol/L K2S2O8储备液;配制磷酸盐缓冲液(pH=7.4)。 制备ABTS 自由基溶液: 各取0.4 mL ABTS 储备液和K2S2O8储备液, 混合均匀后, 至于黑暗处室温放置12 h,然后用配制好的磷酸盐缓冲液稀释,使其在紫外734 nm 处的吸光度为0.7±0.02;称取一定量的样品,用蒸馏水配制4 mg/mL 的样液,并梯度稀释。 取13 个试管,编号为A1—A6、B1—B6 和A0,在A 组试管中依次加入3 mL 梯度稀释的样液,并加入3 mL ABTS 自由基溶液,使其迅速混合,在室温下避光静置6 min;B 组试管中以等体积的磷酸盐缓冲液代替ABTS 自由基溶液,A0 试管为空白对照,以3 mL 蒸馏水代替样液,其他步骤同A 组试管。 用紫外分光光度计于734 nm 波长处测定吸光度。 根据式(3)计算ABTS 自由基的清除率。
1.6.4 苯氧乙醇与CMHC 复配时的羟基自由基清除能力测定
配制4.5 mol/L FeSO4溶液、3 mmol/L 水杨酸溶液和2.9 mmol/L H2O2溶液。配制4 mg/mL 的羧甲基半纤维素样液。 取11 个试管,编号为A1—A5、B1—B5 和A0,加入3 mL 梯度稀释的羧甲基半纤维素样液,每个试管中再加入60 μL 2%苯氧乙醇溶液,A0试管为空白对照,用3 mL 蒸馏水代替样液。 在每个试管中加入1 mL 亚硫酸铁溶液和1 mL 水杨酸溶液, 放置10 min 后, 在每个试管中加入1 mL 稀释10 倍的H2O2溶液, 放入37 ℃水浴锅中水浴反应15 min,用紫外分光光度计于510 nm 波长处测量吸光度。 根据式(3)计算羟基自由基的清除率。
1.7 吸湿性和保湿性实验
1.7.1 吸湿性实验
配制碳酸钾溶液(相对湿度43%)和饱和硫酸铵溶液(相对湿度81%),各取100 mL 倒入烧杯于干燥器内平衡一夜。 精确称取2 份0.5 g 烘干的样品分别放入型号相同的称量瓶中,再放入干燥器中,分别记录放置0、4、8、12、24、48、72、96、144 h 时样品的质量,根据式(4)计算吸湿率。
式中:m0为初始时的样品质量,g;mt为放置一段时间后的样品质量,g。
1.7.2 保湿性实验
称取2 份0.5 g 样品, 分别加入到烘至恒重的称量瓶中,再滴入约0.2 g 去离子水,轻轻摇晃使样品充分浸湿, 将称量瓶分别放入装有300 g 变色硅胶和饱和碳酸钾(43%)的干燥器中,分别记录放置0、4、8、12、24、48、72、96、144 h 时样品的质量,根据式(5)计算保湿率。
式中:m0为刚添加去离子水时的样品质量,g;mt为放置一段时间后的样品质量,g。
1.8 抗菌活性实验
分别测定半纤维素、 羧甲基半纤维素以及苯氧乙醇的抑菌效果, 并测定苯氧乙醇与羧甲基半纤维素复配后的抑菌效果。
配制质量分数为4%的苯氧乙醇样液, 样液在超净工作台紫外灯下杀菌30 min。 将培养基、培养皿等实验操作仪器用121 °C 高压蒸汽灭菌30 min;将杀菌后的牛津杯放置在培养皿上, 然后将加热并灭菌的牛肉膏蛋白胨培养基溶液在超净工作台上倒入平板; 用移液枪吸取200 μL 菌液到凝固好的培养基表面,用涂布棒均匀涂抹;将牛津杯拔掉,称取一定量的HC 和CMHC 粉末分别倒入牛津杯形成的孔洞中并摇晃均匀,加入一定量的苯氧乙醇溶液;将培养皿置于36.8 ℃恒温培养箱中培养48 h,观察细菌生长情况,记录抑菌圈的大小。
2 结果与讨论
2.1 半纤维素羧甲基化改性
2.1.1 响应曲面实验结果分析
响应曲面设计及实验结果见表1, 在Design-Expert 软件中对数据进行多元拟合, 可得到醚化反应取代度对碱用量(x)、氯乙酸用量(y)和温度(z)三种因素的二次多项回归模型:

表1 响应曲面设计及实验结果
预测取代度与实际取代度之间的对比如图1 所示,可看出实际的取代度在预测值附近均匀分布,两者具有良好的相关性。

图1 实际取代度和预测取代度之间的关系
模型的校正决定系数R2=0.984 5,说明98.45%的响应变异性可用这个模型解释说明。 对模型进行方差分析,F=113.89,P<0.000 1, 说明模型可靠,模型有意义且达到极显著水平。 模型失拟项的F=3.14,P=0.148 8,说明失拟因素并不显著,因此可以用此模型来对半纤维素的羧甲基化实验结果进行分析和解释。
根据Box-Bennken 的模型设计结果, 对半纤维素羧甲基化改性实验的理论最佳实验条件是: 碱用量1.5 g、氯乙酸用量1.374 5 g、反应温度64.65 ℃,在此条件下的预测取代度为0.288 5。使用此优化条件进行实验验证,最终测得实际取代度为0.290 5。
以半纤维素羧甲基化的取代度为响应值, 碱用量、 氯乙酸用量和温度三个自变量与响应值之间关系如图2 所示。 由图2 可以看出: 每个自变量的变化都会对取代度的大小产生一定影响。 当碱用量、氯乙酸用量或者温度单方面增加时, 反应的取代度都是先增加后降低。 碱性条件产生醚化反应, 当碱用量过低,反应不完全;当碱用量过高,又会成副产物,所以碱用量过高或者过低都会导致取代度降低。当氯乙酸用量过低,羧甲基不够,反应不够充分;而氯乙酸用量过高,则会与碱进行反应,导致取代度降低。 醚化反应属于可逆反应, 温度过低或者过高都会影响反应结果,温度低时反应不够充分,温度高时则会产生其他副产物。

图2 CMHC 的取代度与自变量的三维关系图
2.2 性能表征
2.2.1 FTIR 分析
使用红外光谱对两种样品进行了分析,结果如图3所示。 从图3 可以看出:在3156、3328、3416 cm-1处的吸收峰是半纤维素中羟基(—OH)的拉伸振动,在2917 cm-1处的吸收峰是半纤维素中亚甲基(—CH2—)的拉伸振动, 在1614 cm-1处的吸收峰代表羧基(—COOH)中的(—C=O)非对称伸缩振动,在1400 cm-1附近是与羧基连接的甲基 (—CH3) 的振动,CMHC相对于HC 在1326 cm-1附近出现新的峰,这是羧甲基(—OCH2—COO—)的(C=O)对称拉伸振动,表明半纤维素羧甲基化改性成功。
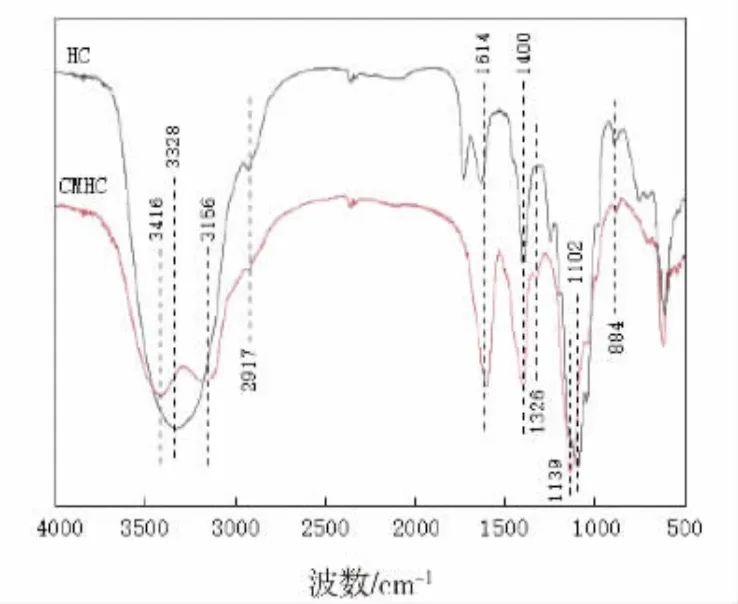
图3 HC 和CMHC 的红外光谱图
2.2.2 SEM 分析
用扫描电子显微镜对半纤维素和羧甲基半纤维素的微观结构进行观察,见图4。 由图4 可以看出:半纤维素粉末的颗粒较小,成絮状分布,颗粒表面凹凸不平, 颗粒间有较大空隙。 而改性后的羧甲基半纤维素粉末, 颗粒较大且光滑, 而且颗粒聚集度增大,结构更紧实,黏度更大。 经过对比发现,改性后的半纤维素颗粒表面发生变化,分子间结合力较强,分子间集聚较紧密,这是因为羧甲基极性较大,分子间氢键结合增强,使分子间更易发生团聚现象。

图4 HC 和CMHC 的微观形貌
2.2.3 单糖分析
采用高效液相色谱法测定桉木预水解液及从预水解液中提取的半纤维素中的单糖组分, 测定结果见表2。 测得预水解液中糖的总含量为4.21%,其中木糖含量占总糖含量的86.82%,含量最高;预水解液的糖组分中还存在3.91%的葡萄糖、6.34%的鼠李糖和2.93%的阿拉伯糖。 在半纤维素中糖的总含量占了38.64%, 木糖含量最高占了总糖含量的82.98%;在改性后的羧甲基半纤维素中糖的总含量为14.13%,其中也是木糖含量最高,占总糖含量的69.14%。

表2 预水解液和半纤维素中的单糖含量
2.3 抗氧化活性分析
2.3.1 DPPH 自由基清除能力
半纤维素和羧甲基半纤维素对DPPH 自由基的清除率见图5。 由图5 可知:在一定浓度范围内,对DPPH 自由基的清除率会随着HC 溶液浓度的降低而减小。当HC 浓度降低到一定程度时,清除率会趋于稳定。 结果表明HC 和CMHC 都有一定的清除DPPH 自由基的能力, 但是在相同浓度的情况下,CMHC 的清除能力明显比HC 的强, 证明CMHC 具有良好的抗氧化性。
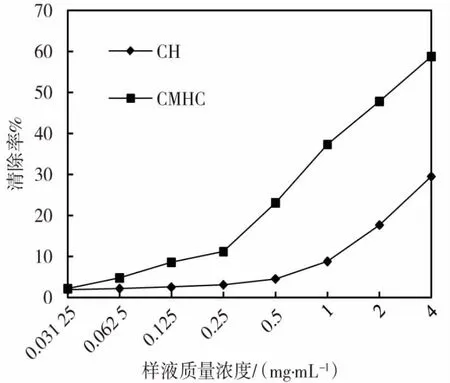
图5 HC 和CMHC 的DPPH 自由基清除率
用该方法测定DPPH 自由基清除率的原理为[12]:DPPH 自由基上存在单电子,该电子在520 nm 处有着较强的吸收峰, 溶解在醇溶液中会使液体呈现紫色。 当在溶液中加入具有抗氧化性的样液, 比如CMHC 溶液,CMHC 内未取代的羟基和羧甲基上的羧基可以与DPPH 自由基的电子相配对,溶液颜色变淡,520 nm 处的吸光度下降。 抗氧化剂浓度越大,溶液颜色越淡,吸光度值越低,即抗氧化性强的表现。
2.3.2 羟基自由基清除能力
图6 为HC 和CMHC 对羟基自由基清除率,在一定浓度范围内都是随着浓度的减少而降低。 在相同浓度下,CMHC 对羟基自由基的清除率比HC 更高,可得出CMHC 抗氧化性比HC 更好的结论。

图6 HC 和CMHC 的羟基自由基清除率
羟基自由基清除主要通过以下的两种机制[13]:(1)样品为羟基提供氢离子,从而使羟基还原;(2)样品与能活化过氧化氢的过度金属离子(比如Fe2+)螯合, 来抑制羟基自由基的还原。 所以羧甲基化半纤维素清除羟基自由基的过程可能是由于后期引入的羧甲基基团跟Fe2+离子反应,抑制过氧化氢活化,从而抑制了反应中羟基自由基的产生, 同时清除羟基自由基的能力提高,即抗氧化性提高。
2.3.3 ABTS 自由基清除能力
从图7 可以看出: 随着样液浓度的降低,ABTS自由基清除率也随之降低。在相同浓度下,CMHC 的ABTS 自由基清除率比HC 略高,但差距不大,两种样品对ABTS 自由基都具有良好的清除效果。

图7 HC 和CMHC 的ABTS 自由基清除率
ABTS 自由基清除实验与DPPH 自由基清除实验一样, 都是用于测量评价样品是否具有抗氧化活性的经典方法。 DPPH 与有色抗氧化剂反应过程中在500 nm 处存在吸收峰,会影响干扰检测结果;而ABTS 的吸收峰在700 nm 处,有色氧化剂就没那么容易对检测结果产生干扰[14]。 因此ABTS 自由基清除实验更加常用。
2.3.4 苯氧乙醇与CMHC 复配时的羟基自由基清除能力
在不同浓度CMHC 溶液中加入60 μL 浓度为2%的苯氧乙醇溶液, 实验样液对羟基自由基的清除率见图8。可以发现,随着CMHC 溶液浓度的下降实验样液对羟基自由基的清除能力也随之减小。将3.3.2实验时的清除率与本次实验在样液浓度为4 mg/mL时对羟基自由基清除率作对比, 可以发现清除率由42.75%提高至了51.76%,说明加入苯氧乙醇进行复配对羟基自由基清除率有增效作用。

图8 苯氧乙醇与CMHC 复配的羟基自由基清除率
2.4 吸湿性和保湿性
2.4.1 吸湿性
图9(a)为在相对湿度为43%的环境中HC 和CMHC 的吸湿率变化。可以看出:随着时间增加,HC和CMHC 的吸湿率均增大,其中HC 的吸湿率在0~12 h 内增大较明显, 在48 h 后几乎不变;CMHC 的吸湿率在0~48 h 内的增大幅度较大, 在48 h 后趋于平缓,达到饱和状态;CMHC 的吸湿效果明显强于HC。
图9(b)为在相对湿度为81%的环境中HC 和CMHC 的吸湿率变化。可以看出:随着时间增加,HC和CMHC 的吸湿率均增大,其中HC 的吸湿率在0~48 h 内增大较明显, 而在72 h 后几乎平稳保持不变;CMHC 的吸湿率在0~72 h 内大幅度增加,在144 h后趋于平缓,达到饱和状态;CMHC 的吸湿效果明显强于HC。
综合图9(a)和图9(b)可知:在相对湿度较大的环境中,样品的吸湿率也更高;在相同湿度条件下,CMHC 的吸湿率明显地大于HC, 说明CMHC 的吸湿效果优于HC。

图9 HC 和CMHC 在不同相对湿度时的吸湿率变化
2.4.2 保湿性
图10 (a) 为在43%的相对湿度环境中HC 和CMHC 的保湿率变化。可以看出:二者的保湿率均一直下降直至平稳,其中HC 的保湿率在0~48 h 均匀下降, 在48 h 后稳定保持在21%左右;CMHC 的保湿率在0~24 h 内均匀下降, 在24 h 后就稳定保持在46%左右。
图10(b)为在干硅胶作用下,HC 和CMHC 的保湿率变化。 可以看出:此时的水分流失比在43%相对湿度环境下更快,HC 的保湿率在72 h 后平稳保持在3%,CMHC 的保湿率在144 h 时保持在8%。在两组实验中,CMHC 的保湿率均高于HC。

图10 HC 和CMHC 在不同条件下的保湿率变化
2.5 抗菌活性实验
HC、CMHC 和苯氧乙醇的抑菌效果如图11 所示。由图11 中A1 和A2 可知,CMHC 和苯氧乙醇在两个菌板上均出现明显的抑菌圈, 但抑菌圈的大小有差别,HC 的抑菌圈不明显,说明CMHC 和苯氧乙醇对两种细菌都有抑制效果,但抑菌能力有所差别。对比A2 和B 可知,CMHC 和苯氧乙醇复配可以在苯氧乙醇的使用量减半时依旧获得较好的抑菌效果, 说明多糖作为天然防腐剂应用在化妆品中是具有可行性的。 由C1 和C2 可知,CMHC 的抑菌圈随着其用量的增多而增大,说明在一定范围内,抑菌能力与其用量成正比。

图11 HC、CMHC 和苯氧乙醇的抑菌效果
通过实验可以推断出CMHC 具有良好的抗菌性,将HC 进行羧甲基化改性可以提高其抑菌能力。而CMHC 与苯氧乙醇复配效果比单独使用苯氧乙醇的抗菌效果更好。
3 结论
本文以造纸工业中的桉木预水解液为原料,采用乙醇沉淀法进行半纤维素的分离提纯, 并根据其结构特点进行醚化改性,生成羧甲基半纤维素,并对这两种产物进行一系列的表征与讨论。 经过实验得出的主要结论如下:
(1)以桉木预水解液为原料,按照流程进行分离纯化各组分, 并测定预水解液和提取出来的半纤维素中糖组分的含量,确定二者中糖含量最高的是木糖。
(2) 以桉木预水解液中提取出来的半纤维素为原料,在碱性条件下加入氯乙酸进行醚化改性,生成羧甲基半纤维素 (CMHC)。 为获得取代度最大的CMHC, 通过响应曲面法获得了半纤维素羧甲基化实验的最佳条件:碱用量1.5 g,氯乙酸用量1.37 g,反应温度65 ℃,在此最佳工艺条件下预测取代度为0.288 5,最终测得取代度为0.290 5,在预测值合理范围内。
(3)对预水解液中提取的HC 和醚化后的CMHC进行红外和电镜表征。使用红外表征发现1400 cm-1和1614 cm-1处吸收峰增强,1326 cm-1处出现新的吸收峰, 表明半纤维素羧甲基化成功。 通过电镜可以看出CMHC 的粉末颗粒较大且光滑,是因为羧甲基化后分子结合力增强,羧甲基极性较大,分子间氢键结合增强,分子间更易团聚。
(4)对制取的HC 和CMHC 进行生物活性实验,发现改性得到的羧甲基半纤维素抗氧化能力以及吸湿性、保湿性都有所提高。通过抗菌实验发现CMHC具有良好的抗菌性, 并且与苯氧乙醇复配后的抗菌效果比单独使用苯氧乙醇的效果更佳。
本文秉持绿色循环发展的理念, 研究了从造纸工业向生物质精炼方向转变中关于预水解液提取半纤维素并加以利用的实验, 这在未来有很好的发展前景,在食品、医疗、化妆品等领域具有研究价值。生物质精炼符合国家绿色环保、可持续发展的理念,也为未来造纸工业开辟了新的发展领域。


