CT定量分析急性呼吸窘迫综合征模型兔肺复张呼气末正压通气最佳压力
郝文瀚,那巍兰,李邑刍,曲 东,袁新宇,闫淯淳*
(1.首都儿科研究所附属儿童医院放射科,2.重症医学科,北京 100020)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是肺内和/或肺外原因引起的以顽固性低氧血症及非心源性肺水肿为显著特征的急性弥漫性炎症性肺损伤。肺保护性通气策略现已取代传统机械通气成为治疗ARDS的主要手段,肺复张呼气末正压(positive end expiratory pressure,PEEP)通气为其中的重要环节[1],可使塌陷的肺泡复张,减少肺内分流,改善低氧合状态,避免肺泡反复开闭引起的呼吸机相关性肺损伤并改善预后。CT可显示肺内充气状态,即肺泡对PEEP的反应程度,为定量评价肺复张效果的最佳影像学方法[2-5],但用于肺复张的PEEP尚无统一标准[6-7]。本研究基于兔ARDS模型观察CT定量分析不同PEEP对肺通气影响的价值,并确定最佳PEEP。
1 材料与方法
1.1 实验动物 10只成年雄性日本大耳兔[北京金牧阳实验动物养殖有限责任公司提供,许可证号:SCXK(京)2029-0002],月龄(4.50±0.41)月,体质量(2.71±0.56)kg。本研究经医院伦理委员会批准(KSSHERLL2018005)。
1.2 制备动物模型 经耳缘静脉以流率5 ml/h注射米达唑仑,并留置麻醉针;成功麻醉后,将动物仰卧位保定于实验台上,连接动物心电监护仪,行气管插管机械通气;于10 min内经耳缘静脉注入油酸(0.1 ml/kg体质量)及20 ml生理盐水,并于90 min后行动脉血气分析,以氧合指数<300 mmHg持续至少30 min为ARDS模型建模成功,并以呼吸机构建压力-容积曲线的最低拐点对应压力维持通气[8]。
1.3 通气设置 采用Mindray SV300 呼吸机,压力控制通气模式,小潮气量(6~8 ml/kg),平台压9 cmH2O,吸气峰压12 cmH2O,吸入气氧浓度40%,呼吸频率35次/分,PEEP 4 cmH2O。
1.4 仪器与方法 采用GE Discovery 750HD CT仪。将动物仰卧位保定于实验台上,于4 cmH2O PEEP下行肺通气,每通气1 min后增加4 cmH2O,直至28 cmH2O。分别于不同PEEP下行全肺扫描,管电压100 kVp,自动管电流控制开启,层厚0.625 mm,螺距1.375∶1,转速0.4 s/rot。
1.5 图像分析 采用3D Slicer v4.11软件。分别于气管隆嵴水平、隆嵴下1 cm及膈上1 cm层面勾画肺脏轮廓,按CT值将其分为不通气区(-100~100 HU)、低通气区(-500~-101 HU)、正常通气区(-800~-501 HU)及过度通气区(-1 000~-801 HU)[9-10],并计算各通气区在上述3个层面中的面积占肺组织比值的平均值,分别记为Rnon、Rlow、Rnormal及Rover。
1.6 统计学分析 采用SPSS 26.0 统计分析软件。以±s表示符合正态分布的计量资料,采用t检验或方差分析行组间比较;以中位数(上下四分位数)表示非正态分布的计量资料,采用Kruskal-WallisH检验进行组间比较。建立各通气区面积占比与PEEP之间的回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 不同PEEP对肺通气的影响 建立ARDS模型前、后各通气区面积占比差异均有统计学意义(P均<0.05),见图1、表1。

表1 建立ARDS模型前、后兔肺各通气区占比变化(%,n=10)

图1 大耳兔,4月龄,2.7 kg体质量 A、B.建立ARDS模型前肺CT图(A)及伪彩图(B)示肺组织充气良好,Rnormal=83.23%(绿色),Rnon(红色)及Rlow(黄色)均不足1%,Rover=15.70%(蓝色);C、D.建立ARDS模型后肺CT图(A)及伪彩图(B)示肺内大片磨玻璃及实变影,以背侧为重,肺组织充气不良,Rnormal减少至30.55%(绿色),Rnon(红色)及Rlow(黄色)分别为10.23%和50.72%,Rover=8.50%(蓝色)
肺复张过程中,随PEEP增高,肺内实变影逐渐变为磨玻璃影,之后逐渐消失;肺野透亮度逐渐增高,肺整体密度减低;不通气区与低通气区逐渐减少至基本消失,正常通气区首先增大,之后被过度通气区所取代而逐渐缩小。见图2。

图2 大耳兔,4月龄,2.7 kg体质量 肺复张过程中的肺伪彩图(上排)及CT图(下排) (红色:不通气区;黄色:低通气区;绿色:正常通气区;蓝色:过度通气区)
肺复张过程中,随PEEP逐渐升高,Rnon、Rlow、Rnormal及Rover均变化明显(P均<0.05):PEEP取4、8及12 cmH2O时,Rnon两两比较差异均有统计学意义(P均<0.05);PEEP取2、16、20、24及28 cmH2O时,Rnon两两比较差异均无统计学意义(P均>0.05);PEEP为4、8、12及16 cmH2O时,Rlow两两比较差异均有统计学意义(P均<0.05);PEEP为12 cmH2O时的Rnormal明显高于PEEP为4、20、24、28 cmH2O时(P均<0.05),而与PEEP为8、16 cmH2O时差异均无统计学意义(P均>0.05);PEEP取12、16、20、24及28 cmH2O时,Rover两两比较差异均有统计学意义(P均<0.01)。见表2。

表2 不同PEEP下ARDS模型兔肺各通气区面积占比(%,n=10)
2.2 最佳PEEP 不同通气区占比与PEEP关系的回归模型分别为Rnon=50.11 PEEP-1.67(r2=0.45,P<0.001),Rlow=-14.17 ln (PEEP)+54.21(r2=0.53,P<0.001),Rnormal=-0.09 PEEP2+2.29 PEEP+45.92(r2=0.21,P<0.001),Rover=1.88 PEEP-3.83(r2=0.56,P<0.001);据此得出Rover对应最佳PEEP为16.14 cmH2O,以之为过度充气压力基线绘制的拟合曲线(图3)显示,Rnon及Rlow首先明显减小,至最低拐点后趋于平缓;Rnormal先增大至理论峰值,之后逐渐减小;Rover则呈线性增大趋势。
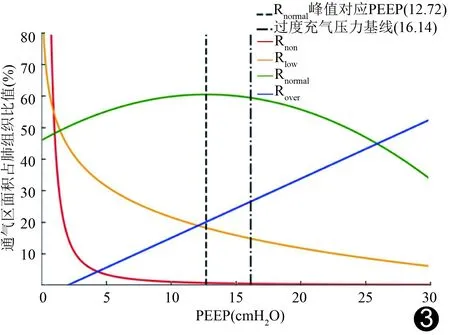
图3 ARDS模型兔肺各通气区R-PEEP最佳拟合曲线
Rnormal达峰值时,Rnon-PEEP曲线及Rlow-PEEP曲线均已出现最低拐点,且Rover未超越过度充气压力基线(16.14 cmH2O),此时10只兔ARDS模型共30个层面CT图像中的Rnormal峰值对应最佳PEEP平均值为(12.48±5.72)cmH2O。
3 讨论
ARDS患者最主要肺部改变为含气组织减少[11],故复张塌陷的肺泡非常重要。ARDS的柏林定义中,肺复张PEEP标准为10~15 cmH2O,但该标准针对所有ARDS患者,而未能实现个体化及精准化[12-13]。目前基于CT的“最佳”PEEP研究报道较少。本研究构建兔ARDS模型,以CT定量分析各通气区不同PEEP下的面积占比,观察肺内通气变化,以此确定“最佳”PEEP。
本研究发现不同通气区对PEEP变化的反应并不一致,以不通气区变化速度最快,主要由于该区肺泡多处于几乎不含气状态,其内气压低,对压力变化的敏感性最高,PEEP=4、8、12 cmH2O时,Rnon两两比较差异均有统计学意义,而PEEP>12 cmH2O时,Rnon无明显变化,提示就不通气区而言,“最佳”PEEP为12 cmH2O;低通气区肺泡内含少量气体,随PEEP增大,Rlow变化趋势较Rnon缓和,当PEEP>16 cmH2O时,Rlow无明显变化,即其“最佳”PEEP值为16 cmH2O;PEEP=8、12、16 cmH2O时,Rnormal无明显变化,且全部30个层面图像中,14个层面(46.67%,14/30)于PEEP为12 cmH2O时可见最大Rnormal。以上结果提示,肺通气主要表现为不通气区逐渐转化为低通气区及正常通气区,当其各自达到“最佳”PEEP时,通气不良大部分得以改善,正常通气区多达到峰值;此后则随PEEP增大,逐渐表现为过度通气。
既往研究[14-15]报道,Rnormal增大与氧合改善有关,而Rover增大则对氧合无明显改善,主要原因在于过度膨胀的肺泡可压迫周围间质而增大肺血管阻力,增加系统性损伤风险[13,16];故设定肺复张的“最佳”PEEP时,应注意避免过度通气。本研究针对ARDS模型兔所获“最佳”PEEP为(12.48±5.72)cmH2O,接近于回归曲线所示理论值,且未超越过度充气压力基线。
本研究的主要不足:①样本量小;②基于兔模型进行观察,有待进一步验证;③未分析影像学改变与临床症状改善的一致性及其与PaO2的相关性;④在Rnormal峰值附近的PEEP区间(8~16 cmH2O)内,可采用小压力梯度进行分析,以获得较精确的变化趋势。
综上所述,CT可有效评估ARDS兔肺PEEP通气效果,推荐PEEP为(12.48±5.72)cmH2O。

