微生物注浆加固某金属尾砂过程中同步生物脱氮试验研究
郑槐淼,伍玲玲,胡 林,张志军,田亚坤,刘 迪,潘宇翔*
(1.南华大学 经济管理与法学学院,湖南 衡阳 421001;2.湖南省矿山岩土工程灾害预测与控制工程技术研究中心,湖南 衡阳 421001;3.南华大学 资源环境与安全工程学院,湖南 衡阳 421001)
0 引 言

本研究拟通过研究具有生物矿化和胶结功能的优势菌株,利用生物脱氮技术,建立微生物注浆加固的优化技术,并采用所构建的微生物注浆加固试验装置展开实验研究。这对于丰富和完善微生物注浆加固岩土理论、创新和发展尾矿坝加固技术,具有重要的理论意义和实际意义。
1 试验材料
1.1 培养基
混合培养基:酪蛋白胨15 g,大豆蛋白胨5 g,氯化钠5 g,尿素20 g,氯化镍0.001 3 g,琥珀酸钠32.9 g,维氏盐溶液50 mL,去离子水950 mL,pH为9.0。其中,尿素溶液采用圆筒式不锈钢加压除菌过滤器分别通过0.45 μm和0.22 μm的微孔透膜进行过滤除菌,其余成分溶液采用加压蒸汽灭菌法在121 ℃状态下灭菌20 min。制备完毕后,将上述两种溶液进行混合即可得到所需的培养基。
1.2 尾砂
试验所用的尾砂取自湖南省某尾矿库干滩,取样前先削去地表枯枝落叶以及约0.1 m厚的表层,然后开挖至距地表2 m并进行剖面整修、清理,选取砂层中心典型部位取出尾矿砂样(见图1)。依据《公路土工试验规程》(JTG 3430—2020),测得原位尾砂密度为2.040 g/cm3,天然含水率为12.1%,干密度为1.825 g/cm3,孔隙比为0.476,相对密度为2.87。其中,由于原样尾砂颗粒粒径均未超过2 mm,因此筛分试验选取孔径分别为1.68、0.83、0.50、0.35、0.25、0.20、0.18、0.14、0.10和0.075 mm的标准筛,按由小到大、自上而下的顺序堆叠,在最上层标准筛内放置烘干尾砂试样200 g,进行多组颗粒分析试验,以其均值作为筛分试验结果,绘制出尾砂颗粒粒径分布图,如图2所示。尾砂颗粒粒径大于0.075 mm部分的质量未超过总质量的85%,属于尾粉砂。此外,该尾砂的不均匀系数CU<5,曲率系数CC>1,根据《土的工程分类标准(附条文说明)》(GB/T 50145—2007),说明尾砂样颗粒比较均匀,属于级配不良砂土。

图1 风干后的尾砂样品Fig.1 Air-dried tailing sand samples
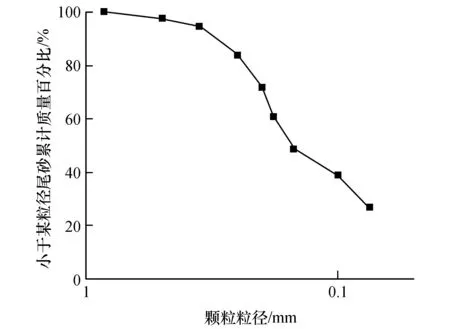
图2 尾砂样品颗粒级配累计曲线Fig.2 Cumulative particle gradation curve of tailing sand samples
1.3 尾砂体注浆加固装置
为避免在钻取和制备砂样过程中,对加固尾砂产生扰动或损伤,尾砂体注浆试验采用的填砂管为沿轴线对半可拆合的透明有机玻璃管,填砂管内径为39.1 mm(与土三轴试验土样直径一致),高度为12 cm。将可拆合的两瓣透明有机玻璃管内壁涂抹凡士林后拼合,在管的外壁用止水胶带粘合预制拆合缝,并在管的上下两侧套箍不锈钢固定约束箍,以防止在制备尾砂柱和注浆过程中填砂管变形。在填砂管上下侧加塞带贯通玻璃管的橡胶塞,上部右侧注浆口与蠕动泵之间用硅胶软管进行连接,上部左侧预留排气口,下侧设置出水口,出水口套置带止水阀的硅胶软管。为防止制作模型和注浆时砂土进入注浆管和出水口,在有机玻璃管两侧各设置4层纱布。同时,为防止注浆过程中出现对尾砂的冲刷和注浆口部堵塞现象,尾砂柱两侧各铺设5 mm厚的砂砾层(砂砾粒径为2 mm±0.1 mm),试验模型装置及尺寸如图3所示。尾砂柱高度为90 mm,采用水密法分层制备,密度为2.040 g/cm3。
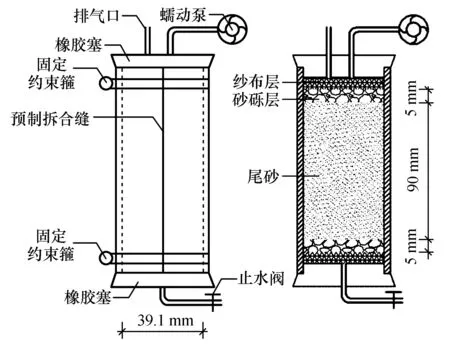
图3 尾砂体注浆加固试验装置图Fig.3 Diagram of tailings grouting reinforcement test device
2 试验方法
2.1 菌群共生溶液培养试验
为在后续的尾砂注浆试验筛选出能与巴氏芽孢杆菌共生的最优同步硝化反硝化菌,开展菌群共生溶液培养试验。试验菌株为巴氏芽孢杆菌和前期筛选出的3株优势同步硝化反硝化菌。取12组250 mL锥形瓶灭菌后各加入100 mL混合培养基,并接入1 mL OD600值为1.0±0.05的巴氏芽孢杆菌菌液,然后分别接入1 mL OD600值为1.0±0.05的同步硝化反硝化菌菌液。将锥形瓶置于恒温振荡培养箱中进行振荡培养,转速控制在150 r/min,温度设值在30 ℃。分别在培养4、8、16和24 h时间点各取出1组不同菌群组合的锥形瓶,测定了培养液中细菌数量、pH值、氨氮浓度及硝氮浓度。试验设置3份平行样,结果取其平均值。
2.2 MICP注浆加固尾砂试验
尾砂体注浆试验如图4所示,制备39个尾砂柱,通过蠕动泵缓慢地向尾砂柱内注入去离子水,排出填砂管内的气体使其达到饱和,调节蠕动泵和出水口的止水阀控制流速为0.5 mL/min,带出砂柱内少量的泥质和杂质(防止影响OD600的测定),间隔一定时间检测出水口处流出液体的OD600值,其值基本达到0即可。过程中记录尾砂柱达到饱和状态所需的注水量,以该注水量为后期进行尾砂体微生物注浆试验所灌入溶液的总体积。
试验分两组进行,第一组为微生物注浆同步脱氮试验组(巴氏芽孢杆菌+最优同步硝化反硝化菌TD-9+混合培养基+CaCl2溶液),第二组为微生物注浆空白对照试验组(巴氏芽孢杆菌+无菌水+混合培养基+CaCl2溶液),具体注入量详见表1。注浆时关闭下部橡胶塞出水口的止水阀,注浆完毕后使注浆液在砂柱内部静置反应24 h,然后打开止水阀排出砂柱内液体,然后重新注入反应溶液。

图4 尾砂体注浆试验过程图Fig.4 Process diagram of tailings grouting test
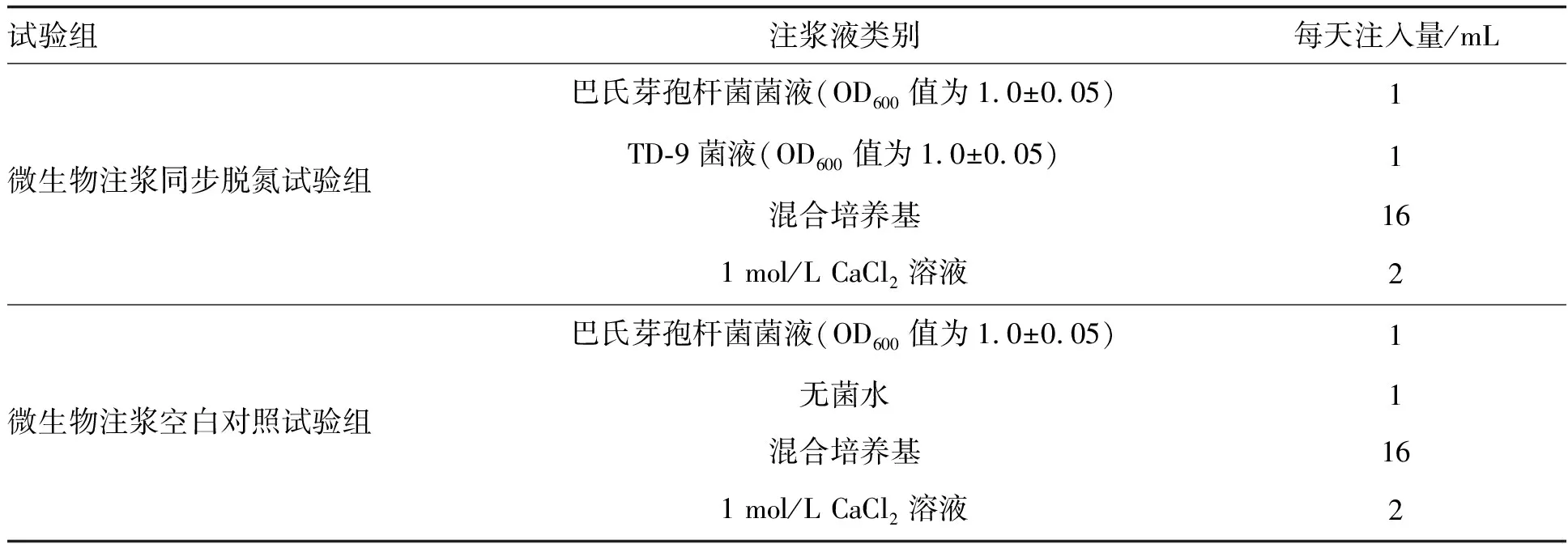
表1 尾砂体注浆各试验组反应液注入量Table 1 Injection volume of reaction fluid for each test group of tailing sand body grouting
试验共进行12 d,每天收集各试验组排出液,测定排出液中细菌数量、pH值、氨氮浓度和硝氮浓度。并分别在注浆反应2、4、6、8、10和12 d后,从两组试验组各拆取出3个尾砂试样,在100 kPa围压下采用全自动应变控制式三轴仪(南京,型号LH-TTS-1F)进行三轴固结不排水试验,试验过程中,采集应变-应力数据。
2.3 检测方法
2.3.1 细菌数量的测定
细菌数量通过测量菌液的吸光度(比浊法)来表示。试验使用蛋白核酸测定仪(德国,型号Biophotometer)来测定菌悬液OD600值,并将数值代入公式(1),以换算出溶液环境中实际的细胞总数。该式仅在OD600值为0.2~0.8范围内才可以使用,若超过此范围,需稀释后再进行换算。
Y=8.59×Z1.362 7×104
(1)
式中,Z为OD600数值;Y为细菌浓度,个/μL。
2.3.2 pH值的测定
试验采用精密台式pH计(美国,型号HQ411D)对溶液的pH值进行测定。
2.3.3 氨氮浓度及硝氮浓度的测定
取50 mL离心管分别装取40 mL不同菌株的培养物上清液后,置于冷冻离心机(德国,型号Z-36HK)中以8 000 r/min的转速离心20 min后,用移液枪取10 mL离心上清液于50 mL比色管中,采用《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)和《土壤硝态氮的测定紫外分光光度法》(GB/T 32737—2016)测定溶液中的氨氮浓度及硝氮浓度。
3 试验结果分析与讨论
3.1 菌群共生溶液培养试验结果分析
3.1.1 细菌数量和pH变化规律
通过对巴氏芽孢杆菌分别与3株同步硝化反硝化菌株进行共生溶液培养试验,得到OD600与pH值随时间变化曲线图,如图5所示。
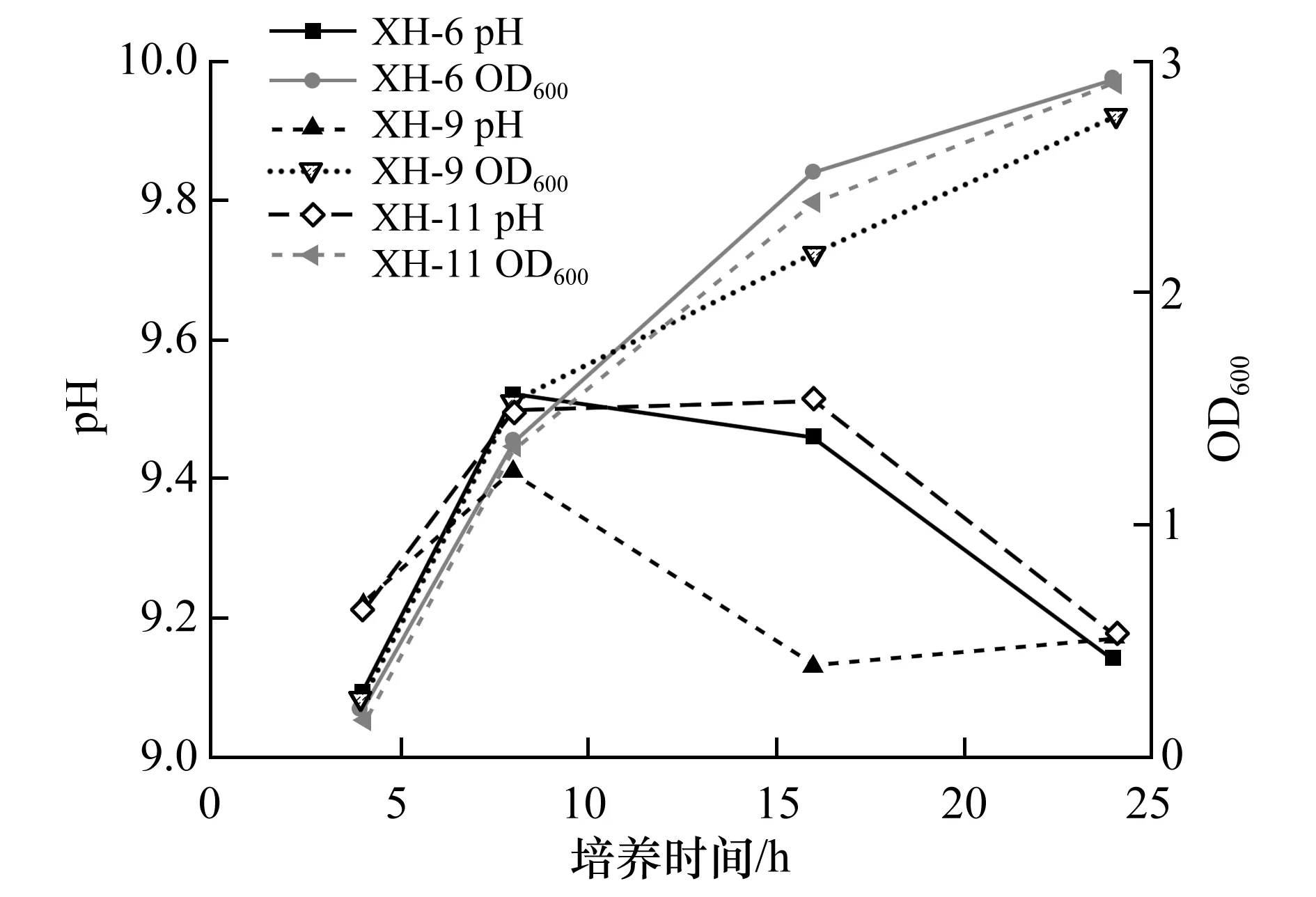
图5 混合培养液中OD600及pH值随时间变化曲线图Fig.5 Variation curves of OD600 and pH in mixed culture solution with time
从图5可知,3组混合培养液中OD600值随培养时间的变化呈现相近的快速增长规律,且与原始培养环境中巴氏芽孢杆菌OD600值变化规律无较大差异,这表明引入这3株菌进行同步硝化反硝化作用对巴氏芽孢杆菌活性不会产生影响。同时,通过实测溶液pH值可知,菌群均处于其最适pH生长范围。
3.1.2 氨氮和硝氮浓度变化规律
氨氮和硝氮浓度随培养时间变化曲线图,如图6所示。从图6可知,3组试验溶液中硝氮浓度一直维持较低水平且符合饮用水标准的要求,氨氮浓度随培养时间的变化呈现先快速上升后下降的规律,其中,TD-9表现出的氨氮去除能力与TD-6和TD-11相比相对较强。
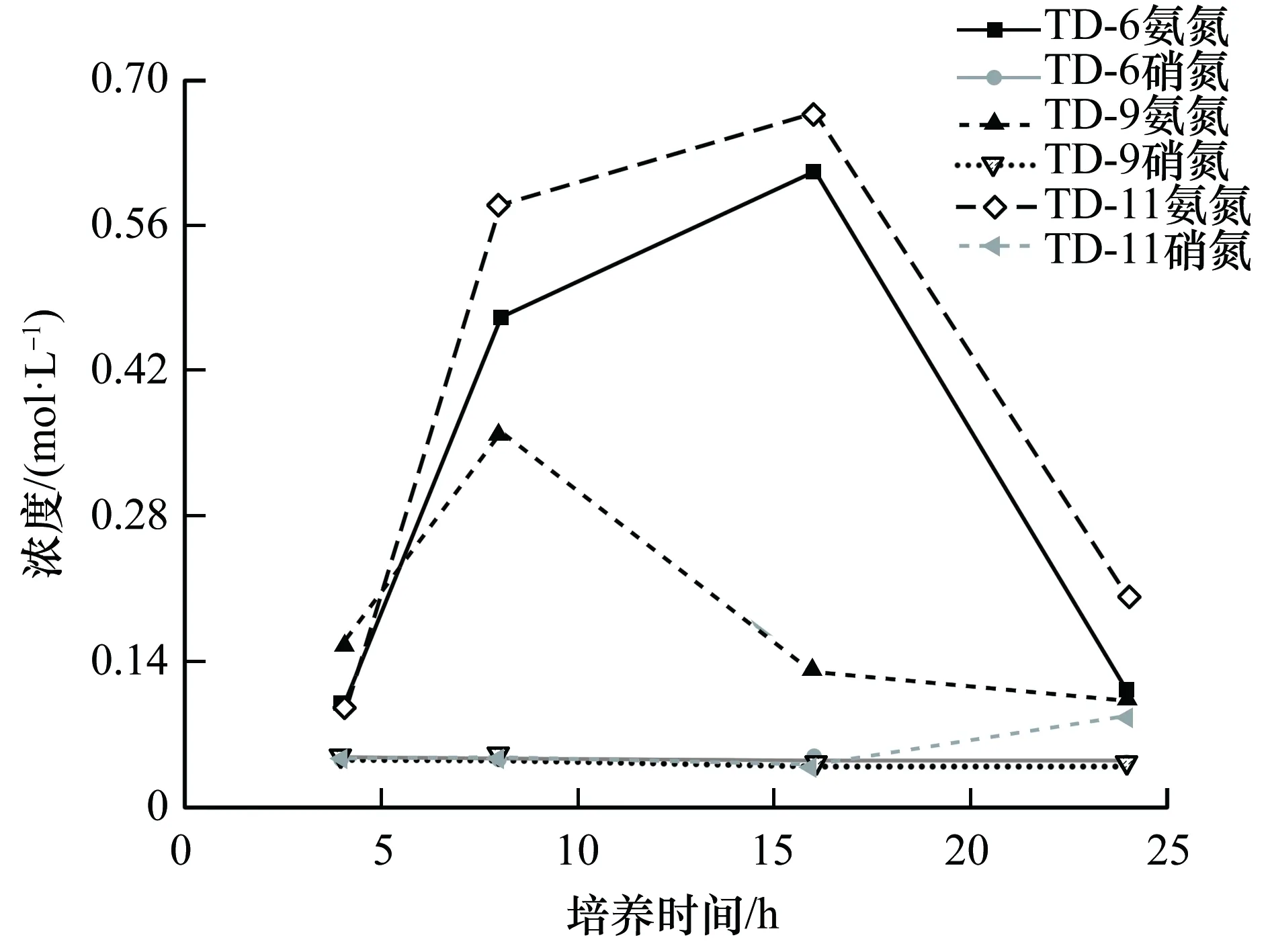
图6 氨氮和硝氮浓度随培养时间变化曲线图Fig.6 Curves of ammonia and nitrate nitrogen concentrations with incubation time
3.2 尾砂注浆排出液成分测定的分析
3.2.1 OD600和pH变化规律
挑选前期从溶液试验中筛选和培育出的最优菌株TD-9与巴氏芽孢杆菌进行尾砂环境下的微生物注浆加固试验。通过对排出液进行测定,得到其OD600与pH值随注浆加固时间变化曲线图,如图7所示。
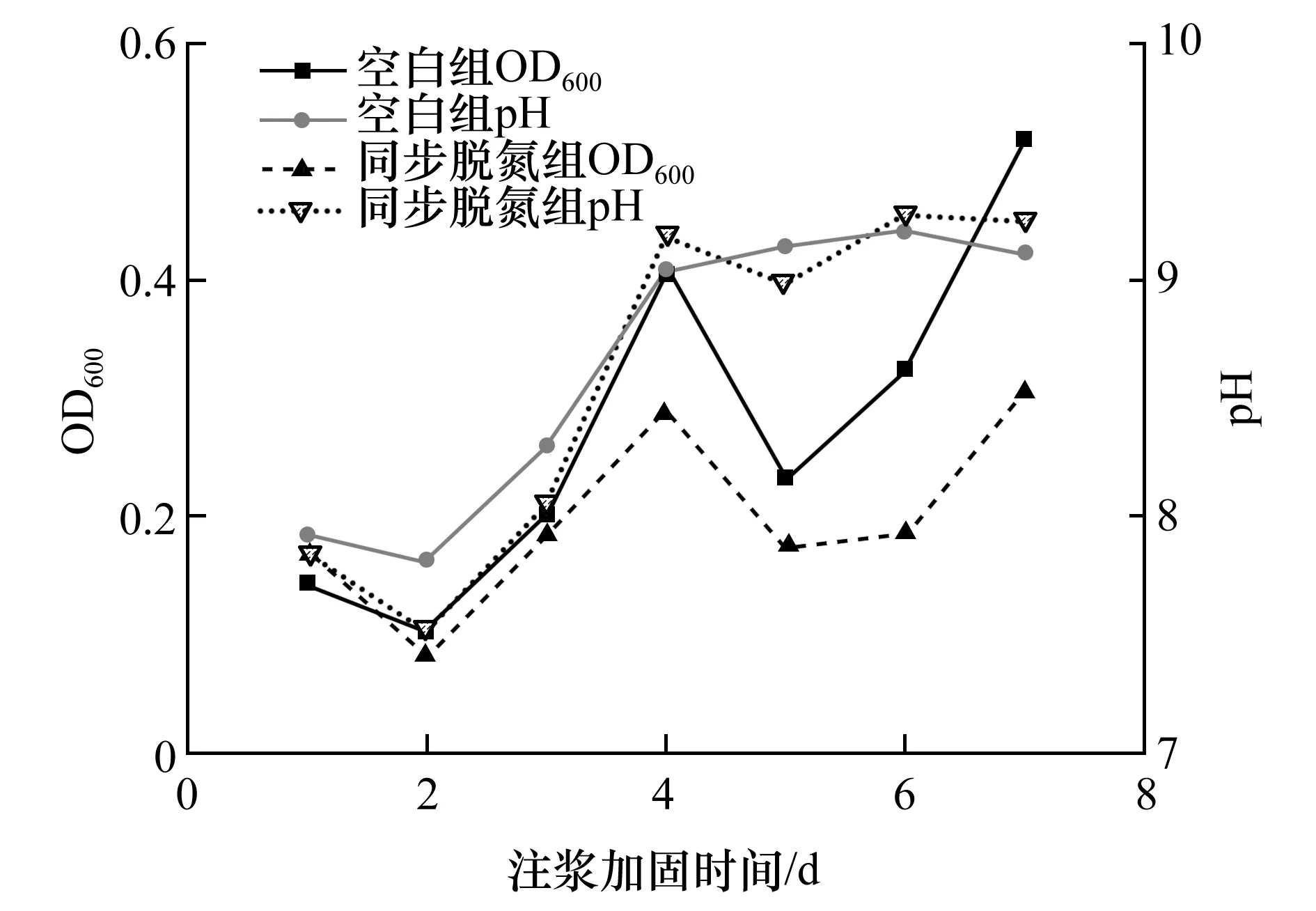
图7 排出液中OD600及pH值随时间变化曲线图Fig.7 Curve of OD600 and pH in the discharge fluid with time
从图7可知,2组试验排出液中OD600值随时间的变化呈现相近规律,经过2 d的适应阶段,菌株开始活性上升并大量繁殖,但同步脱氮组的OD600值与空白对照组相比相对较低,这表明在尾砂环境下引入微生物同步硝化反硝化作用会对巴氏芽孢杆菌活性产生一定影响但影响不大。同时,通过实测溶液pH值可知,在完成4 d注浆后菌群处于其最适pH生长范围。
3.2.2 氨氮和硝氮浓度变化规律
从图8可知,2组试验排出液中氨氮和硝氮浓度随时间的变化呈现相近规律,其中排出液中硝氮浓度一直维持较低水平且符合饮用水标准的要求,同步脱氮组的氨氮浓度与空白对照组相比有一定程度的降低,但没有明显降低,一方面是因为在尾砂环境中有氯化钙参与反应,且TD-9可能存在与维持其脱氮作用的营养底物接触不够充分。另一方面是因为在巴氏芽孢杆菌强脲酶活性的作用下,尿素快速水解,而脱氮菌株同步硝化反硝化速率无法跟上氨氮生成速率,使得排出液中氨氮浓度仍呈现快速上升趋势。
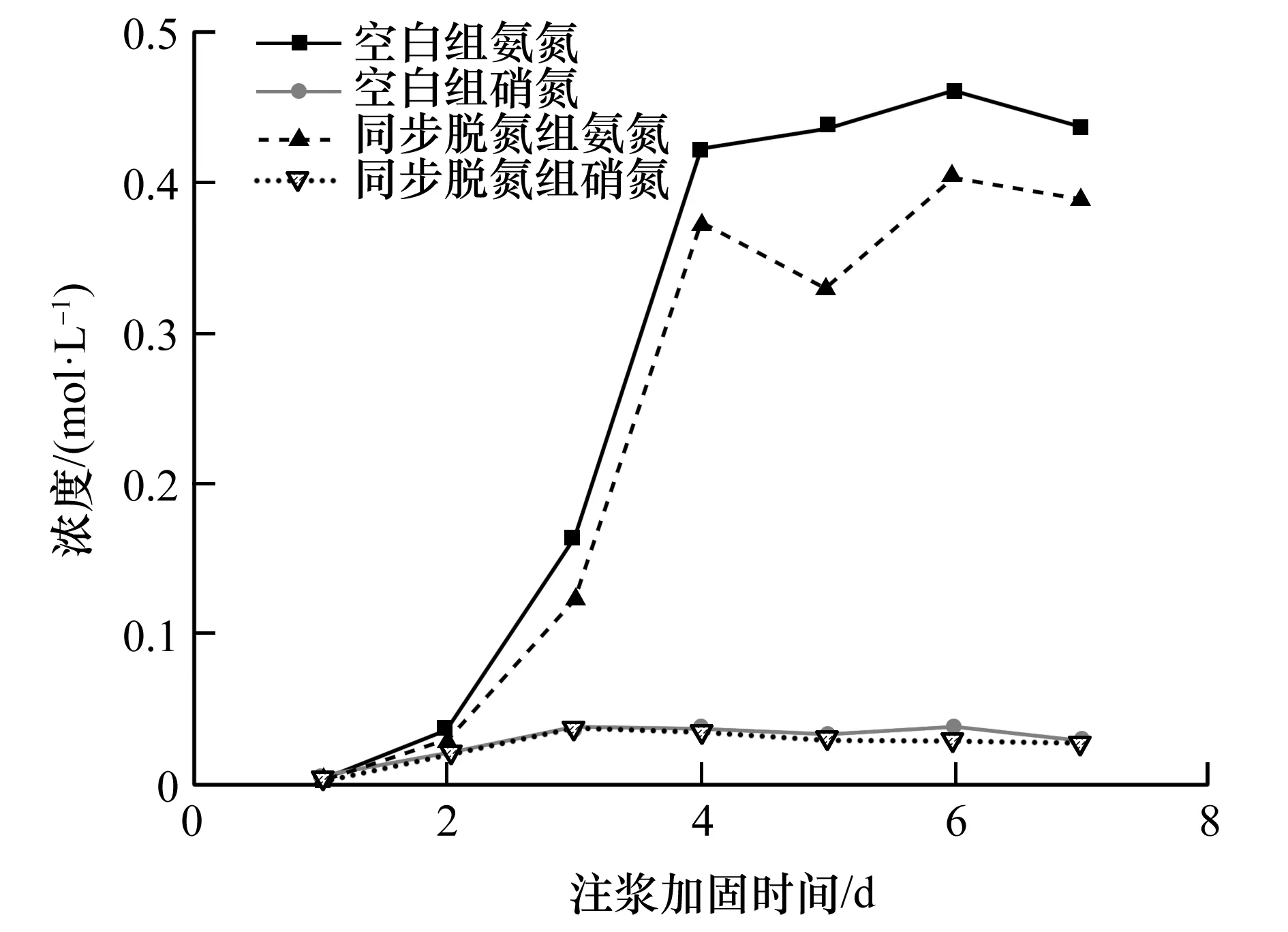
图8 氨氮和硝氮浓度随注浆加固时间变化曲线图Fig.8 Curves of ammonia and nitrate nitrogen concentrations with grouting reinforcement time
3.3 力学性能分析
3.3.1 应力应变曲线
采用全自动应变控制式三轴仪对有无同步生物脱氮作用的两个试验组在不同注浆加固天数的尾砂试样进行三轴剪切试验,得到100 kPa围压下应力应变曲线如图9所示。
从两个试验组固结不排水三轴剪切试验所获得的偏应力与轴向应变关系曲线可知,两组试样应力随应变增长趋势与峰值应力基本相近,这说明在宏观力学特性上引入生物脱氮作用对微生物注浆加固作用没有影响。但两者在处于峰值破坏后的残余强度有所差异,这可能是微生物加固不均匀性以及制样时试样结构体存在差异所造成的。从图9中还可以看出,以注浆加固6 d为界限,在此之前尾砂试样曲线变化阶段与一般岩土体变化类型相似,存在4个阶段,即孔隙压密阶段、弹性变形阶段、非稳定破坏发展阶段和破坏后阶段。而在此之后,尾砂试样曲线变化阶段直接进入线性增长阶段,这表明在微生物胶结作用下尾砂试样大孔隙已被胶结晶体充分填充,使得细小颗粒无法移动,或是离散颗粒形成一个完整的整体。
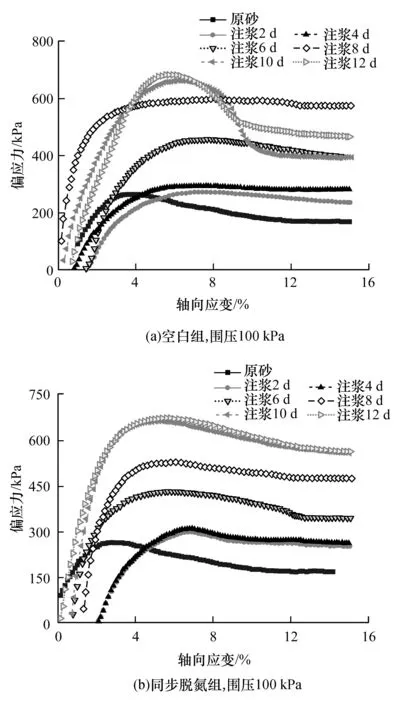
图9 应力应变关系曲线Fig.9 Stress-strain relationship curve
3.3.2 抗剪强度变化
以注浆加固天数为横坐标,尾砂试样的有效黏聚力和有效内摩擦角分别为左右纵坐标,绘制出尾砂试样抗剪强度参数与注浆天数的变化曲线关系如图10所示。
从图10可知,随着注浆天数的增加,两组尾砂试样的有效黏聚力均逐渐增加且增长规律相近,经过12 d的注浆加固增长幅度为283.77%和255.01%。从增长速率上来看,在注浆加固的前4 d,尾砂的有效黏聚力几乎没有发生变化,这是因为加固反应初期,胶结晶体生成量不足,无法在尾砂颗粒之间形成有效黏结体。在经过4 d胶结晶体积累后,尾砂颗粒之间开始形成有效黏结,有效黏聚力呈现直线型上升。同时,随着胶结晶体不断填充和胶结作用下,相邻尾砂颗粒之间的距离越来越小,使得相邻尾砂颗粒间的结合水受颗粒引力的吸附力增大,从而在一定程度上增加了黏结强度。
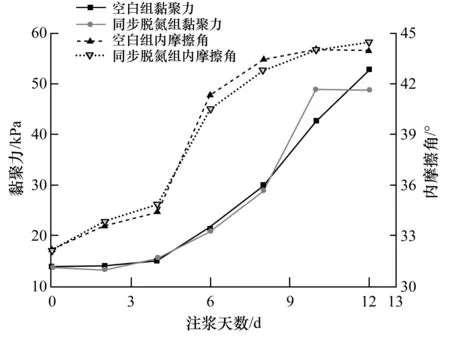
图10 尾砂抗剪强度参数与注浆天数的关系Fig.10 Variable curve of shear strength parameters with grouting days in the tailings
两组尾砂试样的有效内摩擦角均随着注浆天数的增加而逐渐增加且增长规律相近,经过12 d的注浆加固增长幅度为36.71%和38.24%。从增长速率上来看,有效内摩擦角的变化规律与有效黏聚力有所不同,在注浆加固初期,有效内摩擦角就随着注浆天数的增长开始增长,并在第4天~第6天呈快速增长,而后又逐渐趋缓。这是因为岩土体内摩擦角主要靠颗粒表面的摩擦力与颗粒之间的咬合力,随着注浆反应的开始,生成的胶结晶体附着在尾砂颗粒表面,提高了其表面粗糙程度以增加表面摩擦力,当颗粒表面的胶结晶体形成一定体积后,主要以提升颗粒之间的咬合力来提升试样的内摩擦角,使其进入快速增长阶段,后期的胶体晶体主要是用于建立尾砂颗粒之间的黏结,对内摩擦角的贡献不大,因而增长速率逐渐趋缓。
4 结 论
1)引入同步脱氮后MICP加固尾砂过程中氨氮浓度与空白对照组相比降低程度不显著。
2)引入生物脱氮作用对微生物注浆加固尾砂试样应力随应变增长趋势与峰值应力没有影响,但两者在处于峰值破坏后的残余强度有所差异。加固12 d后,尾砂有效黏聚力增长幅度为283.77%和255.01%,有效内摩擦角增长幅度为36.71%和38.24%。
3)为保证在尾砂微生物注浆环境下取得明显的微生物同步氨氮去除效果,仍需对TD-9菌株进行进一步的耐受高浓度氨氮驯化以及诱变育种研究,以获得耐受高浓度氨氮和钙离子且氨氮去除速率快的优势菌株。

