探讨血清lncRNA联合检测CEA、CA724、CA199在胃癌诊断中的临床意义*
吴雯婷,陈 惠,刘 毅,荣婷婷,沈立松
上海交通大学医学院附属新华医院检验科,上海 200092
胃癌(GC)是消化道最常见的恶性肿瘤之一。近期,世界卫生组织国际癌症研究机构(IARC)发布的全球最新癌症数据显示,2020年全球恶性肿瘤发病率GC排名第五,死亡率排名第四[1]。在我国,GC的发病率与死亡率仅次于肺癌,位居第二[2]。目前,GC的诊断依赖于内窥镜检查、病理检查和血清肿瘤标志物,主要包括癌胚抗原(CEA)、糖类抗原(CA)199、CA724、CA50等检测。内窥镜和病理检查虽然是GC诊断的金标准,但是由于其取材困难和患者痛苦较大,且血清肿瘤标志物的灵敏度与特异度不高,因此需要优化GC的诊断策略与检测手段。
长链非编码RNA(lncRNA)为不编码蛋白质的RNA,其长度超过200个核苷酸[3]。通过大量研究发现,IncRNA在GC、肝癌、乳腺癌、宫颈癌等多种肿瘤中都有表达失调的现象[4-6]。有研究报道,FOXD2-AS1、含铜胺氧化酶4的假基因(AOC4P)在多种癌症中如鼻咽癌(NC)、肝细胞癌(HCC)、GC等都可以升高。目前尚鲜见有关其在GC血清中表达的报道。本实验通过检测GC患者和健康对照者血清FOXD2-AS1、AOC4P以及肿瘤标志物CEA、CA199、CA724的表达水平,比较其差异,探讨血清FOXD2-AS1、AOC4P及其与CEA、CA199、CA724联合检测对GC的诊断价值。
1 资料与方法
1.1一般资料 选取2019年12月至2020年5月在本院住院治疗的经组织病理学确诊的GC患者80例作为研究对象,其中男46例,女34例,平均年龄(63.56±11.60)岁,并根据AJCC第八版进行TNM分期。纳入标准:(1)GC患者经病理确诊;(2) 入院时为初诊GC患者,且术前均未接受放、化疗治疗。另外选取在本院进行健康体检的体检健康者85例作为对照者,其中男42例,女43例,平均年龄(56.68±12.15)岁。
1.2仪器与试剂 血清总RNA提取试剂(德国QIAGEN公司);逆转录试剂(Takara公司);PCR扩增试剂(上海YEASEN公司)。 QuantStudioTMDx实时荧光定量PCR仪(美国ABI公司);NanoDrop 2000分光光度计(美国THERMO公司);Cobas 8000全自动化学发光仪(瑞士Roche公司);细胞培养箱(Revco);无菌超净台(Labconco);细胞培养液(DMEM,Hyclone,USA);胎牛血清(FBS,Gibco,USA)。
1.3方法 标本的采集及处理:采集所有研究对象外周静脉血3 mL,4 000 r/min离心5 min,将血清置于RNAse-free的Eppendorf管中,-80 ℃冻存备用。
血清RNA的抽提:使用血清总RNA提取试剂(德国QIAGEN公司)提取血清RNA,使用NanoDrop 2000分光光度计检测RNA的浓度和纯度,选取(A)值(A260/A280)在1.68~2.00的样本用于后续实验。
RNA的逆转录反应:根据逆转录试剂(Takara公司)说明书配置20 μL的反应体系进行逆转录反应,反应条件为37 ℃ 15 min,85 ℃ 5 s。合成的cDNA放-80 ℃冰箱冻存。
引物设计与合成:lncRNA RNU1和甘油醛-3-磷酸脱氢酶(GAPDH)引物由生工生物工程(上海)股份有限公司进行合成。引物序列见表1。

表1 引物序列
实时荧光定量聚合酶链反应(qRT-PCR):使用QuantStudioTMDx实时荧光定量PCR仪进行扩增,按照Hieff qPCR SYBR Green Master Mix(High Rox Plus)(上海YEASEN公司)试剂说明书进行反应体系的配置。反应体系如下:SYBER Green Master Mix 5 μL,上、下游引物(10 μmol/L)0.2 μL,cDNA模板1 μL,无菌超净水3.8 μL,共10 μL。反应条件如下:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 34 s,40个循环。所有实验重复3次,结果取其均值。通过熔解曲线评估扩增产物的特异度。应用2-ΔΔCt方法计算血清lncRNA相对表达量。
血清CEA、CA199、CA724检测:使用Cobas 8000全自动电化学发光分析仪(瑞士Roche公司)及其配套试剂对入组GC患者及健康对照者血清检测CEA、CA199、CA724的水平。
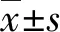
2 结 果
2.1FOXD2-AS1、AOC4P在细胞株中的表达及定位情况 FOXD2-AS1、AOC4P在6种不同GC细胞株中(BGC-823、SGC-7901、MGC-803、HGC-27、MKN-45、AGS)中均有表达,表明FOXD2-AS1、AOC4P可以作为GC诊断的潜在生物学标志。同时本研究进一步检测了这两种lncRNA在GC细胞株MGC-803的定位情况,实验发现FOXD2-AS1更多是在细胞质中表达,而AOC4P更多是在细胞核中。见图1。
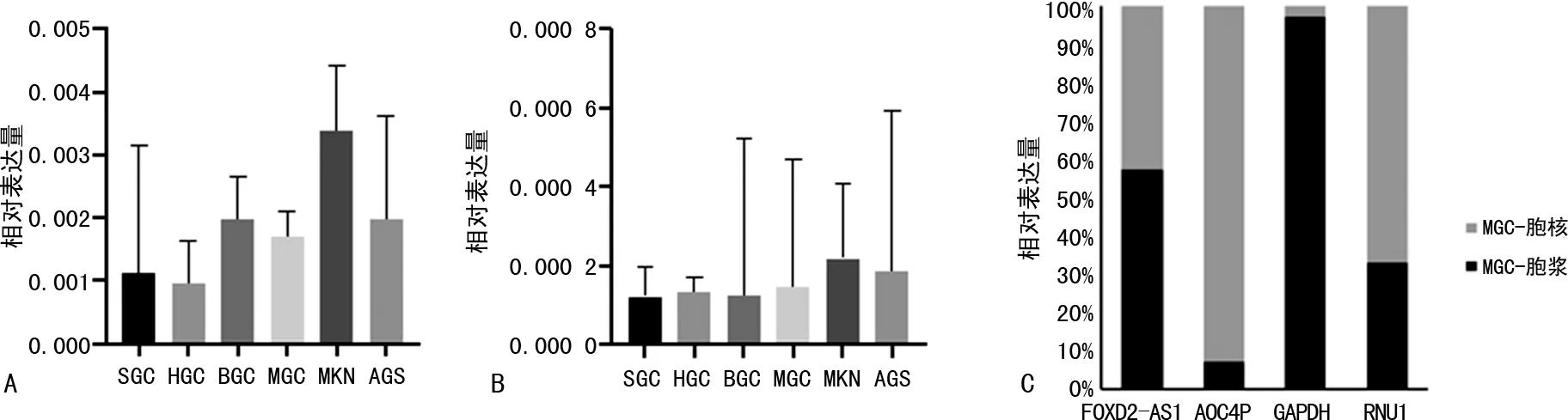
2.2GC组织与癌旁组织、GC患者与健康对照者lncRNA的表达差异 TCGA数据库显示,FOXD2-AS1在GC中明显增高,差异有统计学意义(P<0.01),见图4。另对16组GC组织及癌旁组织的AOC4P进行检测,结果显示AOC4P在GC中明显增高,差异有统计学意义(P<0.01)。对52例初诊GC患者、51例健康对照者血清FOXD2-AS1、AOC4P进行检测,FOXD2-AS1的相对表达量分别为0.054(0.033~0.085)和0.015(0.005~0.027);AOC4P的相对表达量分别为1.470(0.987~3.472)和0.093(0.030~0.677)。GC初诊患者血清FOXD2-AS1(Z=-6.636,P<0.01)、AOC4P(Z=-6.227,P<0.01)的相对表达量明显高于健康对照者。见图2。
注:A为FOXD2-AS1在不同细胞株中的表达;B为AOC4P在不同细胞株中的表达;C为FOXD2-AS1、AOC4P在细胞质和细胞核中的表达。
注:A为TCGA中FOXD2-AS1在GC组织及癌旁组织中的表达;B为AOC4P在GC组织及癌旁组织中的表达;C为FOXD2-AS1在GC及健康对照者中的表达;D为AOC4P在GC及健康对照者中的表达。
2.3GC患者和健康对照者CEA、CA199和CA724的表达差异 对52例初诊GC患者、83例健康对照者血清肿瘤标志物进行检测,发现差异均有统计学意义(P<0.05)。结果见表2。

表2 GC患者和健康对照者CEA、CA199和CA724的表达差异
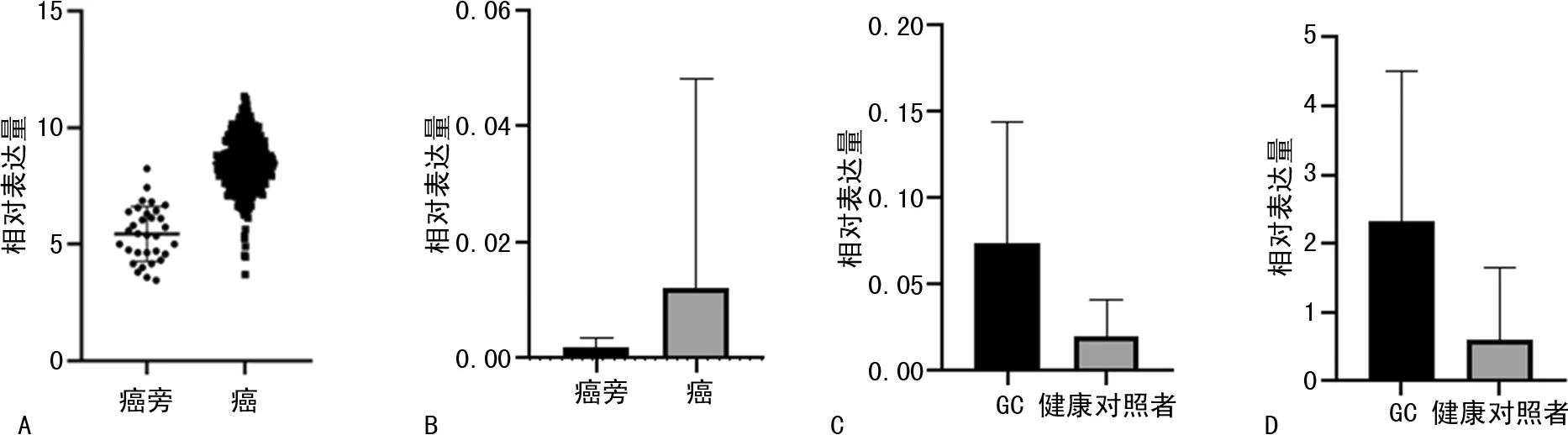
2.4血清FOXD2-AS1、AOC4P的相对表达量对GC的诊断效能 ROC曲线分析结果显示,FOXD2-AS1、AOC4P、CEA、CA199和CA724的曲线下面积(AUC)别为0.879、0.856、0.699、0.654和0.626;其灵敏度分别为90.38%、84.62%、40.38%、32.69%和67.31%,特异度分别为74.51%、76.47%、80.39%、96.08%和56.86%。见图3。

图3 GC患者血清FOXD2、CEA、CA199、CA724的单独ROC曲线分析
2.5血清FOXD2-AS1、AOC4P相对表达量与CEA、CA199、CA724联合诊断对GC的诊断效能 通过检测初诊GC患者血清FOXD2-AS1、AOC4P的相对表达量和CEA、CA199、CA724的浓度,分别计算FOXD2-AS1、AOC4P与CEA、CA199、CA724联合诊断的GC的灵敏度、特异度。用多元Logistic回归模型预测FOXD2-AS1、CEA、CA199和CA724联合检测诊断GC时的AUC最高为0.917,灵敏度和特异度分别为94.23%和74.51%,见表3及图4。
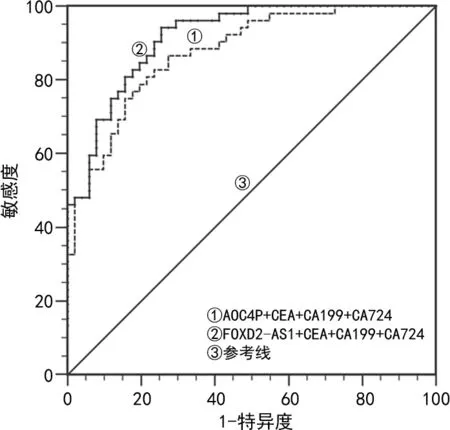
图4 FOXD2-AS1、AOC4P与CEA、CA199、CA724联合诊断的ROC曲线

表3 FODX2-AS1、AOC4P、CEA、CA199及CA724的单独或联合诊断效能
2.6GC患者血清FOXD2-AS1、AOC4P表达水平与临床病理特征的关系 分析GC患者血清FOXD2-AS1、AOC4P的表达与临床病理特征的关系,发现其与年龄、TNM分期、淋巴结转移均无明显相关性(P>0.05)。结果见表4与表5。

表4 GC患者FOXD2-AS1表达水平与病理特征的关系
续表4 GC患者FOXD2-AS1表达水平与病理特征的关系
表5 GC患者AOC4P表达水平与病理特征的关系
3 讨 论
GC是起源于胃黏膜上皮细胞的恶性肿瘤,由于GC早期症状隐匿,缺乏比较可靠的早期诊断标志物。目前我国临床诊断GC仍依赖于内窥镜、病理检查以及血清肿瘤标志物的检测,但血清肿瘤标志物灵敏度和特异度不高,内窥镜筛查率低,导致多数患者在确诊时已经处于中晚期,其5年存活率仅25.00%[7]。因此,深入研究GC的发病机制和探索新型分子生物学标志物对GC的早期诊断及治疗有重要意义。
有研究发现,lncRNA可以通过调控肿瘤相关基因的产生、转录水平和转录后水平等方面,最终影响GC细胞的增殖、分化、凋亡、侵袭和转移等[8]。血液样本因其易获得且低侵袭性等优点被视为更理想的检测样本,可用于检测各项指标从而能够早期发现癌症并对患者进行预后预测[9-10]。有报道证实,外周血中lncRNAs性质稳定,表达水平不受外源性RNA酶和温度改变的影响[11-12]。
AOC4P是长度为2 073 bp的lnc RNA,目前为止AOC4P的功能只在结肠癌和肝细胞癌中进行了研究[13-14]。在结肠癌中,AOC4P(也称为 UPAT)在高致肿瘤结肠癌细胞中通过调节蛋白质的普及和降解参与癌细胞的表观遗传调节[14]。在肝癌中,AOC4P表达降低是疾病预后不良的因素之一,可以作为肝癌的独立预后因子[15]。目前尚未见AOC4P在血清中的表达与GC相关性的研究。而本研究通过实验发现AOC4P在不同GC细胞株中均可表达,表明AOC4P可以作为GC诊断的潜在生物学标志物。本研究还通过实验发现AOC4P大多是在细胞核中表达,但是血清中AOC4P的表达并不低。AOC4P可能通过外泌体释放入细胞外和体液中。有研究发现,外泌体可以帮助细胞核中的lncRNA释放入外周循环[16]。转移是一个多步骤的过程,包括肿瘤细胞侵入原肿瘤部位的局部组织,侵入血液和淋巴血管,以及转移地点的适应和增殖。有证据表明,外泌体参与所有转移过程[17]。
FOXD2-AS1位于 1p33 染色体,与癌症的恶化和进展有关。有研究报道,FOXD2-AS1在几种癌症中如鼻咽癌(NC)、肝细胞癌(HCC)、GC等都可以升高[18-20]。然而,FOXD2-AS1表达与癌症临床病理特征之间的关联仍然具有争议性。XU等[20]发现FOXD2-AS1表达与肿瘤大小、TNM阶段和淋巴转移有关,但与性别、年龄的差异无关。SU等[21]报告说,高FOXD2-AS1表达与淋巴结转移和分化无关。本实验结果显示FOXD2-AS1与年龄、TNM分期和淋巴结转移无关,与上述研究结果相符。但是本课题研究的是血清中的FOXD2-AS1的表达,与组织中的FOXD2-AS1研究结果可能不一致。并且由于标本量小,因此需要扩大标本量深入探讨FOXD2-AS1和AOC4P与临床病理特征之间的关系。
本研究发现,GC初诊患者血清中 FOXD2-AS1和AOC4P的相对表达量明显高于健康对照者,说明二者对诊断GC有明显的临床价值。
另外,本研究通过ROC曲线分析,结果显示FOXD2-AS1和AOC4P的曲线下面积AUC别为0.879和0.856,而单独检测CEA、CA199、CA724的曲线下面积仅为0.620、0.595和0.634,说明lncRNA相比较传统的肿瘤标志物能更好地作为区别GC患者与健康人群及对照人群的指标。本研究还分别分析了FOXD2-AS1与AOC4P与 CEA、CA19-9、CA724联合检测的诊断价值,结果发现FOXD2-AS1与CEA、CA199、CA724联合检测时AUC(0.917)、灵敏度(94.23%)最高,并且与单独检测各项目AUC相比差异有统计学意义。
本研究结果显示血清中FOXD2-AS1、AOC4P的表达水平可作为辅助GC诊断的良好指标,且FOXD2-AS1与CEA、CA199和CA724联合检测可提高对GC的诊断效能。但由于其致病机制尚不明确,且本研究病例数量较少,因此需要更大临床样本研究进一步证明。

