经正中裂联合左右侧入路完整切除肝尾状叶治疗小儿肝泡型包虫病1例报告
李 汗, 侯立朝, 王海久, 王 聪, 樊海宁
1 青海大学 研究生院, 西宁 810001; 2 青海大学附属医院 肝胆胰外科, 西宁 810001
包虫病是棘球绦虫寄生于人体及某些动物等宿主体内所致的一种严重的人畜共患性疾病,在我国主要分布于新疆、西藏、四川、青海等各地牧区。致病的包虫病主要是囊型包虫病和泡型包虫病,两类包虫均主要侵犯肝脏。其中泡型肝包虫危害性更大,主要体现在致病性更强、致残率和致死率更高[1]。晚期可能导致肝硬化、黄疸和肝功能衰竭[2]。泡型肝包虫病以出芽或浸润方式增殖[1],因类似于肿瘤生长方式,可侵入肝内血管引起周围组织感染和远处器官转移。目前肝泡型包虫根治性肝切除术作为治疗首选。本例肝泡型包虫侵犯S7段及整个尾状叶并包绕大部分下腔静脉,术中显露困难,容易出现大出血,而左右联合手术入路均不能很好地显露并切除病灶,笔者采用经正中裂入路联合左右侧入路的手术方式切除病灶,取得了很好的治疗效果。现报道如下。
1 病例资料
患者女性,9岁,2020年7月于达日县桑日麻乡卫生院体检行腹部超声提示:肝占位性病变,考虑肝泡型包虫病。患者院外规律口服“阿苯达唑(0.1 g/粒),2 次/d,2 粒/次”治疗,期间患者无明显不适症状。2020年9月18日患者以“体检发现肝包虫病2个月余”收住青海大学附属医院。体格检查:全身皮肤黏膜及巩膜无黄染,腹部平坦,未见胃肠型及蠕动波,未见腹壁静脉曲张。腹软,无腹肌紧张,腹部无压痛及反跳痛,肝、脾肋下未触及,莫菲征阴性。肝浊音界存在,移动性浊音阴性,无肾区明显叩痛。肠鸣音正常,未闻及气过水声及血管杂音。血常规:RBC 5.04×1012/L,WBC 6.27×109/L,PLT 374×109/L;凝血功能: PT 11.7 s,APTT 26.7 s;肝功能:ALT 17 U/L、AST 28 U/L、TBil 4.4 μmol/L、Alb 41.9 g/L、ALP 156 U/L;Child-Pugh分级:5分,A级;ICG-R15 4.8%。包虫IgG抗体阳性;粪便寄生虫/虫卵阴性。肝胆胰脾彩色多普勒示:肝内实性占位,考虑肝泡型包虫(图1a)。肝包虫动态CT、MRI增强示(图1b、1c):肝S1及S7段病灶,考虑肝泡型包虫,该病灶突出肝缘并压迫右肾及肝门。术前肝脏三维重建提示(图2):病灶侵犯肝S1及部分S7段,粘连并包绕下腔静脉270°,肝脏体积 1 018.79 cm3,肝脏内结节总体积60.70 cm3,肝S7段体积 133.23 cm3,剩余肝脏体积958.09 cm3。结合患者既往病史、包虫IgG抗体、影像学检查诊断为肝泡型包虫病(分期P3N0M0国际标准,PⅠ、Ⅷ0Ⅴ1M0新疆标准)。常规检查心、肺、脑、肾等重要器官功能无明显异常,无明确手术禁忌证。于2020年10月13日在全麻下行“开腹肝S7段+S1段切除术”。
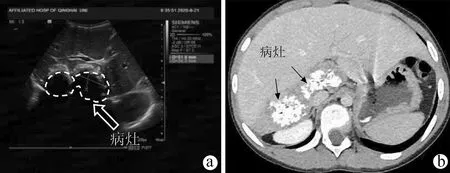
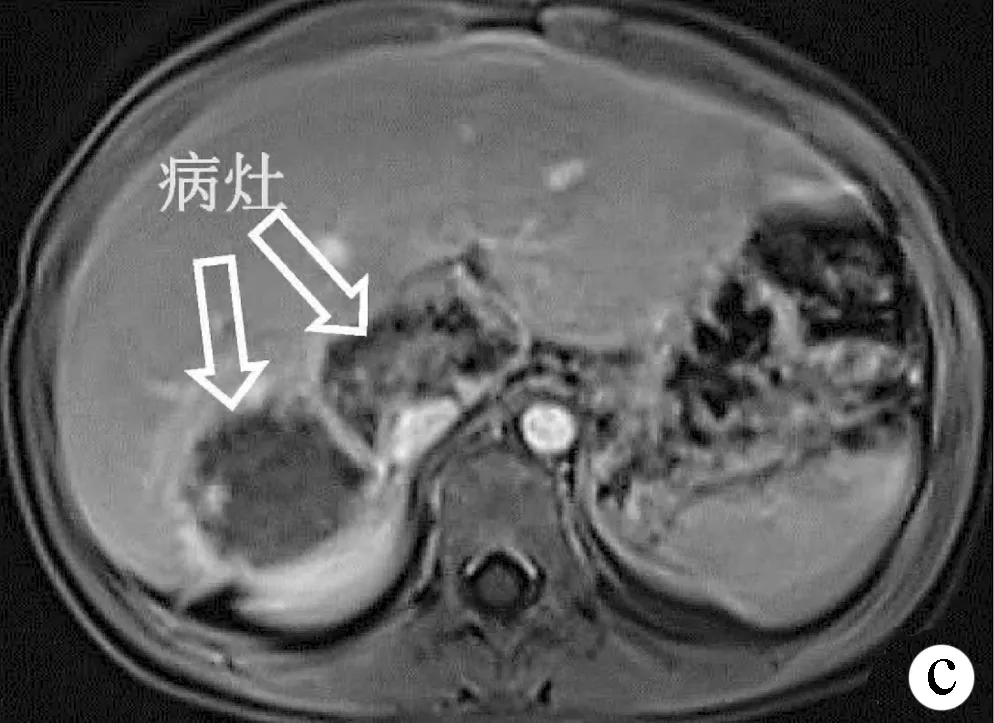
注:a,肝脏超声可见肝S1、S7段分别探及高回声结节,内部回声欠均匀(箭头);b,肝包虫动态CT增强静脉期可见肝S1~S7段团块状混杂密度影,其内见多发钙化影(箭头);c,肝包虫动态MRI增强静脉期可见肝 S1~S7 段团块样混杂信号影,边缘呈高信号(箭头)。
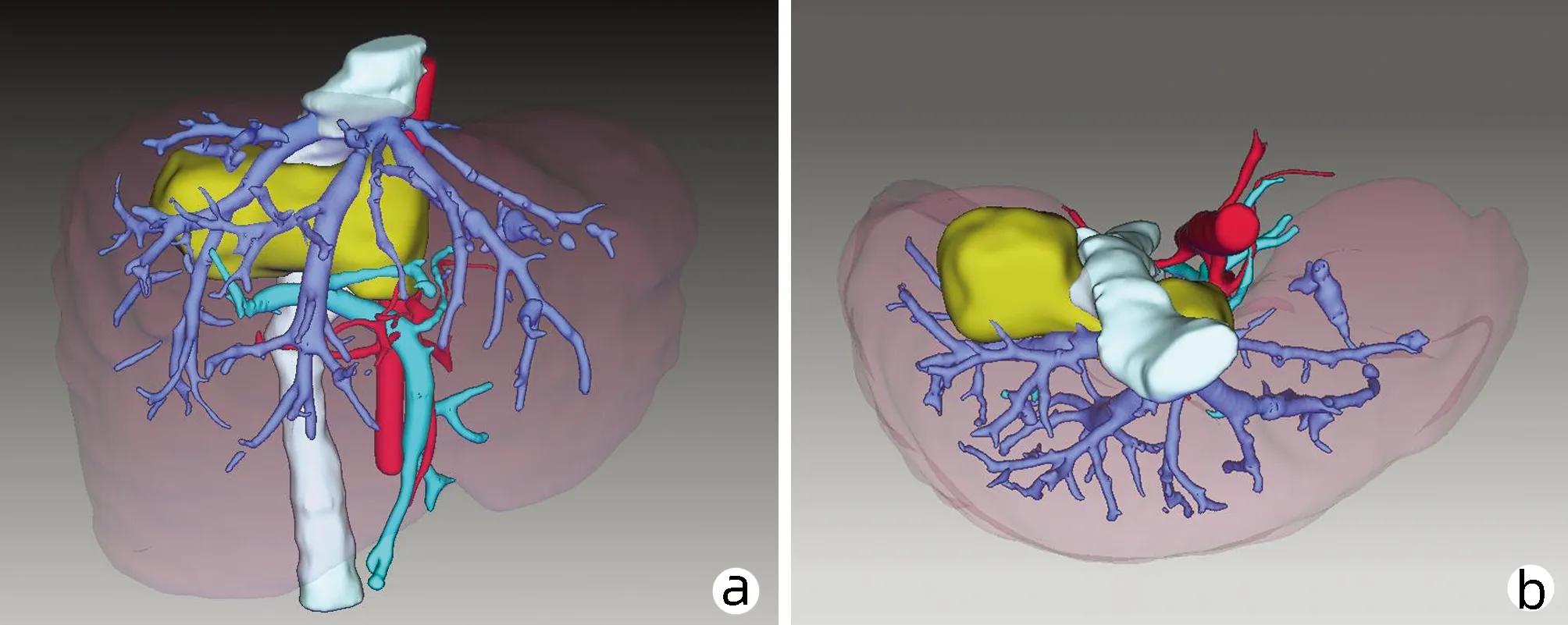
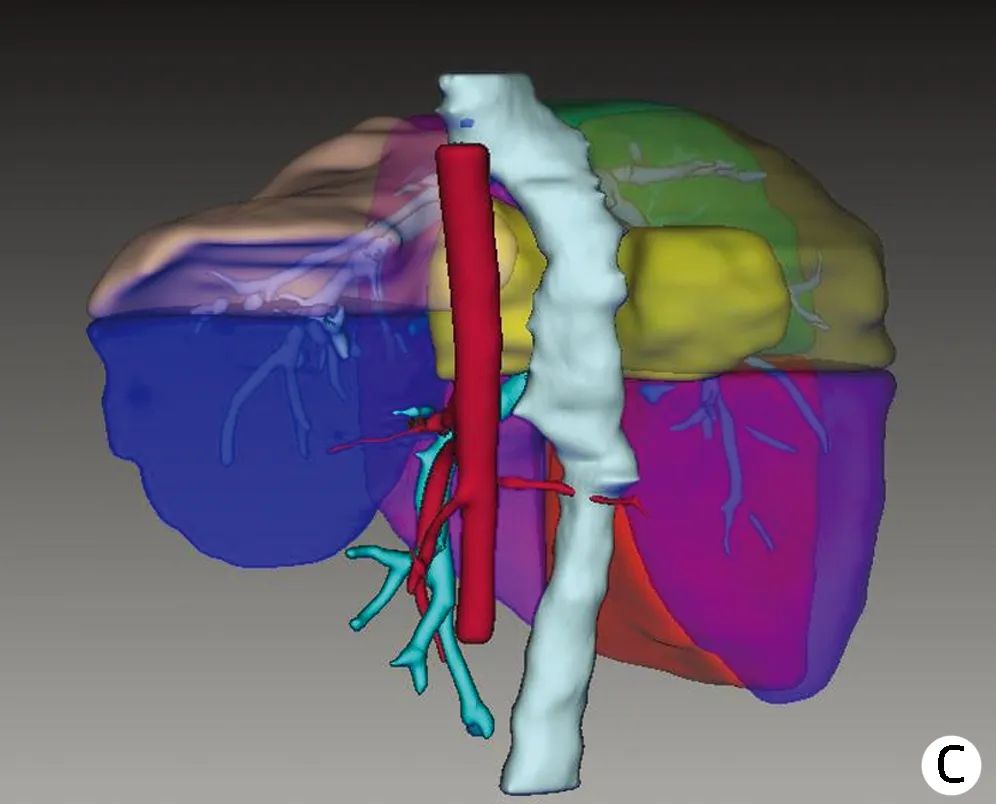
注:a,正面观(标记黄色部分为病灶);b,上面观(标记黄色部分为病灶);c,病灶与其余肝段的关系(标记黄色部分为病灶)。
手术方式: (1)取右上腹部反“L”形切口,长约15 cm,逐层切开入腹,切口置保护巾,放置肝脏拉钩,暴露术野。(2) 切断并结扎肝圆韧带,顺次游离肝周韧带,显露肝下腔静脉前壁及腔静脉凹。(3)koche切口向左侧掀起十二指肠,清扫No.16b1淋巴结(图3a、b)。(4)分别于肝上下腔及左肾静脉上方肝下下腔预置阻断带。(5)沿胆囊左侧缘(图3c)与腔静脉凹之间的肝脏脏面和膈面标记预切线,沿标记线用超声刀和CUSA从足侧向头侧逐层劈开肝实质,劈肝过程中保留肝中静脉分支V5、V4b及其汇合处(B点)(图3d),在肝中静脉右侧离断肝实质并切断结扎其余沿途血管。再沿肝中静脉背侧离断肝实质至Arantius管,将Spiegel叶从肝脏上游离下来。(6)将右肝向左掀起,在右肝静脉主干根部预置阻断带,距离病灶边缘1 cm处,沿着肝右静脉右侧及其背侧向左侧离断肝实质与中央汇合,将病灶从肝脏上完全游离下来(图3e)。至此,病灶仅与下腔静脉相连。(7)因病灶侵及并包绕下腔静脉270°,完全阻断肝后下腔静脉,阻断时间为26 min,采用“边剪边修补”的方法,用剪刀将病灶从下腔静脉前壁上剪下来(图3f),完整切除病灶,大小约8 cm×4 cm(图3g)。腔静脉壁缺损<1/3,用4-0 proline缝合腔静脉前壁,观察无明显狭窄(图3h)。冲洗术野,仔细止血,检查无活动出血及胆漏,创面贴附纤丝速即纱。于右侧膈下、肝断面中央,文氏孔后方分别放置腹腔引流管1根。术中失血约250 mL,补液1970 mL,输注300 mL红细胞悬液,输注170 mL血浆,尿量800 mL。术后予以心电监护密切关注生命体征;给予止血、保肝、抑酸及抗炎补液治疗。术后观察事项:生命体征是否平稳;腹腔引流管引出液性质及量;患者临床表现及体征,必要时给予对症处理,并酌情复查检验。
术后情况:患者术后体温波动在36.5 ℃~38.3 ℃。术后1周复查CT示:肝尾状叶、肝S7切除术后,术区多发渗出、积气及金属线影;正中及右侧腹壁皮下多发渗出;腹腔内置管(3根)(图4)。右膈下引流管引流出30~300 mL/d,文氏孔前方肝断面引流管引流出10~60 mL/d,文氏孔后上方肝断面引流管引流出30~150 mL/d,各引流管引流液均为淡血性液体,引流量逐日下降,于术后第14天拔除所有引流管。肝功能:TBil在手术第3天达到高峰(16.8 μmol/L);ALT、AST则在术后当天达到最高值(分别为491 U/L、1608 U/L);血常规:WBC于术后当天达高峰(23.04×1012/L);凝血功能:PT、INR在术后第1 天达到高峰(分别为15.5 s和1.31),APTT则在术后当天达到最高值(37.6 s)(表1)。患者手术3 d后肝功能、血常规、凝血各功能指标逐渐恢复正常。未出现肝功能不全等并发症,未发生术后出血、胆漏、肺部感染等其他特殊并发症,于术后第17天顺利出院。
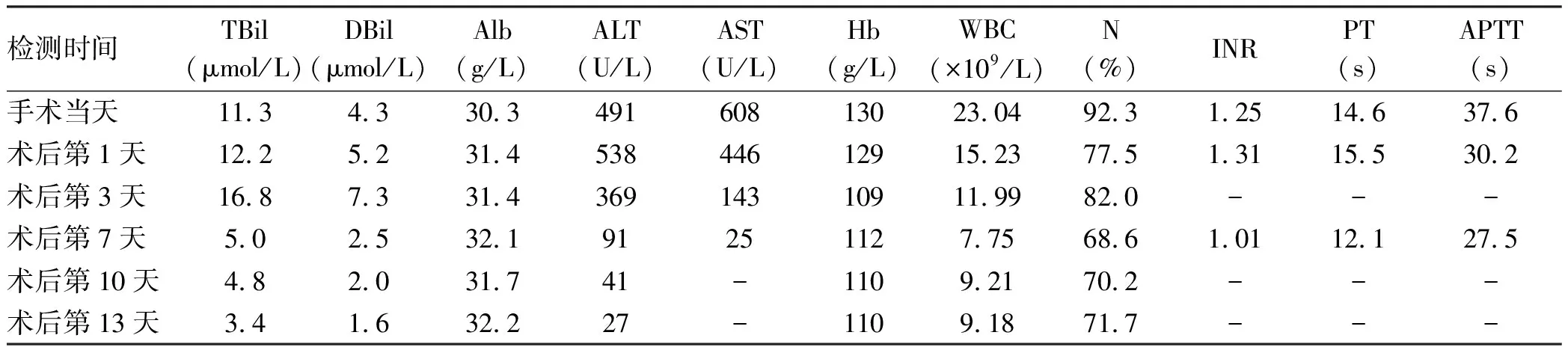
表1 术后血生化指标
术后病理诊断:(肝叶)肝泡型包虫病,淋巴结呈慢性炎症性改变,淋巴结可见包虫侵犯。
注:a,术中可见包虫淋巴结转移灶位于IVC左侧、LRV下缘;b,为术中切除的包虫淋巴结转移灶标本;c,于肝脏脏面、胆囊床左侧缘作预切开标记;d,劈开肝脏过程中保留了肝中静脉分支V5、V4b及其汇合处(B点);e,将病灶从肝脏上游离下来;f,将病灶从IVC前壁上切下来;g,从IVC上切下来的病灶标本;h,肝S7段、尾状叶完全从下腔静脉上分离下来后,可见修补后的IVC、RHV、第一肝门及其血流阻断带。
术后随访:患者术后继续规律口服“阿苯达唑”抗包虫治疗至少1年,平时未诉不适,生活质量及学习均未受到影响。术后随访至今(8个月)未见包虫复发。
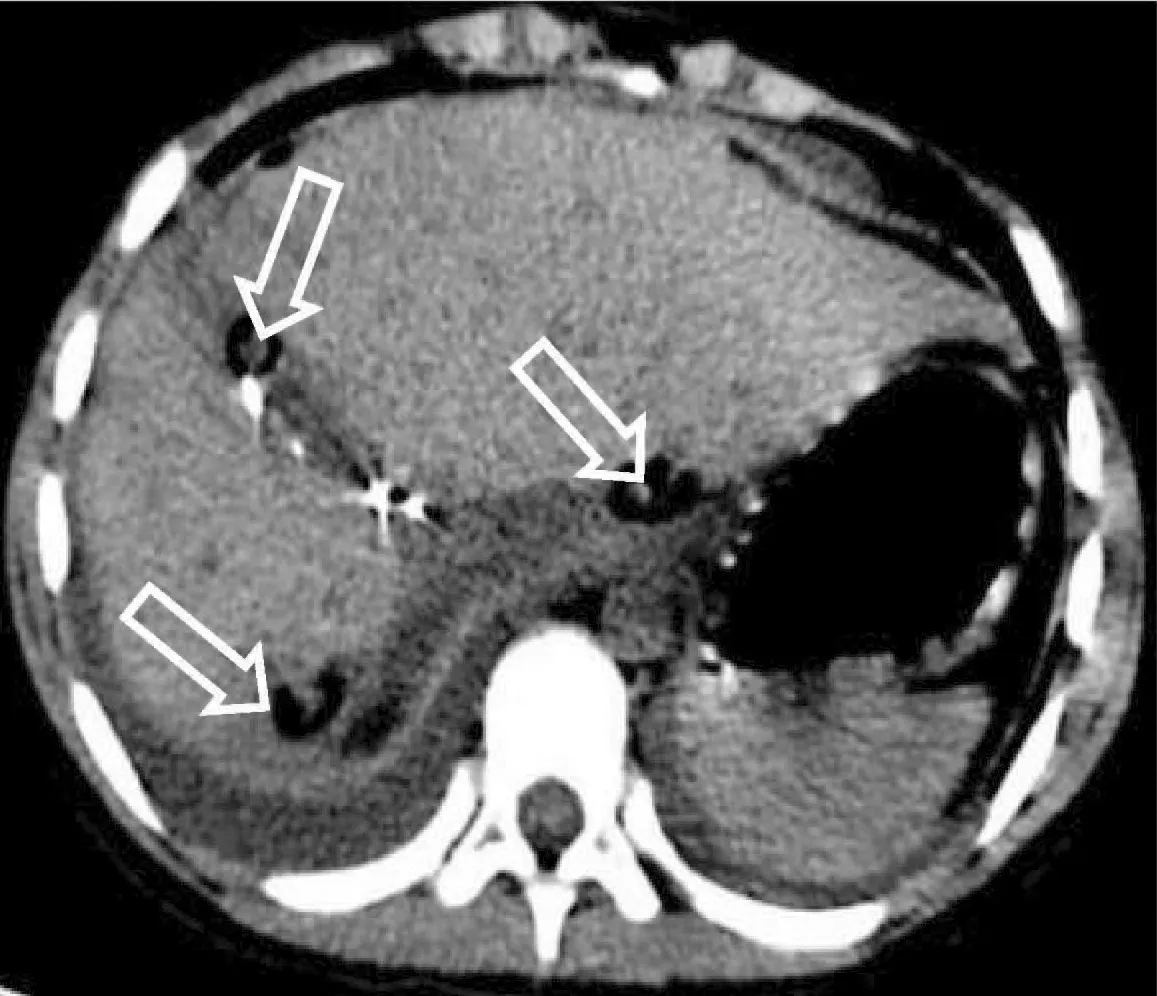
注:肝尾状叶、肝S7组织切除术后,术区多发渗出,正中及右侧腹壁皮下多发渗出;腹腔内置管(3根)(箭头)。图4 2020年10月20日复查腹部CT
2 讨论
肝尾状叶是由Spiegel叶、尾状突、腔静脉旁部三个部分组成,被3个肝门及下腔静脉包绕,操作过程中损伤这些结构可引起严重的并发症,因此需要对这些解剖结构有清晰的认识[3]。该区以往被列为手术禁区,也被称为肝外科的最后领域[4]。而随着对肝尾状叶解剖结构研究不断的深入,诊疗技术的提高,一系列外科技术的发展让肝尾状叶切除更加精准、安全、可控,使肝尾状叶切除不再是肝脏手术的禁区[5],极大降低了手术风险。
肝尾状叶病灶的手术入路应根据病灶位置、大小而有所不同[6]。而不同的尾状叶切除方式各有利弊。(1)左侧入路:适用于病灶主体在尾状叶Spiegel部,因行此入路可获得较好的手术视野并且管道结构较少[7],在游离腔静脉及切除Spiegel部也比较容易。但当肝尾状叶大部分或完全包绕下腔静脉时,此入路因解剖结构显露困难从而影响术中操作。(2)右侧入路:适用于病灶位于尾状突部,如果残肝体积足够也可联合右半肝切除。肝后下腔静脉窝因位置深与之汇合的静脉丰富有“血谷”之称[8],这也决定了术中如果血流阻断准备不充分、血管结扎不彻底或者线结脱落将会导致凶险性大出血。(3)正中裂劈开前入路:适用于位于尾状叶腔静脉旁部的巨大病灶[9]。腔静脉旁部被肝实质和肝后下腔静脉所覆盖,从肝表面无法辨识,当病灶紧贴下腔静脉并且粘连严重时,仅游离全肝并不能将病灶从下腔静脉上分离下来,则需从肝正中裂劈开肝实质彻底显露尾状叶。肝中裂是沿肝中静脉主干走行而存在的虚拟分界面[10]。此入路优势为:(1)经正中裂劈开肝脏再向左右两侧分离尾状叶病灶而不用切除肝实质,在切除尾状叶的同时可减少正常的肝切除量,尤其对于全身情况及肝功能稍差的患者,此方法无疑能减少术后肝衰竭等并发症的发生率;(2)经正中裂劈开肝脏显露左右肝蒂汇合部后,能很好地暴露结扎切断所有尾状叶的门静脉三联,由此肝尾状叶可完全从第一肝门分离出来[10];(3)此入路可兼顾左右侧尾状叶的游离,为尾状叶的切除提供了一个良好的手术操作空间,可使左右两侧的尾状叶直视下安全暴露分离并切除,避免了肝静脉及下腔静脉的损伤。不足之处在于断肝面较大,出血较多,术后胆漏发生概率较高[6]。
本例患儿因肝包虫瘤体包绕肝后下腔静脉270°,与肝后下腔静脉、肝静脉联系十分紧密且病灶巨大无法左右推动,采用单一左右侧入路法均难以充分显露术野,而良好的术野在手术中有着举足轻重的地位。选择正中裂入路,虽能很好显露术野,腔静脉旁部也可在直视下从下腔静脉上游离下来,但左右尾状叶的病灶较大且与周围组织关系密切,对于本病例,此入路并不能完全将整个尾状叶切除。因此选择经正中裂入路联合左右侧入路的手术方式,充分利用3种手术入路的优势,同时也规避了各自的不足。劈肝过程中,选择在肝脏腹腔面胆囊窝左侧开始切肝,这样选择的目的是保留了胆囊,因为本例患者为小儿,保留了胆囊意味着可提高患者术后的生活质量,这也符合外科手术的宗旨。在S4b与S5之间切开时,保留了肝中静脉B点分支“人字形”结构的V4b和V5,减少了术后肝淤血的发生率。另外,在将病灶从下腔静脉上游离下来之前,采用先行阻断肝后下腔静脉和肝下下腔静脉,再从足侧向头侧边切病灶边修补下腔静脉前壁的切口至彻底将病灶游离下来,这种手术方式可使术者在处理血管时更加安全可控。青海地区是肝包虫病的高发地,我院是包虫病的防治研究中心之一,有丰富的肝包虫切除经验。对于本例肝包虫转移至第16组淋巴结却未见病例报道。考虑是从肝脏病灶转移而来,因此术中完整清除了沿途淋巴结,切断了肝包虫转移途径,同时也降低了术后肝包虫复发转移的风险。术后病理证实包虫侵犯淋巴结,但WHO-IWGE提出的PNM分型[11-13]和中国温浩团队提出的PIVM分型[13]均未对包虫淋巴结转移情况进行说明及分型。术中淋巴结是否需要清扫,有待进一步研究和讨论。
通过本病例,笔者的体会如下。(1)术前:评估患者肝功能及全身情况,严格把握手术适应证及禁忌证;根据腹部CT、MRI明确病灶位置、大小、与周围组织关系,如果病灶较大复杂,需要联合肝切除时,可行三维可视化技术计算残肝体积,术前模拟手术切除并由此选择合适的手术方式,避免术后出现小肝综合征;对术中可能出现的问题提前做好充分准备。(2)术中:有效的脉管结扎能减少出血的风险,降低因失血过多给患者机体带来的打击。术中可以应用血流控制技术如预置血流阻断带和降低中心静脉压来达到减少肝血窦出血和预防大出血的目的;尾状叶腔静脉旁部腹背侧有肝实质和肝后下腔静脉所覆盖,与右后叶肝段分界不清,此时可以从右后叶门静脉支穿刺注入染色剂,对尾状叶进行“反染”,这样未被染色的尾状叶和被染色的肝右后叶就可以辨识了;另外肝包虫有术后种植转移的风险,因此要最大程度避免病灶残留,术中精细操作防止腹腔种植,注意对周围组织的保护。如果术后出现复发,再手术的难度较前明显增加,术后患者生活质量也显著降低。术者完成该术式还要熟练掌握绕肝提拉法、联合IVC重建的肝尾状叶切除、逆行肝尾状叶切除的肝胆外科技能。(3)术后:合理的应用ERAS理念促进患者机体的恢复,降低术后并发症的发生率;术后肝功能不全是肝切除术后最常见和最凶险的并发症[14],因此应该高度重视术后护肝治疗和肝功能监测;密切关注腹腔引流液的量与颜色,及时发现肝术后胆漏或感染等并发症,当患者出现发热、白细胞升高时应行胆汁或引流液培养。
综上,对于尾状叶手术入路还有左右侧联合入路、左右侧入路联合绕肝带旁侧入路、前入路联合左侧入路、逆行入路,但是不管是哪种手术入路都要根据患者病情的实际情况而定。尾状叶切除要求术者有良好的肝脏解剖基础、精湛的肝胆外科技术,并且要“严于术前,精于术中,勤于术后”[15]。目前腹腔镜微创外科在肝胆外科中的应用日益成熟,其放大作用在尾状叶细小血管处理中展示了腹腔镜独特的优势。随着3D腹腔镜技术、术中ICG荧光引导下的肝切除技术出现,可以看到,未来肝尾状叶切除将更加精准、更加微创。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李汗负责课题设计,资料采集与分析,撰写论文;樊海宁、王海久、王聪参与对文章的知识性内容作批评性审阅;侯立朝参与文章批评性审阅并指导撰写文章并最后定稿。

