甲状腺髓样癌合并乳头状癌1例并文献复习
马 强,梁春立
同济大学附属东方医院甲状腺外科,上海 200120
甲状腺癌是内分泌系统中最常见的恶性肿瘤。根据肿瘤起源及分化差异,甲状腺癌又分为:甲状腺乳头状癌(papillary thyroid carcinoma, PTC)、甲状腺滤泡癌(follicular thyroid carcinoma, FTC)、甲状腺髓样癌(medullary thyroid carcinoma, MTC)以及甲状腺未分化癌(anaplastic thyroid cancer, ATC)[1]。PTC 起源于滤泡上皮细胞,占全部甲状腺癌的85~90%,预后较好;MTC 来源于甲状腺滤泡旁细胞,约占1~2%左右[2-3]。临床上MTC 合并PTC 非常罕见,具体机制尚不清楚。由于MTC 和PTC 的治疗原则存在不同,因此尽早明确MTC 合并PTC 的诊断,有利于制定合理的治疗方案。
1 病例资料
患者,女,56 岁,因发现双侧甲状腺占位入院。患者因腹泻来院就诊,行胸部CT检查发现右侧甲状腺占位,遂来我科门诊就诊。患者自诉偶有胸闷,伴腹泻、多汗、面部潮红10 余年,无声音嘶哑、饮水呛咳、吞咽困难等症状。专科检查:颈软,两侧不对称,气管向左移位;右侧甲状腺Ⅲ度肿大,右叶可触及直径约5.0 cm×3.0 cm 大小肿块,质韧、表面光滑、无压痛;甲状腺左叶未触及明显肿块;双侧颈部未触及肿大淋巴结。甲状腺彩超显示:双侧甲状腺内见数个低回声肿块,右叶见大小52.0 mm×28.0 mm肿块,形态规则,边缘清楚,内部回声降低,分布不均匀(图1A);左叶结节大者大小7.0 mm×6.0 mm,直立性生长,形态规则,边界欠清,内部回声降低,伴有点状钙化(图1B);彩色多普勒血流成像(CDFI)未见明显血流信号改变;甲状旁腺区未见明显异常;双侧颈部淋巴结未见异常;诊断结论:甲状腺左叶结 节TI-RADS Ⅳb 类,右 叶 结 节TI-RADS Ⅲ类。FT3:3.1 ng/mL,FT4:1.5 μg/dL,TSH:1.1 μIU/mL,PTH:3.8 pmol/L,血 钙:2.1 mmol/L,降 钙 素:>2000.0 pg/mL,癌 胚 抗 原(carcino-embryonic antigen,CEA):132.0 ng/mL,胃 泌 素 释 放 肽 前 体(progastrin releasing peptide,pro-GRP):440.0 ng/mL,肾上腺素:33.3 pg/mL。颈部增强CT:双侧颈部未见异常肿大淋巴结。腹部超声:肝脏、胆囊、胰腺、脾脏、肾脏和肾上腺区未见明显异常。患者否认颈部辐射暴露史及甲状腺恶性肿瘤家族史。临床诊断:双侧甲状腺占位,髓样癌可能。
患者于2020年03月24日全麻下行甲状腺全切术+双侧颈部中央组淋巴结清扫术,术中病理诊断:左侧甲状腺微小乳头状癌(直径0.5 cm,0.4 cm);右侧甲状腺髓样癌(HE染色见图1D-E)。免疫组化结果:刚果红染色(+),CD56(+),Syn(+),CgA(+),降钙素(+),CEA(+)(图1G-L),Ki-67(+4%),MC(-),S-100(-);中央组未见转移性淋巴结。患者术后病情稳定,术后第3 天降钙素和CEA 明显下降(降钙素:177.0 pg/mL,CEA:68.1 ng/mL),患者未出现声音嘶哑、饮水呛咳等症状,术后1 周出院。出院诊断:右侧甲状腺髓样癌,左侧甲状腺乳头状癌。术后3个月复查降钙素1.4 pg/mL,CEA:1.9 ng/mL,Tg<0.1 ng/mL;术后两年复查降钙素<0.5 pg/mL,CEA:2.1 ng/mL,Tg<0.1 ng/mL,颈部超声未见明显异常肿大淋巴结。目前,患者TSH 抑制治疗中,门诊定期随访甲状腺超声、甲状腺功能、Tg、降钙素和CEA。
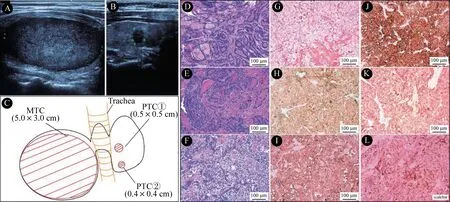
图1 甲状腺结节超声图像、结节分布模式图及术后病理结果Fig. 1 Ultrasound images, distribution diagram, and pathology results of thyroid nodules
2 讨论
MTC 和PTC 的细胞起源不同,临床特征、治疗策略和预后也明显不同。MTC 发病率低,MTC 合并PTC 更为罕见,约占甲状腺肿瘤的0.15%以下[4-5]。MTC 具有神经内分泌瘤的临床病理特征,能够产生多种多肽激素,包括降钙素、5-羟色胺、CEA、淀粉样蛋白、前列腺素等[6-7],部分患者会出现类癌综合征如腹泻、面部潮红、多汗等临床表现。本例患者伴腹泻、多汗、面部潮红10余年,属于典型的类癌综合征的症状。患者术前检查甲状旁腺区、肾上腺区未见明显占位,PTH、血钙和肾上腺素水平也正常,可以排除多发性内分泌肿瘤(multiple endocrine neoplasia, MEN)。
超声是甲状腺结节评估的首选检查,因MTC 在超声学上没有特异的表现,所以超声对于明确MTC合并PTC 诊断的作用有限,且可能导致漏诊或误诊。但是超声对于初步评估甲状腺结节以及颈部淋巴结的情况是不可缺少的。超声引导下细针穿刺活检(fine-needle aspiration guided by ultrasound,FNA)在超声不能鉴别良恶性的甲状腺结节中具有重要的作用[8]。增加对穿刺标本冲洗液中降钙素和CEA 的检测可以明显提高MTC 的诊断率[9-11]。美国甲 状腺协会(American Thyroid Association, ATA)2015 指南对于可疑MTC 推荐行FNA 穿刺标本冲洗液降钙素检测[8]。另外随着基因组学的发展,Afirma 基 因 组 测 序 分 类(genomic sequencing classifier, GEC)的应用,大大提高了MTC 阳性FNA样本检测的特异度和灵敏度[12]。血清学检查中降钙素及CEA 的检测可以提高MTC 的诊断率[13]。我国2012 版的指南[14]和ATA 2015 指南[8]对于甲状腺结节患者是否常规检测血清降钙素未持肯定态度,主要考虑MTC 的低发病率和降钙素检测的成本效益。最近有研究认为pro-GRP 可以作为MTC 的诊断指标。pro-GRP 是胃泌素释放肽的前体结构,其升高可见于包括MTC 在内的多种疾病,比如肾癌、尤文肉瘤等[15-16]。Marina 等[17]研究显示单独检测pro-GPR 对于MTC 的诊断灵敏度为88.9%,特异度为76.90%,pro-GRP 与降钙素联合检测,MTC 诊断的灵敏度可达到100.0%。本例患者右侧甲状腺结节超声学未见明显的恶性征象(图A),血清降钙素、CEA 以及pro-GPR 显著升高,高度考虑MTC 的存在;因右侧结节较大,未再行FNA,直接手术切除肿块,冰冻病理明确MTC的诊断。
MTC 合并PTC 的治疗方案目前尚无相关诊疗指南,国内外学者多建议兼顾两者的复发和转移风险决定治疗方式。对于MTC 的手术治疗,国内外指南一致认为甲状腺的切除范围应为甲状腺全切术。但也有研究认为对于单发、直径<1.0 cm、未浸润甲状腺被膜的散发性MTC 患者,行腺叶切除的生存率与甲状腺全切除术相比差异无统计学意义,且可以降低术后甲状旁腺功能减退、喉返神经损伤的发生率[18]。关于淋巴结清扫范围,对于cN0的患者,多行预 防 性 中 央 组 淋 巴 结 清 扫(central lymph node dissection,CND)[19];但是也有观点认为如果降钙素<20.0 pg/mL,肿块较小且位于腺体内,也可以不做CND[20]。对于cN0 的患者行预防性侧颈淋巴结清扫(lateral neck dissection, ND)存在较大争议[21]。ATA 认为应该根据血清降钙素的水平决定是否行预防性LND:如果降钙素>20.0 pg/mL,应行双侧CND 和同侧LND;如果降钙素大>200.0 pg/mL 应行双侧CND 和双侧LND[20]。Pena等[22]研究发现,对术前无侧颈淋巴结转移的患者行LND,其局部复发、远处转移和总体生存率对比豁免LND 组没有明显差异。本例患者MTC 合并对侧PTC,术前降钙素>2 000.0 pg/mL,术前超声和颈部增强CT 未发现异常淋巴结,手术行甲状腺全切术+双侧CND,未行预防性LND。
患者左侧两灶PTC,均为微小癌,中央组淋巴结未见明显转移,评估复发风险为低危,不推荐131I 治疗。患者术后进行TSH 抑制治疗,定期检查甲状腺功能、Tg、降钙素、CEA、颈部超声、胸部CT、腹部超声等。目前患者已随访两年余,Tg、降钙素和CEA均在正常范围内,其他检查也未见明显复发迹象。
综上所述,MTC 合并PTC 是一种非常罕见的甲状腺肿瘤。术前超声检查对于明确诊断缺乏特异性,需要结合降钙素、CEA 和pro-GPR 辅助诊断。FNA 穿刺冲洗液检测降钙素和CEA 可以提高MTC的诊断率。MTC 合并PTC 的治疗首选手术治疗,以甲状腺全切+双侧CND 为主,是否选择LND 需要根据MTC 和PTC 的危险度情况决定。本文通过病例分析和文献检索可为MTC 合并PTC 的诊疗提供借鉴意义。

